肺岩宁方对Lewis荷瘤小鼠肿瘤相关性巨噬细胞极化的调控作用研究*
2021-11-22张琦君邓海滨殷书敏徐振晔
张琦君,邓海滨,车 勇,殷书敏,徐振晔
(1.上海中医药大学,上海 201203;2.上海市虹口区江湾医院,上海 200434;3.上海中医药大学附属龙华医院,上海 200032)
肺癌属于祖国医学中“肺积”范畴,临床观察晚期肺癌患者常出现神疲乏力、形体消瘦、腰膝酸软、少气懒言、头晕耳鸣、气短而喘、自汗盗汗等肺肾精亏表现,徐振晔教授将其病机归纳为“精气亏虚,癌毒内蕴”,治疗上注重养精补肾,辅以益气健脾,协同抗癌解毒之品祛邪,研制“益气养精,解毒散结”中药复方——肺岩宁方。全方生黄芪补气温阳,白术甘温健脾,两药相合,补肺脾肾之虚;黄精益精填髓,淫羊藿合山茱萸补肾温阳,三药相合,阴阳并补,阴中求阳,阳中求阴;石见穿、山慈菇、蜂房、七叶一枝花、干蟾皮解毒散结,祛邪抗癌,诸药相合,攻补兼施、益气养精、解毒散结。临床研究发现,肺岩宁方使肺癌患者生存期、临床症状方面获益明显[1];基础研究发现其不仅能多靶点抗肿瘤生长、转移[2],还有调控肿瘤免疫微环境的作用,能降低肺癌患者CD4+CD25+Treg细胞比例、下调Foxp3 mRNA表达[3]及调节Treg/Th17细胞失衡[4]。在肿瘤免疫微环境中,肿瘤相关性巨噬细胞(tumor-associated macrophages,TAMs)作为主要的间质细胞之一,在包括肺癌在内的多种实体瘤中,其含量增高与肿瘤局部浸润、血管生成、缺氧、早期转移相关[5],已成为现今肿瘤免疫研究的热点之一,因此本研究进一步探讨肺岩宁方对肿瘤相关性巨噬细胞极化的影响,为其治疗肺癌的机制提供新的理论依据和参考。
1 材料与方法
1.1 实验动物 6周龄SPF级C57BL/6纯系雄性小鼠36只,体质量(20±2)g,由上海中医药大学动物实验中心代购于上海斯莱克实验动物有限责任公司,许可证号:SYXK(沪)-2014-008。小鼠在动物实验中心SPF级动物房饲养,室温(25±2)℃,采用食饲料饲养方式,自由进食与饮水,适应性喂养1周后开始实验,采用2%异氟烷吸入麻醉后,断颈处死动物。动物实验经上海中医药大学实验动物福利与伦理委员会审查,符合实验动物福利与伦理相关规范,伦理编号:PZSHUTCM190628010。
1.2 细胞株 小鼠Lewis肺癌细胞株购自中国科学院上海生命科学研究院细胞资源中心。
1.3 药物与试剂 肺岩宁方组方:生黄芪30 g,白术9 g,石见穿30 g,山慈菇12 g,蜂房9 g,干蟾皮6 g,淫羊藿15 g,黄精30 g,山茱萸15 g,灵芝15 g,七叶一枝花9 g,14剂中药共计生药2 520 g,于上海中医药大学附属龙华医院中药房进行标准化水煎提,水煎液经醇提后将药物浓缩至生药含量为2 g/mL,-80 ℃保存备用。超敏聚合酶免疫化学检测试剂盒(批号:20190315)、IL-4 ELISA试剂盒(批号:20190315)、IL-10 ELISA试剂盒(批号:20190315)(上海司鼎生物科技有限公司);CD68抗体(货号:A15037)(abclone公司);CD206抗体(货号:ab64693)、PD-1抗体(货号:ab214421)、PD-L1抗体(货号:ab238697)(abcam公司);PI3K抗体(货号:5405S)、C/EBPβ抗体(货号:3082S)(CST公司)。
1.4 主要仪器 DMI3000B荧光倒置显微镜(Leica公司);RM2235型病理切片机(上海徕卡仪器有限公司);HS1125型组织摊片机(浙江省金华市华速科技有限公司);5810R型冷冻离心机(Eppendorf公司);F50型酶标检测仪(Tecan公司);1645050型电泳仪(BIO-RAD公司);V370型扫描仪(EPSON公司)。
1.5 造模与分组 小鼠适应性喂养1周后,采用随机数字表法取16只C57BL/6小鼠分为正常对照组、正常肺岩宁组,每组8只。取余下20只C57BL/6小鼠进行造模,造模方法:取对数生长期小鼠Lewis肺癌细胞,消化、离心、重悬后制备成细胞密度为5.0×106/mL的细胞悬液,取0.2 mL注射于C57BL/6小鼠右腋部皮下,建立Lewis肺癌小鼠移植瘤模型,接种7 d后可触及瘤块即判定为造模成功。20只小鼠中有4只造模未成功,余下16只荷瘤小鼠随机分为模型对照组和模型肺岩宁组,每组8只。
1.6 实验给药 造模成功后开始给药干预,给药剂量根据人鼠体表面积折合法计算,约成人剂量的9倍[6]。正常肺岩宁组、模型肺岩宁组小鼠灌胃给予肺岩宁方,40 g/(kg·d)。正常对照组、模型对照组小鼠灌胃给予等体积生理盐水,1次/d,连续2周。末次灌胃禁食12 h后眼球采血,断颈处死,迅速剥离瘤体,分别保存备用。
1.7 观察指标
1.7.1 抑瘤率 剖取小鼠皮下瘤组织,电子天平称取瘤质量后分为两部分,分别用于病理和Western blotting检测标本。病理检测标本用4%多聚甲醛固定,Western blotting标本于检测-80 ℃液氮中保存。根据抑瘤率(%)=(1-实验组平均瘤质量/对照组平均瘤质量)×100%,计算抑瘤率。
1.7.2 免疫组化法检测瘤组织CD68、CD206表达情况 排除有坏死液化、增生肉芽的瘤体,最后每组取6只瘤体进行检测,将瘤组织置于多聚甲醛固定制作石蜡切片,将切片放置入二甲苯Ⅰ、二甲苯Ⅱ中脱蜡各15 min,再依次放入无水乙醇Ⅰ、无水乙醇Ⅱ、85%乙醇、75%乙醇中脱水各5 min,蒸馏水冲洗2次后置于含EDTA抗原修复缓冲液中,PBS洗涤3次后放入3%H2O2中室温避光孵育25 min,滴加3%BSA室温封闭30 min,滴加稀释浓度分别为1∶200、1∶400的一抗(CD68、CD206)4 ℃孵育过夜,滴加二抗室温孵育50 min,PBS洗涤3次后滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色,苏木素复染3 min,1%的盐酸乙醇分化5 s,自来水冲洗,氨水返蓝,流水冲洗后依次放入75%乙醇、85%乙醇、无水乙醇Ⅰ、无水乙醇Ⅱ中各6 min,再放入二甲苯Ⅰ中脱水5 min,切片晾干后中性树胶封片。染色后以CD68、CD206抗体在细胞膜上出现棕黄色为阳性判定标准。于龙华医院肿瘤研究所病理成像系统下采集组织切片图像,于镜下无特异性着色的不同区域,随即拍摄4个200倍镜视野,采用Image J图像分析软件进行CD68、CD206的平均光密度值(阳性面积%)计算,阳性面积%=IOD值/阳性面积。
1.7.3 ELISA法检测血清IL-4、IL-10含量 使用1.5 mL EP管收集各组小鼠血液标本,4 ℃3 000 r/min离心20 min,收集血清,2~8 ℃保存,48 h内进行检测。根据IL-4、IL-10试剂盒中步骤操作,计算出血清IL-4、IL-10含量。
1.7.4 Western blotting检测瘤组织PI3K、C/EBPβ、PD-1、PD-L1表达情况 每组随机取3只小鼠瘤体进行检测,提取瘤组织总蛋白样品,经SDS-PAGE分离蛋白后,将蛋白转印于PVDF膜上,5%的脱脂牛奶封闭1 h,加入一抗(1∶1 000)4 ℃过夜,TBST洗膜3次后加入二抗(1∶3 000)室温孵育1 h,TBST洗膜3次后显影曝光,图像扫描。采用Image J图像分析软件计算条带灰度值,将目标条带灰度值与内参灰度值对比表示目标蛋白相对表达量。
1.8 统计学方法 采用SPSS 24.0软件对各组数据进行统计学处理,计量资料以“均数±标准差”()表示,两组之间比较采用独立样本t检验,多组间比较采用单因素方差分析LSD-t法检验。所有统计均采用双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 抑瘤率 模型肺岩宁组小鼠瘤质量明显低于模型对照组(P<0.05),抑瘤率为60.59%。(见表1)
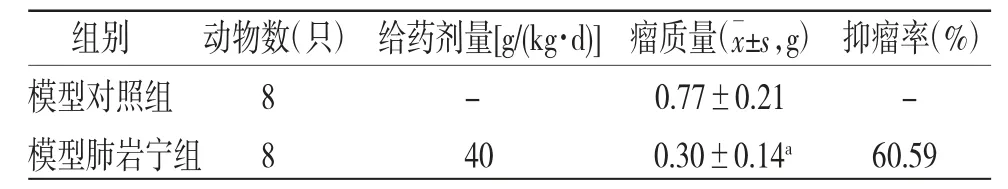
表1 两组小鼠皮下瘤质量及抑瘤率比较
2.2 两组小鼠皮下瘤组织中CD68、CD206表达情况 模型对照组小鼠肿瘤细胞膜周围CD68颗粒染色较少,CD206颗粒染色较多,表明其肿瘤组织中CD68蛋白表达较弱,CD206蛋白表达较强;而模型肺岩宁组肿瘤细胞膜周围CD68颗粒染色较多,CD206颗粒染色较少,表明其肿瘤组织中CD68蛋白表达较强,CD206蛋白表达较弱。(见图1)

图1 两组小鼠皮下瘤CD68、CD206 表达情况(免疫组化,×200)
模型肺岩宁组小鼠皮下瘤免疫组化CD68的平均光密度值明显高于模型对照组(P<0.05);CD206的平均光密度值明显低于模型对照组(P<0.05)。(见表2)
表2 两组小鼠皮下瘤免疫组化CD68、CD206 平均光密度值比较()

表2 两组小鼠皮下瘤免疫组化CD68、CD206 平均光密度值比较()
2.3 各组小鼠血清IL-4、IL-10含量比较 模型对照组小鼠血清IL-4、IL-10含量明显高于正常对照组、正常肺岩宁组(P<0.05);模型肺岩宁组小鼠血清IL-4和IL-10含量明显低于模型对照组(P<0.05)。(见表3)
表3 各组小鼠外周血清中IL-4、IL-10 含量比较(,pg/mL)

表3 各组小鼠外周血清中IL-4、IL-10 含量比较(,pg/mL)
2.4 两组小鼠皮下瘤组织中PI3K、C/EBPβ、PD-1、PD-L1表达情况 模型肺岩宁组小鼠皮下瘤组织中PI3K、C/EBPβ、PD-1、PD-L1表达水平明显低于模型对照组(P<0.05)。(见图2、表4)
表4 两组小鼠皮下瘤组织中PI3K、C/EBPβ、PD-1、PD-L1 表达水平比较()

表4 两组小鼠皮下瘤组织中PI3K、C/EBPβ、PD-1、PD-L1 表达水平比较()
注:与模型对照组比较,aP<0.05

图2 两组小鼠皮下瘤PI3K、C/EBPβ、PD-1、PD-L1表达情况
3 讨 论
在肿瘤微环境中,围绕肿瘤细胞为中心,肿瘤间质细胞和细胞外基质形成了一个复杂的、动态的网络环境,无时无刻不影响着肿瘤的发生、发展和转移。肿瘤相关性巨噬细胞(TAMs)作为肿瘤间质细胞中的主要细胞之一,在缺氧、肿瘤细胞和各种免疫细胞诱导及各种细胞因子的作用下发生表型改变,对肿瘤产生双重作用[7]。TAMs根据其功能可分为M1型(经典激活,classically activated)及M2 型(选择活化,alternatively activated)两类[8]。M1型巨噬细胞表达高水平的促炎症细胞因子如IL-1、IL-6、IL-12与TNF,并通过产生活性氮和活性氧,参与炎症反应,具有高度抗原提呈,高表达MHCⅡ和促进Th1反应的能力[9]。相反,M2型巨噬细胞,产生少量的促炎细胞因子及大量抗炎细胞因子如IL-4、IL-10,高度表达甘露糖受体(CD206)和清道夫受体(CD163),通过精氨酸酶途径增加鸟氨酸和多胺的释放,消耗T细胞增殖所需的代谢物精氨酸,从而抑制T细胞介导的适应性免疫反应[10],其功能异常激活可引发过敏反应、促进肿瘤生长、延缓对病原体的免疫反应等[11-12]。在肿瘤微环境中TAMs通常具有M2型,促进Th2淋巴细胞和Treg细胞分化和招募,促进肿瘤增殖、生长、转移、血管生成,降低机体主动免疫反应,为肿瘤浸润、转移提供适宜的免疫环境[13]。TAMs的异质性并非一成不变,其极化具有可逆性及可调节性,可随肿瘤免疫微环境中的肿瘤免疫应答而重塑,某些中药单体就具有逆转M2型TAMs向M1型转化的作用[14]。
中医药整体观念的思路与肿瘤免疫治疗的理念不谋而合,通过对机体微环境的调节作用,逆转肿瘤免疫逃逸的状态,改善肿瘤微环境中的关键细胞及其功能,从而发挥抗肿瘤、抗转移复发的作用[15]。就如“种子-土壤”学说中所阐述,肿瘤细胞如同种子,种子是否生长有赖于所处土壤即肿瘤微环境是否适宜其生长发展与转移,而中医药整体调节的理念恰恰解释了其通过对肿瘤微环境的调节达到抑瘤抗转移的目的。在本研究中,我们加入了正常肺岩宁组以观察肺岩宁方对正常小鼠免疫微环境的调节作用,检测结果显示与模型对照组小鼠比较,肺岩宁方灌胃后的正常小鼠外周血中免疫抑制性细胞因子IL-4、IL-10水平降低,提示肺岩宁方可能通过对细胞因子的调节,改变了“土壤”的免疫微环境,抑制了M2型TAMs生成所需的免疫抑制性细胞因子产生,不利于肿瘤细胞的种植、生长和增殖。经肺岩宁方干预2周后,与模型对照组比较,模型肺岩宁组小鼠皮下瘤M1型TAMs表面抗原CD68阳性表达明显增多,M2型TAMs表面抗原CD206阳性表达明显减少,同时降低了外周血中免疫抑制性细胞因子IL-4、IL-10的含量,提示肺岩宁方可通过对肿瘤免疫微环境中关键细胞因子的调节影响TAMs极化。
在肿瘤发生发展过程中,巨噬细胞PI3Kγ信号通路在抑制NF-κB活化的同时刺激C/EBPβ活性,触发转录程序从而促进肿瘤免疫抑制,在荷瘤小鼠模型中,选择性抑制TAMs中PI3Kγ、C/EBPβ活化可恢复CD8+T细胞毒性,并协同PD-1抑制剂发挥抑瘤作用[16]。该通路同时也影响TAMs极化,如中药单体大黄素通过抑制巨噬细胞招募及逆转M2型TAMs生成减少乳腺癌小鼠肺转移,其机制与降低C/EBPβ的表达相关[17]。另有文献显示TAMs可表达PD-1、PD-L1[18],并影响其极化,调节细胞因子分泌如IL-10、IL-12等,调控TAMs表面标志物表达[19]。中药补肺汤通过下调IL-10,阻断PD-1表达,下调CD206+TAMs,抑制非小细胞肺癌的生长[20]。本研究利用Western blotting检测小鼠皮下瘤中PI3K、C/EBPβ、PD-1、PD-L1的表达水平,也得到了与上述文献一致的结果。
综上所述,肺岩宁方可能通过降低免疫抑制性细胞因子IL-4、IL-10分泌,抑制PI3K/C/EBPβ和PD-1/PD-L1信号通路,调控肿瘤微环境中TAMs极化,促使其表型向M1型转变,从而发挥抑瘤作用。
