与SARS-CoV有交叉免疫反应的SARS-CoV-2 S蛋白B细胞抗原表位预测
2021-11-19高竞溪高珂星鲁非纪锋郭志刚
高竞溪 高珂星 鲁非 纪锋 郭志刚
(南京师范大学生命科学学院,南京 210046)
由SARS-CoV-2侵染机体引发的新型冠状病毒肺 炎(Coronavirus Disease 2019,COVID-19) 具 有较为强烈的人际传染能力[1-2],新冠疫情总体呈现暴发性流行趋势[3],给中国乃至世界带来了巨大损失。由于现阶段预防措施及治疗手段的不足,疫情难以控制,故疫苗和药物的研制已成为全球关注的焦点。SARS-CoV-2为RNA病毒,多呈球状,直径在60 nm-140 nm之间,且表现出部分多形性,外周分布有独特的尖峰结构(9-12 nm),整体呈日冕状[4]。SARS-CoV-2主要编码4种结构蛋白:棘突蛋白(spike protein,S)、核衣壳蛋白(nucleocapsid phosphoprotein,Np)、包膜蛋白(envelope protein,E)和膜蛋白(membrane protein,M)。其中 S蛋白是由S1和S2两个亚基组成的三聚体Ⅰ类融合蛋白,主要起介导病毒与细胞附着(S1)和囊膜与细胞膜融合(S2)的作用[5]。与SARS-CoV相似,SARS-CoV-2通过S蛋白识别并结合人类血管紧张素转化酶II(human angiotensin converting enzyme 2,hACE2)进而入侵机体[6-7],由此推测S蛋白对SARS-CoV-2的入侵、致病起到一定的调节作用,具有较高的研究价值。
冠状病毒是变异最快、最多样化的病毒群之一,SARS-CoV-2作为其中的一员具有快速突变的潜能[8],寻找其较为保守的区段,可以为研制具有相对广谱性的抗病毒药物和疫苗提供依据,对预防由冠状病毒变异引发的新问题起到关键性作用。本研究构建了基于SARS-CoV-2 S蛋白氨基酸序列的系统发生树以期探究SARS-CoV-2与SARS-CoV S蛋白的同源性,同时为预测S蛋白未来的演化方向与速率提供信息。
虽然SARS-CoV-2与SARS-CoV在基因结构和组成上存在较大差异[7],但二者同属于Sarbecovirus亚属SARS病毒种具有较近的亲缘关系。研究指出SARS-CoV-2 S蛋白的抗原决定簇与SARS-CoV S蛋白的抗原决定簇相似度较高[9-10],已有研究表明,从SARS-CoV痊愈者体内分离制备的SARS-CoV单克隆抗体S309可作为交叉中和SARS-CoV-2的抗体[11],二者互相佐证提高了本研究的可行性。S蛋白作为一个整体,各个表位的状态均有可能影响其结构与功能。现有研究多专注于S蛋白中结合功能性受体hACE2的抗原表位[12-13],而其他表位的相关研究信息却较少。由此,本研究分析了SARSCoV-2 S蛋白的氨基酸序列,并通过与SARS-CoV S蛋白氨基酸序列的比对确定了目标区段,进一步综合预测出可能的通用B细胞抗原优势表位。旨在为研究病毒介导的识别、结合、内吞[6]机制奠定理论基础,寻找通用抗体的精确靶点,为表位疫苗提供设计方向。
1 材料与方法
1.1 材料
从NCBI数据库(https://www.ncbi.nlm.nih.gov/)中获取不同国家地区SARS-CoV-2、SARS-CoV、MERS-CoV、HCoV-HKU1、HCoV-NL63、HCoV-229E毒株的S蛋白氨基酸序列。
1.2 方法
1.2.1 SARS-CoV-2株S蛋白系统发生树的构建 以多株不同冠状病毒为研究对象(表1),采用MEGA5.05软件中的Neighbor-joining法分析各毒株的S蛋白氨基酸序列并构建基于SARS-CoV-2 S蛋白氨基酸序列的系统发生树,应用MegAlign软件分析不同冠状病毒间的遗传距离。
1.2.2 SARS-CoV-2与SARS-CoV S蛋白的氨基酸序列对比及跨膜分析 采用MegAlign软件对表1中的SARS-CoV-2与SARS-CoV毒株S蛋白氨基酸序列进行比对分析;另采用TMHMM Server在线软件对SARS-CoV-2 Wuhan-Hu-1株(WHU01)的S蛋白进行跨膜分析。

表1 研究所用的冠状病毒株Table 1 Coronavirus strains used in this study
1.2.3 Wuhan-Hu-1株S蛋白整体及目标区段的三维结构预测 应用Phyre2在线软件(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测Wuhan-Hu-1株S蛋白整体及目标区段的三维结构,并应用Chimera软件模拟其三维立体结构。
1.2.4 Wuhan-Hu-1株S蛋白目标区段的B细胞抗原表位参数分析 以DNAStar软件Protean模块中的多种方法分别剖析Wuhan-Hu-1株S蛋白的目标区段,步骤如下:首先对目标区段的二级结构(Garnier-Robson法和Chou-Fasman法)、柔性区段(Karplus-Schulz法)、表面可能性(Emini法)进行预测;然后分析目标区段的亲水性指数(Kyte-Doolittle法),再预测其抗原指数和抗原表位指数(分别用Jameson-Wolf法和Kolaskar-Tongaonkar法(http://tools.immuneepitope.org/tools/bcell/iedb_input));最后,参考S蛋白的空间结构预测结果,在目标区段内综合预测可与SARS-CoV发生交叉免疫反应的SARSCoV-2 S蛋白B细胞优势抗原表位。
2 结果
2.1 SARS-CoV-2 S蛋白的氨基酸序列比对分析及系统发生树的构建
本研究以SARS-CoV-2 Wuhan-Hu-1株(WHU01)S蛋白和其他不同国家地区的人类冠状病毒S蛋白的氨基酸序列为分析对象,采用Neighbor-joining法(步长1 000,boot-strap值>60%)构建系统发生树,结果如图1所示。MegAlign软件分析指示:不同国家地区分离的SARS-CoV-2毒株S蛋白氨基酸序列存在极高相似性(99.9%-100%),Wuhan-Hu-1株S蛋白氨基酸序列与所列出的SARS-CoV参考株(QXC1、ExoN1、TC3、CHUKtc46NP、CHUKtc51L、CHUKtc55NS)S蛋白氨基酸序列的相似性为77.4%-77.5%, 与 MERS-CoV、HCoV-HKU1、HCoV-229E、HCoV-NL63毒株的相似性分别为30.2%、28.3%-28.4%、21.4%-21.5%、20.3%。结果表明不同国家地区间的SARS-CoV-2毒株S蛋白氨基酸序列差异性很小;SARS-CoV-2与SARS-CoV毒株的S蛋白氨基酸序列相似度相较于其他4种冠状病毒高两倍以上,指示二者的S蛋白中可能存在相似甚至相同的B细胞抗原表位。

图1 SARS-CoV-2及代表冠状病毒的S蛋白氨基酸序列系统发生树Fig.1 Phylogenetic tree of amino acid sequence of S protein in SARS-CoV-2 strain and other representative viruses of Coronavirus
2.2 目标区段的选择
分别以6个不同地区、不同时间取样的毒株为样本,进行SARS-CoV-2和SARS-CoV S蛋白的氨基酸序列比对,并对Wuhan-Hu-1株S蛋白进行跨膜分析进而选定目标区段。序列比对如图2所示,944-1 215区段相似度较高(95.6%),其中存在两段完全一致的连续区段(944-1 054、1 151-1 215位),指示此区域很可能存在二者共同的抗原表位。图3的S蛋白跨膜分析指示,1 237-1 273位氨基酸残基处于囊膜内侧,1 214-1 236位氨基酸残基处于跨膜区段,而1-1213位氨基酸残基则大概率位于膜外,位于膜外的区段更可能作为优势B细胞抗原表位。综合上述分析,本研究选取位于囊膜外且保守度最高的区段944-1 213(270aa),进行抗原表位分析,如图2红色方框所示。

图2 SARS-CoV-2 S蛋白与SARS-CoV S蛋白的氨基酸序列比对Fig.2 Sequence alignment of amino acid sequence of S protein in SARS-CoV-2 and SARS-CoV strain
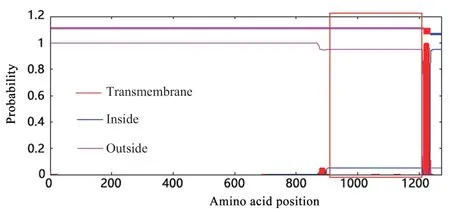
图3 Wuhan-Hu-1株S蛋白跨膜分析Fig.3 Transmembrane analysis of S protein in Wuhan-Hu-1 strain
2.3 Wuhan-Hu-1株S蛋白整体及目标区段的结构预测
使用在线工具Phyre2预测Wuhan-Hu-1株S蛋白及目标区段的三维结构。由图4-A可知,S蛋白整体呈现“Y”型,存在3个由β-折叠和α-螺旋组成的疏水核心。α-螺旋分布于S蛋白的局部区域,β-折叠多集中于蛋白内部,起连接作用的β-转角和无规则卷曲则广泛分布于蛋白的表面,由此推测S蛋白具有较强的可变性。目标区段分析结果图4-B显示,氨基酸序列前端和末端都存在α-螺旋且前端更长,局部存在β-折叠,中部存在较多的无规则卷曲和β-转角结构,指示该区域的部分区段具备作为优势B细胞抗原表位所需的结构特点。

图4 Wuhan-Hu-1株S蛋白整体及目标区段的结构预测Fig.4 Structure prediction of whole and target region of S protein in Wuhan-Hu-1 strain
2.4 Wuhan-Hu-1株S蛋白的抗原表位参数分析
柔性区段(Karplus-Schulz法)分析结果(图5-A)显示,Wuhan-Hu-1株S蛋白的944-1 213位氨基酸区域(目标区段)中柔性区段超过52%,占比较多且呈分散分布(表2)。
亲水性指数(Kyte-Doolittle法)分析(图5-B)指示,目标区段中具有亲水性的区段呈均匀分布,其中靠近羧基端的氨基酸序列所跨区段最大、具有最高的亲水性指数,表明该区段极有可能作为病毒的抗原表位。
表面可能性(Emini法)分析(图5-C)表明,目标区段整体的表面可能性较高,其中1 146-1 162氨基酸区段表面可能性指数最高且跨区最长(表2),指示该区段具有作为B细胞抗原表位的潜力。
Jameson-Wolf法预测结果(图5-D)显示,目标区段中均匀分布有多个抗原指数偏高的区段,其中位于1 136-1 171位的氨基酸区域抗原指数最高可达3.00,该区域同时也是跨区最大的区段(表2),指示其大概率可作为B细胞优势抗原表位。

表2 Wuhan-Hu-1株S蛋白目标区段的柔韧性、亲水性、表面可能性和抗原指数Table 2 Flexibility regions, hydrophilicity, surface probability and antigenic index of S protein target region in Wuhan-Hu-1 strain

图5 Wuhan-Hu-1株S蛋白目标区段抗原表位参数分析Fig.5 Analysis of antigen epitope parameters in the target region of S protein in Wuhan-Hu-1 strain
Kolaskar-Tongaonkar法分析结果图6显示,目标区段的抗原指数最小值为0.926,最大值为1.215,均值为1.040。
图6 Wuhan-Hu-1株S蛋白目标区段抗原表位指数分析Fig.6 Antigen epitope index analysis of the target region of S protein in Wuhan-Hu-1 strain
2.5 Wuhan-Hu-1株S蛋白目标区段的B细胞表位预测结果综合分析
综合目标区段内柔韧性、亲水性、表面可能性、抗原性、抗原表位指数的预测结果,如果抗原指数≥ 1.040(均值),表面可能性指数≥ 1,亲水性指数≥ 0,位于细胞膜外且其内部或附近存在β-转角、无规则卷曲等柔性区段,同时占据不少于6个氨基酸残基,则该区段最有可能作为目标抗原表位。结合结构预测结果,本研究从目标区段内共筛选出符合以上条件的8个优势抗原表位区段,如表3所示,推测这些区段作为SARS-CoV-2 S蛋白B细胞抗原表位较其他区域更具优势,且其中的部分区段大概率能引起SARS-CoV-2与SARS-CoV的交叉免疫反应。

表3 可与SARS-CoV发生交叉免疫反应的SARS-CoV-2株S蛋白B细胞抗原表位Table 3 B cell epitopes of S protein in SARS-CoV-2 strain which can cross-immunize with SARS-CoV
3 讨论
3.1 抗原表位的作用
抗原表位通常为位于抗原分子外表面上较松散、易扭曲的区段,是由6-15个氨基酸残基、多糖残基或核苷酸组成的具有特殊结构和免疫活性的基团[14]。抗原表位既是抗原与相应受体结合时结构和功能上必需的最小单位,也是免疫细胞与抗原特异性识别的关键分子,故抗原表位的存在可刺激机体产生免疫反应并表达相应抗体以保护机体。对于疫苗的制备,小分子蛋白更易做到快速、大量地表达,表位疫苗相较减毒疫苗能达到更高的安全性,故蛋白质抗原表位的鉴定对多肽疫苗和新型药物的研制具有重要意义[15]。
本研究从NCBI数据库获取了Wuhan-Hu-1株S蛋白的氨基酸序列(1 273 aa),空间结构预测结果显示,Wuhan-Hu-1株S蛋白整体呈现“Y”型,β-转角和无规则卷曲等连接结构多广泛散布于蛋白表面,即S蛋白的可变性较强,为其与hACE2的特异性结合奠定了结构基础。
3.2 准确预测SARS-CoV-2株与SARS-CoV株S蛋白共同抗原表位的重要性
S蛋白分为S1和S2两个功能亚基,前者含A/B/C/D四个核心区域并介导病毒与细胞的附着[15],后者高度保守且介导病毒的膜融合过程[16]。由于S蛋白在新冠病毒入侵机体的过程中发挥着不可替代的作用,自COVID-19暴发以来一直备受关注。日前,周强团队测定了SARS-CoV-2受体结合区与hACE2配合物的晶体结构[13],更加直观地阐明了将S蛋白作为SARS-CoV-2疫苗、药物设计靶标的重要意义。
表位是剖析抗原的构造、功能及其与抗体特异性反应机制的基础,不同的生物大分子表位若存在相似的空间构象,就可能与同一种抗体的互补决定区相契合,从而引发交叉反应[17]。研究显示,SARS-CoV-2毒株S蛋白的抗原决定簇与SARSCoV毒株存在较多相似之处[9-10],加之其都通过S蛋白与hACE2结合入侵机体[6-7],推测两者的S蛋白存在较为保守的区段。本研究以不同地区、不同时间取样的毒株为样本构建系统发生树,证实了两者的S蛋白氨基酸序列相似性相比于其他4种冠状病毒最高(77.5%)且具有共同起源和相似的感染模式,与大多数其它研究结果一致。作为单链RNA病毒,经过较为长期的演化,冠状病毒的变异可能会使疫苗或单抗的效果受到影响。目前对于SARSCoV-2在何时、何处发生基因突变难以预测。但基于病毒生存、增殖的需要,重要基因区段如对病毒细胞嗜性的改变起到决定性作用的S基因[18-19]等即使发生突变也难以保留。本研究的目标区段位于SARS-CoV-2和SARS-CoV均较为保守的S蛋白区段,随机突变在本研究目标基因序列中积累的可能性较小[20],因此针对S蛋白抗原表位设计的疫苗和药物研发在短期内受SARS-CoV-2变异影响的风险不大。对于SARS-CoV-2 S蛋白而言,现有研究尚未检测到其表位的突变,将这些表位作为抗体设计的靶标可能在一定程度上保护机体免受SARS-CoV-2的侵染。SARS-CoV-2感染人类细胞的机制复杂,在未识别宿主细胞时S蛋白的存在形式为亚稳态的预融合构象;S1亚单位与宿主受体识别并结合后,融合前三聚体的亚稳态稳定状态被打破,S1亚单位脱离;同时S2亚单位转变为融合后构象稳定存在,进而介导病毒囊膜与宿主细胞膜融合以致病毒入侵机体[16,22]。目前,位于S1亚基的N端结合结构域和受体结合位点广受关注,与其相邻的S2亚基主要负责病毒与细胞膜的融合,对病毒的结合能力也具有重要意义[12]。此前姜世勃等[22]研制出一种针对人冠状病毒S2亚基中HR1结构域的泛冠状病毒融合抑制剂,这都指示未来的研究可通过靶向S2亚基较保守表位的中和抗体来抑制病毒的侵染,从而起到预防作用。以位于病毒表面S2亚基的抗原为研究对象,深入研究非受体结合域抗原表位,并检验其是否能在体内发挥保护作用,对于进一步了解交叉免疫反应的机制具有重要意义。
本研究通过序列比对,发现SARS-CoV-2与SARS-CoV毒株S蛋白囊膜外存在一高度保守区段944-1 213(270aa),故对该区段进行B细胞抗原表位多参数综合预测。
3.3 抗原表位与多种影响因素之间的关系
Hopp和Woods共同开创的亲水性参数预测法为抗原表位的研究奠定了基础[23],此后科研人员又相继发表了多种参数和算法,丰富并发展了B细胞抗原表位的相关研究。先前的预测结果指示,单一参数方案并不能准确预测抗原表位,提示此后研究应综合考虑多种参数方案,尤以可能性方案(hydrophilicity)、可塑性方案(flexibility)、抗原性方案(antigenicity)及二级结构(secondary structure)预测最为重要[24-25]。
为适应与抗体结合时构象的改变,B细胞优势抗原表位应兼有灵活移动性、较好柔韧性以及位于蛋白质表面等特点。本研究分析了Wuhan-Hu-1株S蛋白的氨基酸序列(1 273aa),参照与SARS-CoV株S蛋白氨基酸序列比对结果并佐以跨膜分析,选定研究的目标区段为944-1 213位氨基酸区段(270 aa);结合多种参数的预测结果,对目标区段B细胞抗原表位进行了综合性分析,最终筛选出8个SARS-CoV-2与SARS-CoV潜在共用的B细胞抗原表位氨基酸区段:959-966、973-979、1 003-1 011、1 030-1 037、1 057-1 070、1 079-1 085、1 123-1 132、1 174-1 179。
3.4 共享表位疫苗的重要性与安全性
纵观冠状病毒的疫情发展史,冠状病毒在不可预测的时间反复出现并造成了严重影响[26],通用冠状病毒抗体、疫苗的生产或许可以填补特异性防治手段的缺位,助力解决由冠状病毒带来的不确定性隐患。对于抗体及疫苗的研制,由Fc或补体系统介导产生的抗体依赖增强(antibody dependent enhancement,ADE)现象广受关注。体外研究发现一种SARS-CoV抗体,可影响其S蛋白的构象,导致已被抗体结合的病毒仍具有结合宿主细胞的能力,甚至拥有Fc受体的免疫细胞更易被感染[27]。由此可见,ADE现象不仅会在两次感染同一病毒不同毒株时产生,即使是初次感染若采用不适当的抗体治疗也有导致ADE现象产生的风险。虽然目前体内实验还没有证据表明新冠抗体会引发ADE现象,但鉴于通用抗体的特殊性,更需警惕ADE现象的发生以确保抗体或疫苗的安全可靠性。SARS-CoV-2在9个月的扩散与变异中已产生两种亚型,这要求研发人员充分考虑两种病毒的各亚型并加强临床前研究。
未来表位疫苗的研制,还需解决短肽的设计、高效表达并提纯可溶性高活性抗原的方法等问题。2020年6月2日发表的专利显示,利用大肠杆菌制备参考n-s优势表位的融合蛋白可用于患者的辅助诊断,在新型冠状病毒总抗体检测中灵敏度和特异性均为100%[28]。由此可见通过大肠杆菌表达的抗原表位短肽仍具有免疫原性,为表位疫苗的研制提供了信心。无论是抗体还是疫苗,进入临床使用前均需要充分的动物实验及长期的临床实验来验证其是否能够达到通用疫苗的疗效及其安全性。
对于本研究的应用价值,相较于通过单细胞测序技术以及高通量抗体分离与筛选技术从血浆中分离抗体,利用生物信息学科学地预测抗原表位并由此筛选构建相应抗体更具针对性和普适性。从本研究的角度出发,生产通用抗体若依靠从治愈者体内筛选得到,鉴于抗体产生的随机性,恰好筛选出所需抗体的可能性极低,而通过预测区段并研制相应抗体效率更高。同时实验验证出具有抗原性的短肽也可以为表位疫苗的设计提供信息。目前,人类对病毒蛋白表位的认知尚处于初级阶段,较为保守的S2亚基表位被结合是否会影响病毒的侵染、致病能力尚待考究,通用表位疫苗的研制及其安全性有待验证。
4 结论
本研究通过SARS-CoV-2和SARS-CoV S蛋白序列比对和跨膜分析得到了二者高度保守的区段(944-1 213 aa),并结合亲水性指数、柔性区段、蛋白质表面可能性和抗原指数等参数,筛选出了8个SARS-CoV-2与SARS-CoV潜在共用的B细胞抗原表位氨基酸区段:959-966、973-979、1 003-1 011、1 030-1 037、1 057-1 070、1 079-1 085、1 123-1 132、1 174-1 179。
