融合超嗜热菌Pyrococcus furiosus红素氧还蛋白可提高靶蛋白的热稳定性
2021-11-19吴娇余桂珍袁航刘娴高艳秀龚明邹竹荣
吴娇 余桂珍 袁航 刘娴 高艳秀 龚明 邹竹荣
(云南师范大学生命科学学院 云南省生物质能源和环境生物技术重点实验室 教育部生物质能源持续发展和应用工程研究中心,昆明 650500)
大肠杆菌表达系统是当前重组蛋白生产的主要途径,但仍面临不少挑战,包括蛋白降解、错误折叠、溶解性差以及需要高效的纯化方法等[1]。在此方面,基因融合表达策略是一重要解决手段,并已有一些功效相当稳定的融合标签,包括麦芽糖结合蛋白(maltose-binding protein,MBP)、谷胱甘肽 S-转 移 酶(glutathione S-transferase,GST)、 硫氧还蛋白(Trx)、泛素(Ub)、小泛素相关修饰物(smallubiquitin-related modifier,SUMO)[1-3]以及一些超酸性小分子蛋白(MsyB、YjgD)等[4]。
另外,该策略也可以用来提高蛋白质的热稳定性。热稳定性对重组蛋白(如一些工业酶制剂和多肽类药品)的功能活性、应用范围和保存时效至关重要[5],也对那些与物种耐热性和作物产量非常密切的功能蛋白(特别是酶)非常关键[6-8]。蛋白质在高温下的可溶性变化可被视为衡量其热稳定性的重要依据,因而通过融合表达策略提高蛋白质的可溶性本身就具备提高其热稳定性的潜力,在这点目前已有一些研究报道证实。譬如,融合超酸性短肽(包括大肠杆菌 MsyB、YjgD[4]和酰基载体蛋白 ACP[9],以及人 α-Synuclein 蛋白[4,10]、拟南芥微管蛋白[4]和核酮糖-1,5-二磷酸羧化/加氧酶(Rubisco)长链型活化酶[11]的酸性尾部),不但能提高靶蛋白——小桐子和拟南芥抗坏血酸过氧化物酶1(JcAPX1、AtAPX1)[4,9]、大豆和烟草短链型 Rubisco 活化酶(GmRCA2、NtRCA2)[9,11]、大肠杆菌高丝氨酸 O-转琥珀酰酶(EcMetA)[9]以及小桐子TATA盒结合蛋白(JcTBP1)[11]的可溶性,而且还增强了它们的热稳定性和/或由它们介导的宿主耐热能力。除此之外,还有一类热稳定融合标签主要来源于嗜热微生物蛋白,它们可以将自身很高的热稳定性赋予给靶蛋白。譬如,融合超嗜热菌Pyrococcus furiosus的麦芽糖结合蛋白(PfMBP)能显著提高环孢杆菌木聚糖酶的热稳定性[12],获得产量和热稳定性更高的抗体来免疫检测炭疽杆菌孢子蛋白[13],特别是能制备溶解性和热稳定性更好的流感血凝素抗原疫苗[14]。通过这种方法可以实现高产热稳定重组蛋白疫苗,使疫苗的运输和使用更为便捷。还有,融合Pyrococcus furiosus连接酶的DNA结合域可以增强普通Taq DNA聚合酶的耐热性并改善其扩增特性[15],融合来源于嗜热菌Thermoanaerobacterium thermosaccharolyticum DSM571的几丁质结合域可以提升多功能半纤维素酶的高温酶活性,使之具有更高温度的适用潜能[16]。但是,上述来源于嗜热微生物的热稳定蛋白融合标签有一共同缺点就是分子偏大,某些情况下可能会干扰目标蛋白的高级结构进而影响其活性。
而来自超嗜热菌Pyrococcus furiosus的红素氧还蛋白(Rubredoxin)即PfRub则是一种小分子铁硫蛋白,由53个氨基酸残基构成,是目前已知最耐热的蛋白质之一[17]。PfRub在大肠杆菌中重组表达纯化后呈现红色,表明能正确折叠并与铁硫簇结合[17]。进一步的高级结构研究发现它当中特殊的氢键以及数量较多的丙氨酸残基和β折叠可能赋予它超乎寻常的耐热性[18-19]。本研究拟选择3个对热敏感但具有重要功能的酶作为靶蛋白(包括JcAPX1[4,9]、EcMetA[9]和假单胞菌亚磷酸盐脱氢酶(PsPtxD)[20]),首次检验PfRub(后简称Rub)作为融合标签能否有效增强大肠杆菌重组酶蛋白的热稳定性并保护其在高温下的酶活性。
1 材料与方法
1.1 材料
质粒 pET(JcAPX1)、pET(PsPtxD)、pET(EcMetA)均为本实验室先前构建[4,9,20],载体 pET32a(+)及大肠杆菌菌株BL21(DE3)均由本实验室保存。限制性内切酶(Sal I、Xho I、Nde I)、Phusion高保真DNA 聚合酶、T4 DNA 连接酶和碱性磷酸酶等均购于Thermo Scientific公司;质粒提取试剂盒、DNA纯化回收试剂盒、DNA/蛋白质分子量标准等均购自北京Transgene公司;HisTrap FF crude层析柱购自GE Healthcare;引物(表1)合成和DNA测序均由北京华大基因公司完成。

表1 本研究中所用引物Table 1 Primers used in this study
1.2 方法
1.2.1 Rub基因的合成及其融合表达载体的构建本工作采用Phusion DNA聚合酶和两轮PCR进行Rub基因片段的合成。首先,引物Rub-F2、Rub-R2互补延伸后直接作为模板,通过程序:95℃ 2 min;95℃ 30 s,51℃ 30 s,72℃ 12 s,1 个循环;95℃ 30 s,72℃ 30 s,72℃ 12 s,35 个循环 ;72℃ 10 min,合成第一轮PCR产物。随后,将它进行适当稀释(0.1-1 ng/μL)并从中取1 μL作模板,使用引物Rub-F1Sa、Rub-R1Xh 和程序 95℃ 2 min ;95℃ 30 s,47℃ 30 s,72℃ 12 s,1 个 循 环 ;95℃ 30 s,72℃ 30 s,72℃12 s,30个循环;72℃ 10 min扩增出第二轮PCR产物片段即Rub。Rub纯化后用Sal I和Xho I双酶切,再与经XhoI酶切和去磷酸化的pET(JcAPX1)、pET(PsPtxD)、pET(EcMetA)载体片段分别连接,构建成融合表达载体pET(JcAPX1-Rub)、pET(PsPtxD-Rub)和pET(EcMetA-Rub)。阳性重组克隆分别用靶蛋白基因5′端引物JcAPX1-5Nd/PsPtxD-5Nd/EcMetA-5Nd和Rub片段3′端引物Rub-R1Xh进行菌落PCR鉴定,并最后通过测序验证。DNA和蛋白质序列分析以及蛋白质的基本属性(氨基酸数目、分子量大小、等电点以及pH 7.0条件下的净电荷)分析均采用Invitrogen公司的Vector NT suite 11.5软件。
1.2.2 重组蛋白的诱导表达与纯化 将含表达载体的大肠杆菌BL21(DE3)单克隆37℃培养至OD600约为0.6,加入终浓度为0.5 mmol/L的IPTG,然后根据不同靶蛋白而区别进行诱导表达:对pET(JcAPX1)及pET(JcAPX1-Rub)菌液,37℃诱导4 h;对pET(EcMetA)及pET(EcMetA-Rub)菌液,30℃诱导8 h;对pET(PsPtxD)及pET(PsPtxD-Rub)菌液,25℃诱导过夜。参照文献[4-9]离心收集菌体,重悬和超声裂解,制备样品进行SDS-PAGE分析,并且使用凝胶成像和分析软件Quantity One(Bio-Rad)对胶上目标蛋白条带进行灰度定量分析,然后根据同一重组蛋白在上清(S)、沉淀(P)组分中的条带灰度值来计算其可溶性(公式: S /(S + P)×100%)。采用His标签亲和层析,参照文献[20]对重组PsPtxD及其Rub融合蛋白进行纯化并洗脱在无磷缓冲液中。
1.2.3 重组蛋白的热稳定性分析 将上述诱导表达菌的超声裂解液离心后取上清,采用梯度PCR仪为给定温度范围自动提供的几个合适温度点(间隔均匀),分别成组对重组JcAPX1 | 融合蛋白JcAPX1-Rub样品(37-60℃)、PsPtxD | 融合蛋白PsPtxD-Rub样品(30-50℃)、EcMetA | 融合蛋白EcMetA-Rub样品(25-45℃)热处理30 min。然后,将每个处理样品离心分为S和P两个组分进行SDS-PAGE分析。对胶上每个温度处理样品(S和P两组分)中目标蛋白条带进行灰度定量分析并以此估算其可溶性。最后,依据可溶性随温度的变化作图来评价重组蛋白的热稳定性。详细步骤参照文献[4-9]。
1.2.4 重组蛋白的酶活耐热分析 按上述相同方式对重组靶蛋白及其Rub融合蛋白进行温度处理,但此时需使用纯化过的重组PsPtxD及其融合蛋白PsPtxD-Rub。参照文献[4]对JcAPX1及其融合蛋白JcAPX1-Rub的热处理后样品进行APX胶活性染色分析,同时通过分光光度法定量测定其酶活。将未经温度处理样品(CK)的APX酶活性定义为100%,以此为标准计算出各温度点处理后样品的相对酶活性,并随温度作图直观展示它的变化趋势。类似地,参照袁航等[20]对PsPtxD及其融合蛋白PsPtxD-Rub经热处理后的样品进行分光光度法酶活测定,并作图展示它随温度变化的曲线。通过M9基本培养基上的细菌梯度稀释点板实验,直接对重组EcMetA及其Rub融合蛋白在菌体内的酶活进行耐热性分析:将含表达载体pET(EcMetA)、pET(EcMetA-Rub)及pET32a(+)空载体的BL21(DE3)大肠杆菌37℃培养至OD600为0.4,加入终浓度为0.5 mmol/L的IPTG,25℃诱导培养过夜;然后将菌液OD600均调为1.4,分别取200 μL放置在44℃、48℃、52℃恒温水浴锅中处理2 h;最后将热处理菌液和未处理菌液(CK)按照10-1、10-2、10-3、10-4倍数进行梯度稀释,各取2 μL成行点板于M9固体培养基上,置于37℃恒温培养箱中培养1-2 d,观察菌落的生长情况并拍照记录。
2 结果
2.1 Rub基因的合成及其大肠杆菌融合表达载体的构建
本工作根据超嗜热菌Pyrococcus furiosus红素氧还蛋白(简称Rub)的基因片段(GenBank NC_018092,1008432...1008596 nt) 的 大 小 设 计 了4条约60 bp的引物。首先,通过内部引物对Rub-F2/Rub-R2之间互补延伸作模板,扩增出约100 bp的第一轮PCR产物;然后以之为模板,使用外部引物对Rub-F1Sa / Rub-R1Xh进行第二轮PCR,合成得到大小约180 bp的完整Rub基因片段(图1-A)。通过SalⅠ和XhoⅠ双酶切,Rub随后分别插入到载体pET(JcAPX1)、pET(PsPtxD)、pET(EcMetA) 上靶蛋白基因编码区的3′末端,最后各自经菌落PCR鉴定获得了其融合表达载体pET(JcAPX1-Rub)(图1-B)、pET(PsPtxD-Rub)(图 1-C)和 pET(EcMetARub)(图1-D),并且通过测序验证了Rub基因的合成准确及与靶蛋白基因编码区的无框移融合。
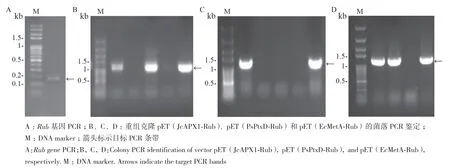
图1 Rub基因的PCR合成及其融合表达载体的构建Fig.1 PCR synthesis of the Rub gene and construction of its fusion expression vectors
通过比较Rub标签、靶蛋白及其融合蛋白一些特性,如氨基酸数目、分子量大小、等电点以及pH 7.0条件下的净电荷等(表2),可以看出Rub是一小分子酸性蛋白,作为融合标签可以使它的靶蛋白得到一定程度的酸化,带上更多的净负电荷,而且分子量并未增大许多。

表2 Rub、靶蛋白及其融合蛋白的特性Table 2 Properties of Rub,target proteins,and their fusion forms
2.2 融合Rub可提高大肠杆菌重组靶蛋白的可溶性
将 靶 蛋 白 表 达 载 体 pET(JcAPX1)、pET(PsPtxD)、pET(EcMetA)及与Rub融合的表达载体 pET(JcAPX1-Rub)、pET(PsPtxD-Rub)、pET(EcMetA-Rub)分别成对于相同条件下在大肠杆菌BL21(DE3)中诱导表达,表达菌经超声裂解后通过SDS-PAGE分析。结果显示,本工作选用的3种靶蛋白JcAPX1、PsPtxD、EcMetA在大肠杆菌重组表达时大部分确实为不溶的沉淀形式(图2-A、D、G),可溶性不到或接近10%(图2-B、E、H),并且表达菌裂解液几乎以本色呈现(图2-C、F、I)。相比较,加了Rub标签的融合蛋白JcAPX1-Rub、PsPtxD-Rub、EcMetA-Rub重组表达时有相当部分存在于上清中(图2-A、D、G),可溶性显著得到提高(对JcAPX1-Rub甚至高达90%以上)(图2-B、E、H)。另外,由于融合了属铁硫蛋白的Rub(能结合Fe离子)使得表达菌裂解液可呈现出暗红色,颜色的深浅看似与Rub融合蛋白的可溶性呈正相关,其中JcAPX1-Rub表达菌裂解液的暗红色显然最深(图2-C、F、I)。这些结果表明Rub可作为一个增溶标签有效促进靶蛋白在大肠杆菌中的可溶性表达。尽管当中对各靶蛋白可溶性提高的程度似乎并不相同,但这可能与靶蛋白本身性质有很大关系。
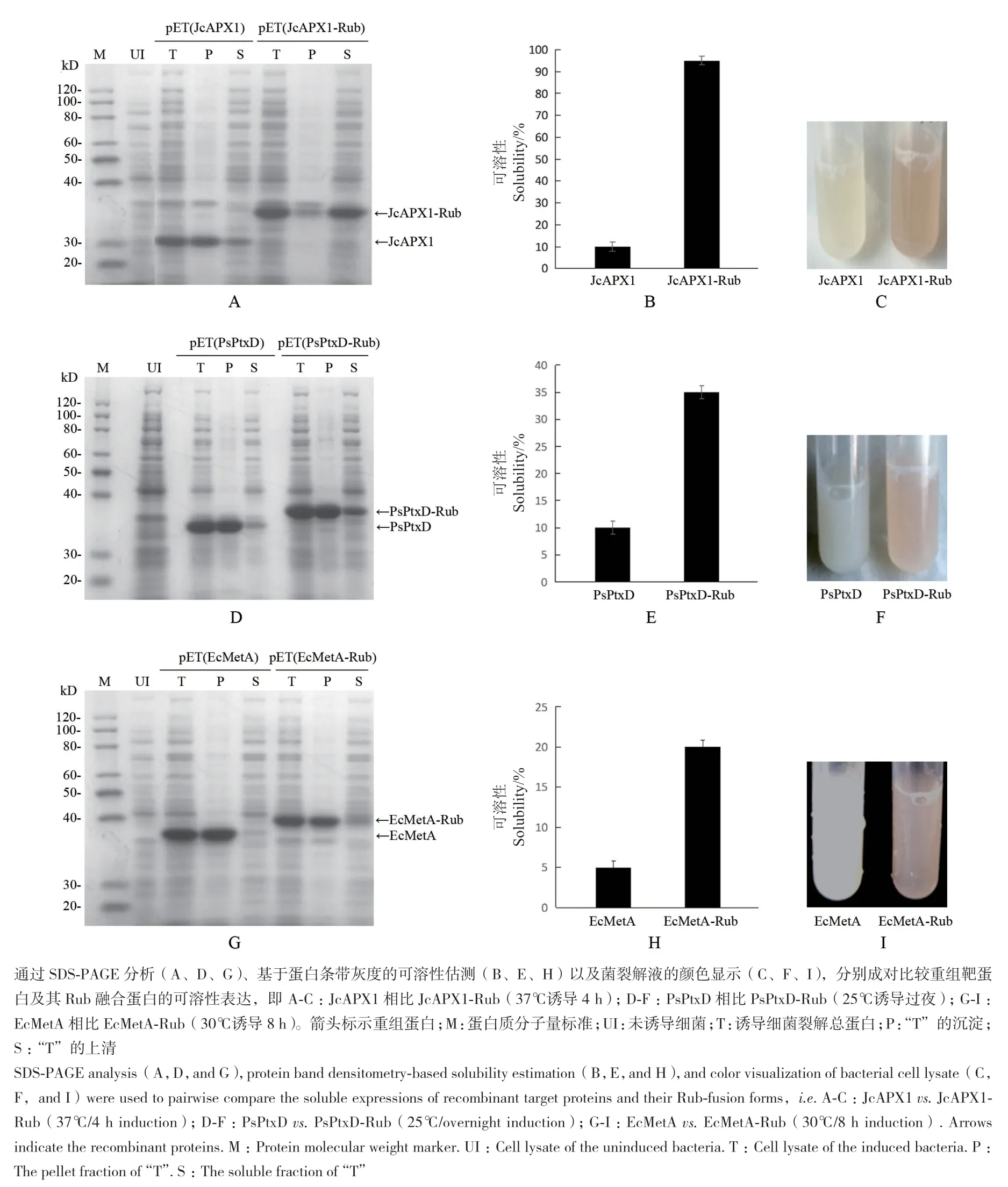
图2 融合Rub可促进靶蛋白JcAPX1、PsPtxD、EcMetA在大肠杆菌中的可溶性表达Fig. 2 Rub fusion enhances the soluble expressions of target proteins JcAPX1,PsPtxD,and EcMetA in E. coli
2.3 融合Rub可提高重组靶蛋白的热稳定性
靶蛋白及其Rub融合蛋白表达菌裂解液离心后的上清经系列设定温度点热处理后,进行SDS-PAGE分析和估算目标蛋白的可溶性。结果显示,JcAPX1蛋白的可溶性随着温度升高而逐渐降低,它在45℃时就有近50%以不溶的沉淀形式存在,当温度升至55℃左右时就几乎不可溶;与之相比,JcAPX1-Rub融合蛋白的可溶性随温度升高并没有明显变化,几乎都以可溶的形式存在(图3-A、B)。PsPtxD蛋白在低于35℃的处理温度下大部分还在上清中,接近40℃时可溶性就急剧下降到30%左右,到45℃左右就变得基本不可溶;相比较,PsPtxD-Rub融合蛋白的可溶性在40℃左右还保持很高(接近90%),虽然随温度缓慢下降,但在50℃高温仍有70%的可溶性(图3-C、D)。类似地,EcMetA可溶性在35℃之前受处理温度影响较小,但升至38℃左右时就急剧下降至50%,在超过41℃以后基本变得不可溶;相比较,EcMetA-Rub融合蛋白的可溶性随温度升高并没有明显下降,在45℃时仍然保留高达90%的可溶性(图3-E、F)。这些结果一致表明融合Rub可显著提高重组靶蛋白的热稳定性。

图3 融合Rub可增强靶蛋白JcAPX1、PsPtxD、EcMetA的热稳定性Fig. 3 Rub fusion improves the thermostability of target proteins JcAPX1,PsPtxD,and EcMetA
2.4 融合Rub可提高重组JcAPX1、PsPtxD酶活的耐热性
由于大肠杆菌缺乏内源性APX酶,因而重组表达的JcAPX1及其Rub融合蛋白无需纯化可直接进行酶活耐热性分析。将表达菌裂解液离心后的上清经系列温度点热处理后,先通过直观的胶活性染色来检测酶活变化。由图4-A可以看出,JcAPX1酶活在45℃以下随温度升高而逐渐轻微下降,但在47.7℃时就顷刻完全失活;与之相比较,JcAPX1-Rub融合蛋白的酶活性在温度低于47.7℃之前基本没有太大变化,只有当温度升到50.5℃时才明显下降,但仍保留约40%的水平。进一步通过灵敏的分光光度法进行酶活测定,发现在所有低于44.5℃的温度处理点上,JcAPX1的酶活性与CK(未经处理)相比随温度逐步上升但较缓慢,而JcAPX1-Rub融合蛋白的酶活上升趋势较快,甚至延伸至47.5℃达到最高(2倍多)。JcAPX1酶活性在44.5℃以后就开始急剧下降,到47.5℃仅保留约50%,当温度升至52℃时就基本丧失,而此时JcAPX1-Rub仍然保留有70%左右的活性。到53.5℃时,两者的活性均趋同为无(图4-B)。该结果与前面胶活性染色结果大体一致,表明融合Rub标签能够有效保护酶蛋白JcAPX1免受热失活,使其耐热性提高了近5℃。
为了避免大肠杆菌内源性干扰,重组表达的PsPtxD及其Rub融合蛋白需要先经His标签亲和层析纯化(洗脱在无磷缓冲液中)后才进行酶活耐热性分析。样品经系列温度点热处理后通过分光光度法检测其酶活性。结果显示,PsPtxD酶活性对温度较敏感,除了25℃比CK略高,之后就持续下降,到37℃就完全失活,其半失活温度接近32.5℃。相比较,PsPtxD-Rub融合蛋白的酶活性在34℃前随温度升高都持续上升,之后开始下降,但在43℃前仍高出CK,直到53.5℃才完全失去活性,其半失活温度约为47.5℃(图4-C),这表明Rub标签的添加能够大幅(约15℃)提高PsPtxD酶活的耐热能力。

图4 融合Rub可提高JcAPX1、PsPtxD体外酶活的耐热性Fig. 4 Rub fusion improves the heat tolerance of the in vitro enzymatic activities of JcAPX1 and PsPtxD
2.5 融合Rub可提高EcMetA重组大肠杆菌菌株的耐热性
本工作还对靶蛋白EcMetA及其Rub融合蛋白采用了更方便的体内活性耐热分析。由于EcMetA是大肠杆菌甲硫氨酸(必需氨基酸)合成途径的关键酶,它的酶活耐热性可以表观地由高温胁迫后的细菌菌落生长状态反映出。通过M9基本培养基上的细菌梯度稀释点板实验可以发现,含表达载体pET(EcMetA)或融合表达载体pET(EcMetA-Rub)的重组大肠杆菌与含空载pET32a(+)的细菌相比,在未受温度胁迫(CK)时的菌落生长状况基本相似。经42℃处理2 h后点板,含EcMetA表达载体的大肠杆菌生长状况略好于含空载菌,而含EcMetA-Rub融合表达载体的大肠杆菌生长状况明显好于前两者。将温度升至48℃处理2 h后点板,各重组大肠杆菌生长状况类似于42℃处理2 h,但含EcMetA-Rub载体的重组菌菌落生长优势凸显出来。而经过52℃高温处理2 h后,能够更明显地看出含EcMetA-Rub融合表达载体的菌落在高温胁迫下的生长优势,当稀释至1 000倍点板仍有菌落生长,而另外两者只有在未稀释时点板才有少数的菌落生长(图5)。这些结果表明融合Rub增强了EcMetA重组大肠杆菌菌株的耐热性,推测是Rub作为热稳定融合标签有效保护了靶酶蛋白EcMetA在菌体内免受热失活。
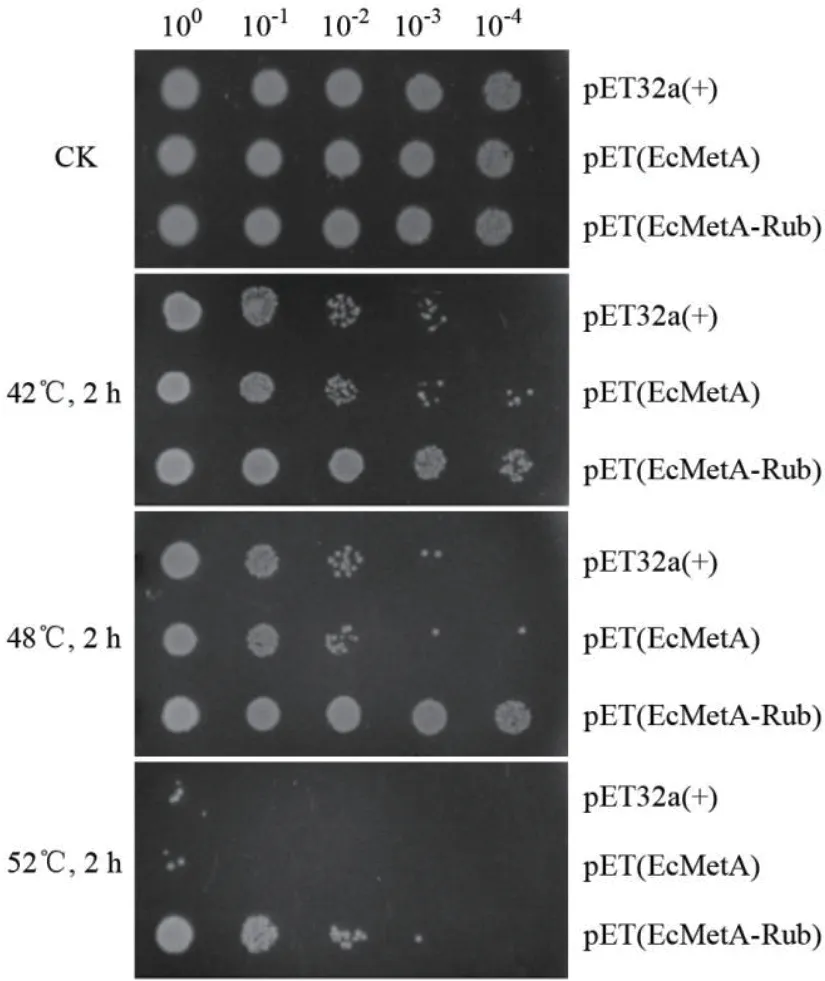
图5 细菌稀释点板分析Rub融合对EcMetA重组大肠杆菌在高温胁迫下的生长影响Fig. 5 Influence of Rub fusion on the growth of EcMetA recombinant E. coli strain under heat stress by bacterial dot plating test with serial dilution
3 讨论
目前,蛋白质可溶性和热稳定性仍然是重组蛋白高效生产、功能应用和长久保存不可回避的问题,而使用融合表达策略已成为其重要解决手段,关键是找寻功效显著的增溶/热稳定蛋白融合标签。为此,本工作检验了超嗜热菌Pyrococcus furiosus的红素氧还蛋白(Rub)作为该类融合标签的可行性。嗜热微生物中的蛋白通常具有很高的热稳定性,Rub也不例外,事实上它是目前已知的最耐热蛋白质之一,高温下不易发生变性聚集,这得益于它分子高级结构中的特殊氢键和数量较多的β-折叠[17-19]。
本研究选取了3种热不稳定重要靶蛋白JcAPX1、PsPtxD和EcMetA,发现融合Rub确能一致显著提高了它们的可溶性和热稳定性,并且在相当大程度上提高了JcAPX1、PsPtxD的体外酶活耐热性以及增强了EcMetA重组大肠杆菌的耐高温能力(即体内酶活耐热性)。这些结果说明Rub如同其他嗜热微生物蛋白[12-16]一样,作为融合标签能够将自身超高热稳定性“顺式”传递给靶蛋白。另外,Rub的这种增溶/热稳定作用还可能与它的酸性特质有关,靶蛋白与它融合能得到一定程度的酸化,类似于目前已鉴定的不少超酸性短肽标签[4,9-11]。
另外,Rub分子量不大(53 aa),对靶蛋白折叠和功能的潜在影响较小,符合理想融合标签的大小标准,可以认为这是它有别于其他嗜热微生物蛋白标签[12-16]的重要优势。
还有,Rub在大肠杆菌中重组表达能形成正确高级构象并与铁硫簇结合呈现红色[17],在本研究中它与3种不同靶蛋白融合也能使各个表达菌裂解液呈现出暗红色,并且颜色的深浅与其融合蛋白的可溶性呈正相关。这种特性可用于融合蛋白可溶性表达水平的判断及后续纯化过程的示踪。
总之,从现有的文献资料来看,本工作可能是首次从嗜热微生物耐热蛋白群体中鉴定出分子量小、效果明显的增溶/热稳定融合标签,为利用蛋白融合策略提高靶蛋白的可溶性、热稳定性及其抗热失活能力甚至是其宿主(如工业微生物)的耐热性提供了一个新的效应元件。特别提及的是,Rub融合若应用在热不稳定的光合作用相关酶(如Rubisco活化酶[8])上,它对植物耐热性和高温下产量的提高将是可以期待的。另外,由于植物内源性rubredoxin还参与对逆境胁迫的响应,维持正常的电子转移以减少活性氧(ROS)的积累,其过表达植株对盐、碱等诸多胁迫的耐受性增强[21],因而可以想象这种Rub融合还可能赋予目标转基因植物额外的抗逆能力。显然,Rub标签无疑具有相当看好的广阔应用前景。
4 结论
本研究验证了超嗜热菌Pyrococcus furiosus的红素氧还蛋白可以作为热稳定融合标签,显著提高大肠杆菌重组蛋白的可溶性和热稳定性,并能对靶蛋白的体内或体外活性提供明显的热保护作用。
