一种苯酚降解菌Pseudoxanthomonas sp. BF-6的分离鉴定及其降解特性及途径研究
2021-11-19卫晓博侯颖程豪杰秦翠丽牛明福徐建强
卫晓博 侯颖 程豪杰 秦翠丽 牛明福 徐建强
(1. 河南科技大学食品与生物工程学院,洛阳 471023;2. 河南科技大学食品与生物工程学院微生物资源开发与利用重点实验室,洛阳471023;3.河南省食品微生物工程技术研究中心,洛阳 471023;4. 河南科技大学园艺与植物保护学院,洛阳 471023)
苯酚是染料、炸药、造纸、聚合树脂、炼油、煤气、焦化、制药及纺织等多种工业生产废水中最主要的污染物[1]。苯酚属于毒性很强的有机污染物,已被列入中国水环境优先控制污染“黑名单”[2]。含酚废水不经处理而任意排放,不但污染生态环境,而且会对动、植物产生有毒甚至致命的危害,影响生物及人类生存与健康。
目前,国内外处理含酚废水的方法主要有物理法、化学法、生物法及各种结合法,其中生物处理法是一种经济有效且无二次污染的理想方法[3]。虽然酚类化合物是一种生物毒性物质,但是很多微生物(包括好氧的和厌氧的)均可利用酚类化合物作为生长碳源,因此可以利用微生物处理含酚废水[4]。国内外学者针对苯酚微生物降解方面开展了大量的研究工作,分离鉴定的具有降解苯酚能力的微生物广泛分布于细菌的假单胞菌属(Pseudonomonas)[5-6]、芽 孢 杆 菌 属(Bacillus)[7-8]、 不 动 杆 菌 属(Acinetobacter)[9-10]、红球菌属(Rhodococcus)[11-12],放线菌的诺卡氏菌属(Nocardia)[13]和真菌的酵 母 菌 属(Yeast)[14-15]及 烟 曲 霉(Aspergillus fumigatus)[16]等。无论是细菌还是真菌其好氧降解苯酚的途径都是苯酚先在苯酚羟化酶的作用下转化为邻苯二酚,然后邻苯二酚在邻位开环酶(邻苯二酚1,2-双加氧酶)或间位开环酶(邻苯二酚2,3-双加氧酶)作用下打开苯环[17]。
本研究从河南某农药厂废水处理系统中获得一株能够以苯酚为唯一碳源生长的苯酚降解菌株BF-6,采用16S rRNA序列分析和生理生化试验对该菌株分类学地位进行了初步鉴定,并对该菌株降解苯酚的特性和途径进行了研究,以期为含苯酚废水的生物处理提供新的菌株资源和理论支持。
1 材料与方法
1.1 材料
1.1.1 样品 河南某农药厂污水处理系统活性污泥。
1.1.2 培养基与试剂 LB培养基(g/L):酵母粉5.0,胰蛋白胨10.0,NaCl 10.0,固体培养基添加琼脂粉20.0。无机盐培养基(MSM,g/L):NH4NO31.0,KH2PO40.5,K2HPO41.5,NaCl 1.0,MgSO4·7H2O 0.1,pH 7.0。苯酚、邻苯二酚、4-氨基安替比林、铁氰化钾、氨水等均为分析纯,购自天津市德恩化学试剂有限公司。黄素腺嘌呤二核苷酸二钠盐(FAD-Na2)、还原型β-烟酰胺腺嘌呤二核苷酸二钠盐(NADH-Na2)、还原型β-烟酰胺腺嘌呤二核苷酸2-磷酸四钠盐(NADPH-Na4)购自上海阿拉丁生化科技股份有限公司。
1.2 方法
1.2.1 苯酚降解菌的驯化、分离和纯化 取5 g污泥样品,加到含50 mg/L苯酚浓度的无机盐培养基中,并添加终浓度为20 mg/L的酵母汁后,在30℃、180 r/min的摇床上进行富集培养7 d,富集液经测定苯酚降解率达到90%以上后,取其上清液5 mL加入到含100 mg/L苯酚的无机盐液体培养基中,于30℃、180 r/min继续富集,并以100 mg/L的梯度逐步提高苯酚浓度最高至1 000 mg/L。取最后一轮富集液配制成10-1、10-2、10-3.....10-6梯度的稀释液,然后取10-4、10-5、10-6稀释液各0.2 mL涂布在苯酚无机盐固体培养基平板上进行培养,观察平板上菌落的生长情况,挑选其中清晰可见的单菌落,利用LB固体培养基进行多次分离纯化,并对这些菌株进行编号。将纯化好的菌株经LB液体培养基活化培养后,按5%接种量接种到含100 mg/L苯酚的无机盐培养基进行苯酚降解试验,48 h后取样测定苯酚含量的变化,取降解效果最佳的菌株进行鉴定,并研究不同环境因素对苯酚降解的影响及其降解苯酚的途径。
1.2.2 苯酚降解菌的鉴定 根据16S rRNA基因序列分析并结合形态学、生理生化特征等对筛选到的苯酚降解菌进行鉴定。首先在LB固体培养基上对菌株进行平板划线,于30℃恒温培养24 h后观察菌落形态特征;挑取少量菌体进行简单染色后利用光学显微镜观察菌体形态;并参考《常见细菌系统鉴定手册》[18]对菌株进行生理生化特征分析。
将菌株经LB液体培养基培养后,取3 mL菌液,利用细菌基因组提取试剂盒(AxyPrep)提取菌株的总DNA,以此为模板,利用细菌16S rRNA基因通用引物 27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1 492R(5′-GGTTACCTTGTTACGACTT-3′) 进 行PCR扩 增。PCR体 系(50 μL) 为 :2×taq master mix 25 μL, 引 物 27F(25 pmol/μL) 和 1492R(25 pmol/μL)各 2 μL,细菌基因组 DNA(约 50 ng/μL)1 μL,灭菌双蒸水 20 μL。PCR 程序为 :95℃预变性5 min;95℃变性30 s,55℃退火30s,72℃延伸1.5 min,共30个循环;最后72℃终延伸10 min。PCR扩增产物经0.75%琼脂糖凝胶电泳验证后送上海生工生物公司进行测序。测序结果通过BLAST与NCBI数据库基因序列进行比对,并通过MEGA-X软件采用邻接法构建系统进化树。
1.2.3 降解菌株种子液的制备 从LB 平板上挑取苯酚降解菌株单菌落,接种于3 mL LB液体培养基中于30℃,180 r/min摇床培养24 h,然后将培养液接到100 mL新的液体LB培养基中,培养24 h,6 000 r/min离心10 min收集菌体,用灭菌的无机盐培养基洗涤菌体沉淀3次后,制成OD600=1.5的菌液,即种子液。
1.2.4 环境因素对菌株降解苯酚的影响 以菌液初始浓度 OD600=1.5,5%接种量、苯酚初始浓度100 mg/L、pH 值8.0、温度37℃、转速180 r/min为初始培养条件,采用单变量法研究温度、pH值、苯酚浓度、接种量和金属离子对菌株降解苯酚能力的影响。
1.2.5 菌株生物量测定 采用分光光度法在600nm波长处测定细胞悬浮液的吸光度,以OD600数值表示其生物量。
1.2.6 苯酚含量的测定 采用4-氨基安替比林分光光度法测苯酚含量[19]。方法如下:配制苯酚标准溶液,准确称取0.100 g苯酚,配置成100 mg/L的苯酚溶液。分别移取1、2、4、6、8和10 mL苯酚标准溶液置于50 mL比色管中,稀释定容至刻度。在6支比色管中分别加入0.5 mL氨水-氯化铵缓冲液,混匀,然后加入1.0 mL的2% 4-氨基安替比林溶液,再加入1.0 mL的8%铁氰化钾溶液,充分混匀,放置10 min后,立即于510 nm波长处,以水为参比,测定其吸光度,并绘制吸光度对苯酚含量(mg)的校准曲线。将不同时间的培养液经6 000 r/min离心10 min去除菌体细胞后,取适量体积上清液,用与绘制校准曲线相同步骤测定吸光度,并对照标准曲线计算苯酚含量。
1.2.7 菌株BF-6降解苯酚途径 通过检测菌株细胞内苯酚羟化酶活性和邻苯二酚双加氧酶的活性,可以推测菌株降解苯酚的途径。将菌株BF-6接种于含200 mg/L苯酚的无机盐培养基中,37℃培养2 d,6 000 r/min离心收集菌体,菌体沉淀经200 W超声波破碎20 min后,12 000 r/min离心20 min,取其上清液即为菌株BF-6细胞粗酶液。在粗酶液中分别添加10 mmol/L苯酚,1 mmol/L FAD和100 mmol/L NADPH或100 mmol/L NADH,然后利用紫外可见分光光度计在340nm处检测粗酶液中NADPH或NADH吸光度的变化,以确定粗酶液是否具有苯酚羟化酶活性[20]。在粗酶液中分别添加1 mmol/L的FeSO4和10 mmol/L或100 mmol/L邻苯二酚,利用紫外可见分光光度计检测粗酶液中260 nm和375 nm吸光度的变化,以确定粗酶液是否具有邻苯二酚双加氧酶活性[17]。苯酚羟化酶一个酶活力单位定义为每分钟氧化 l μmol NADPH所需的酶量,邻苯二酚双加氧酶一个酶活力单位定义为产生 l μmol顺,顺-黏糠酸或2-羟基黏糠酸半醛所需的酶量。
2 结果
2.1 苯酚降解菌的分离鉴定
经过连续富集,从农药厂活性污泥样品中分离得筛选到一株可以苯酚为唯一碳源的高效降解菌株,命名为BF-6。经过LB固体培养基培养24 h后,BF-6在LB平板上形成较大的菌落,菌落中间突起,圆形,边缘整齐菌体颜色为乳白色,表面黏稠湿润(图1-A)。菌株BF-6在光学显微镜下的形态为杆状,无荚膜,无芽孢(图1-B)。
菌株BF-6部分生理生化试验结果如表1所示,在7种供试碳源中,菌株BF-6可以利用葡萄糖、蔗糖、乳糖和乙醇,不能利用木糖、甘露醇和甲醇;7种供试氮源菌株BF-6都能利用。菌株BF-6对阿奇霉素、四环素、卡那霉素和诺氟沙星4种抗生素没有抗性,但对青霉素、链霉素、头孢克肟、呋喃唑酮等9种供试抗生素均有抗性。菌株BF-6的革兰氏染色反应、甲基红试验、V-P试验、淀粉水解酶试验、反硝化试验、明胶液化试验等试验结果均为阴性,过氧化氢酶试验阳性,其最适生长温度为37℃,最适生长pH值为8.0。

表1 菌株BF-6部分生理生化试验结果Table 1 Results of physiological and biochemical test of strain BF-6
对菌株BF-6的16S rRNA进行PCR扩增,获得了大小约1 500 bp的目的片段,经测序获得长为1 513 bp的有效片段,序列提交GenBank数据库,获得登录号为MW165868。将序列在NCBI上利用BLAST进行序列相似性比对,BF-6菌株与Pseudoxanthomonasmexicana(AB246798)的16S rRNA基因序列相似性为99.8%。选取Ribosomal Database Project 中假黄单胞菌属部分菌株的16S rRNA基因序列与BF-6菌株进行系统发育进化树构建,同时选取寡养单胞菌属部分菌株Stenotrophomonas bentonitica BII-R7(HG800055)、Stenotrophomonas maltophilia IAM 12423(AB294553)、Stenotrophomonas pavanii ICB 89(FJ748683)作为外群,结果见图2。菌株BF-6的16S rRNA基因序列与Pseudoxanthomonas indica相应序列最近,聚为一支。结合菌株BF-6的形态特征、生理生化特性和16S rRNA基因序列的系统发育分析,将菌株BF-6鉴定为Pseudoxanthomonas sp.。
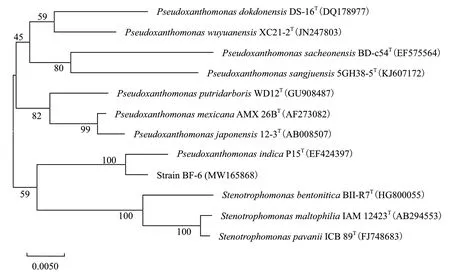
图2 基于16S rRNA基因序列构建的菌株BF-6系统发育树Fig.2 Phylogenetic tree constructed by the neighbor-joining analysis based on 16S rRNA gene sequences of strain BF-6 and related species
2.2 环境因素对菌株BF-6降解苯酚的影响
2.2.1 菌株BF-6以苯酚为唯一碳源的生长曲线及苯酚降解曲线 按5%接种量将菌株BF-6接种到100 mg/L苯酚为唯一碳源的无机盐培养基中、pH 值8.0、温度37℃、转速180 r/min震荡培养。每6 h进行取样一次,首先采用分光光度法在600 nm处测定菌株BF-6生长情况,然后将培养液进行离心,取上清液测定苯酚含量,以时间为横坐标,以菌株的生长量OD600和苯酚含量为纵坐标绘制菌株BF-6以苯酚为唯一碳源的生长曲线及苯酚降解曲线,结果如图3所示。在0-24 h时菌株BF-6生长缓慢,甚至在18-24 h时出现生长量下降,但在24-36 h时则开始呈指数增长,说明菌株BF-6在含有苯酚的无机盐培养基中需要经过较长时间的延滞期,然后才能进入对数生长期;培养基中苯酚含量在0-30 h时呈缓慢下降,30-36 h时则迅速下降,结合生长曲线的变化情况,可知苯酚的迅速降解与菌株的对数生长相一致,36 h时苯酚降解率为97.79%;36 h后随着苯酚含量的减少,菌株BF-6的生长量又开始降低,到48 h时苯酚降解率达到98.51%。
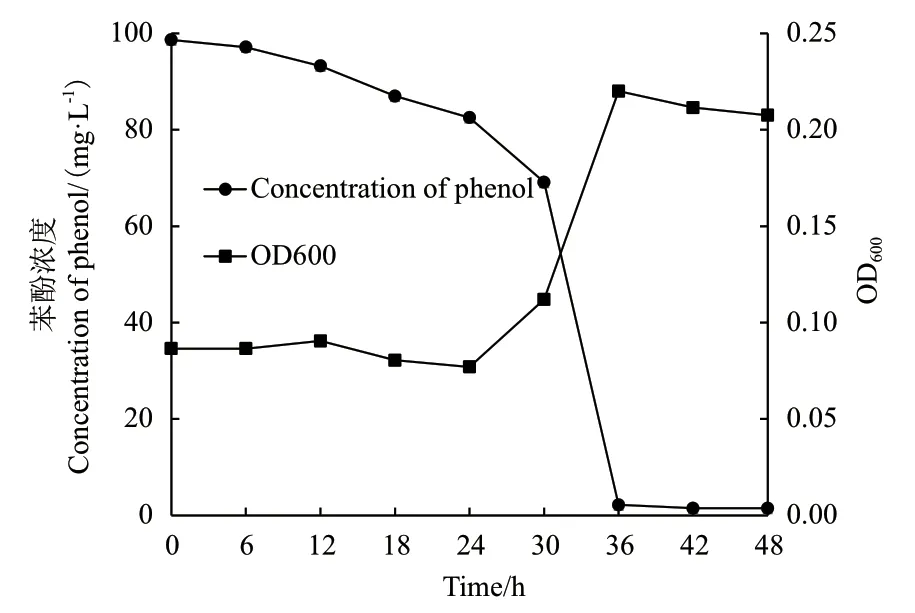
图3 菌株BF-6以苯酚为唯一碳源的生长曲线及苯酚降解曲线Fig.3 Growth curve of strain BF-6 and degradation curve of phenol by using phenol as sole carbon source
2.2.2 温度对菌株BF-6降解苯酚的影响 温度是影响微生物菌株降解能力的主要环境因素之一,因为温度的变化对微生物细胞内的酶系统有着显著的影响。为了研究温度对菌株BF-6降解苯酚能力的影响,分别在中温微生物常用最适培养温度20、25、30、37和42℃条件下进行苯酚降解试验,并定时监测苯酚的残留量。由图4可知,当培养温度在20-37℃之间时,菌株BF-6均可高效的降解苯酚,其在48 h内对100 mg/L苯酚的降解率分别为95.7%、96.9%、97.7%和97.9%;但当温度为42℃时,菌株BF-6对苯酚的降解率仅为3.3%,说明其降解苯酚的能力受到了显著的抑制。由于菌株BF-6在20-37℃条件下对苯酚都有较高的降解率,表明菌株BF-6对一般环境温度有很强的适应性。
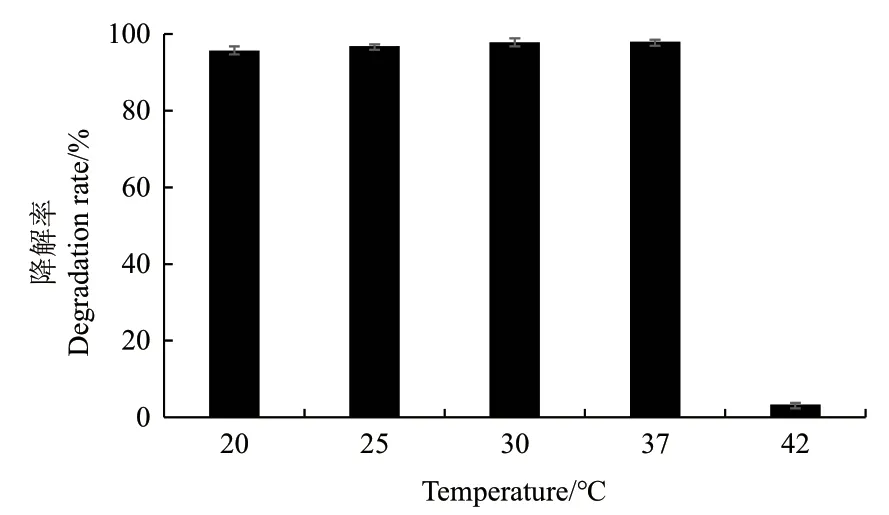
图4 温度对菌株BF-6降解苯酚的影响Fig.4 Effect of temperature on degradation of phenol by strain BF-6
2.2.3 pH对菌株BF-6降解苯酚的影响 培养液酸碱度的变化会对微生物酶的合成和催化活性产生很大的影响,进而影响微生物的生长发育及其对污染物的降解能力。对菌株BF-6在不同pH值条件下降解苯酚的能力进行了研究,由图5可以得出,在pH值5.0-10.0范围内,菌株BF-6均能够表现出良好的苯酚降解能力,当pH值为8.0时,菌株BF-6在48 h内对100 mg/L的苯酚的降解率达到最大,为97.41%,即使在pH为5.0和10.0时苯酚的降解率也可达到80%以上;从以上数据可以看出,菌株BF-6可以很好适应大多数自然环境中的酸碱度而发挥很强的降解作用。
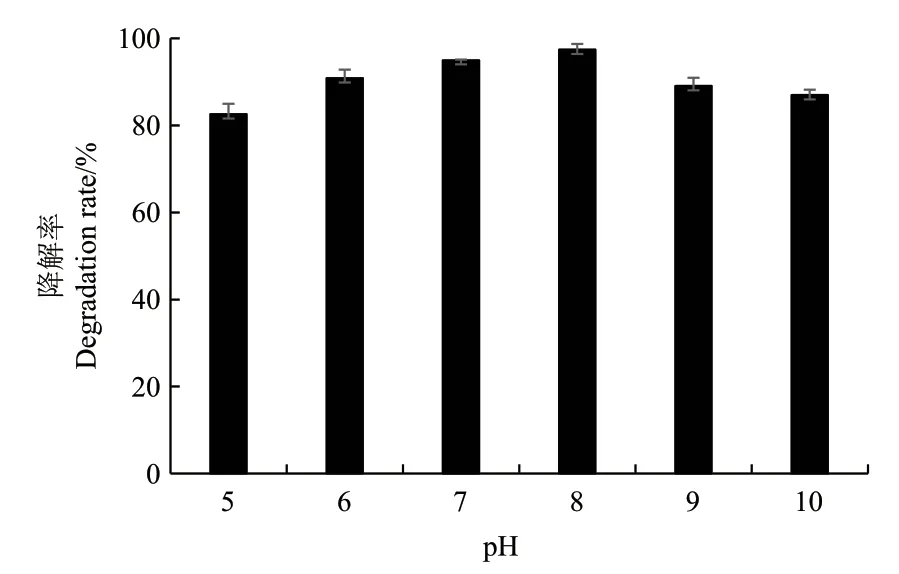
图5 pH对菌株BF-6降解苯酚的影响Fig.5 Effect of pH on the degradation of phenol by strain BF-6
2.2.4 苯酚浓度对菌株BF-6降解苯酚的影响 由于中低浓度(<1 000 mg/L)含酚废水中的苯酚已无回收价值,所以广泛采用生物法处理。对菌株BF-6在不同浓度苯酚条件下的降解能力进行了研究,即按5%接种量将菌株BF-6接种到不同初始浓度苯酚的培养基中,并定时采样,测定培养基中苯酚的含量变化。由图6可以看出,当苯酚初始浓度为100和200 mg/L时,菌株BF-6能够在2 d和4 d内将其降解;而当苯酚初始浓度上升至500 mg/L时,菌株BF-6降解苯酚的能力受到明显的抑制,直到10 d时才能被完全降解。当苯酚初始浓度为700 mg/L和1 000 mg/L时,菌株BF-6降解苯酚的能力基本完全受到抑制,到10 d时,苯酚降解率仅为17.63%和14.88%。这可能是由于高浓度苯酚抑制了菌株BF-6的生长,从而导致其无法降解苯酚。

图6 苯酚浓度对菌株BF-6降解苯酚的影响Fig.6 Effect of initial concentration on the degradation of phenol by strain BF-6
2.2.5 接种量对菌株BF-6降解苯酚的影响 接种量也是影响菌株降解污染物能力的重要因素之一,将菌株BF-6分别按1%、3%、5%、7%和10%的接种量接种于含100 mg/L苯酚的无机盐培养基中,定时取样测定苯酚含量,研究接种量对菌株BF-6降解苯酚的影响。由图7可以看出,当接种量为10%时,仅1 d的时间,菌株BF-6就能将100 mg/L的苯酚降解90.81%;当接种量为5%和7%时,100 mg/L的苯酚需要2 d可以降解98%以上;当接种量为1%和3%时,菌株BF-6也可以在3 d内将苯酚降解90%以上,该结果表明接种量对菌株BF-6降解苯酚有很大影响。
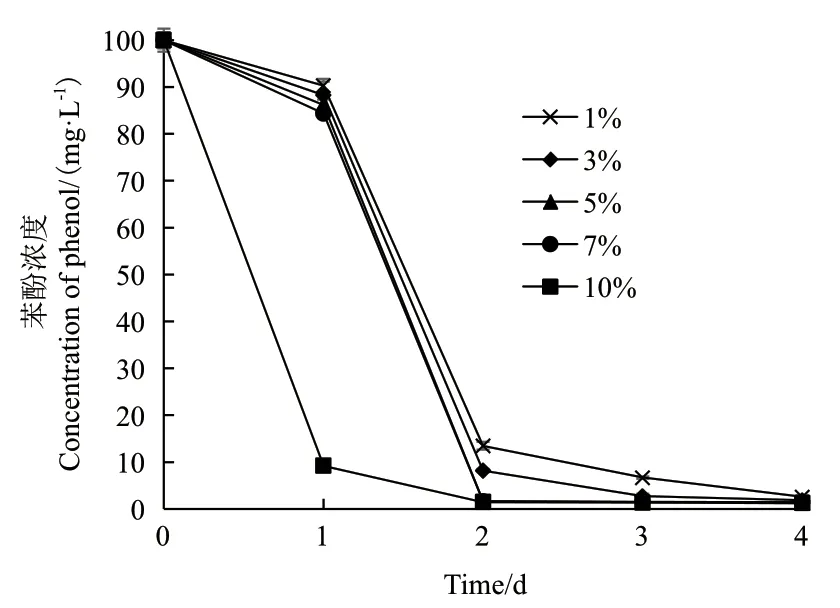
图7 接种量对菌株BF-6降解苯酚的影响Fig.7 Effect of inoculum quantity on the degradation of phenol by strain BF-6
2.2.6 金属离子对菌株BF-6降解苯酚的影响 微生物是利用其产生的酶催化污染物进行降解的,很多金属离子是酶的激活剂,但也有很多金属离子往往会破坏酶的蛋白结构进而使酶失去活性。因此,我们对常见金属离子对菌株BF-6降解苯酚能力的影响进行了研究。由图8可以看出,与接种菌株BF-6而不额外添加金属离子的对照相比,除0.5 mmol/L的Fe3+、Ca2+和Cr3+对菌株BF-6降解苯酚没有影响之外,其他金属离子均对菌株BF-6降解苯酚产生了很强的抑制作用。

图8 金属离子对菌株BF-6降解苯酚的影响Fig.8 Effect of metal ions on the degradation of phenol by strain BF-6
2.3 菌株BF-6降解苯酚途径
微生物对污染物的降解都是通过其分泌的酶进行催化的,研究表明参与苯酚好氧降解的关键酶有苯酚羟化酶和邻苯二酚双加氧酶。将菌株BF-6用苯酚进行诱导培养后,利用紫外分光光度计检测其胞内酶液的苯酚羟化酶和邻苯二酚双加氧酶活性(图9)。由图9-A可以看出,在苯酚羟化酶活性测定过程中,当以NADPH为辅酶时,在反应的30 min内,随着反应时间的延长,340 nm的吸光值逐渐降低,即NADPH逐渐减少,表明粗酶液中含有苯酚羟化酶活性,该酶催化苯酚转化为邻苯二酚,所以消耗了NADPH,经计算该粗酶液中苯酚羟化酶活力约为0.71 U/mg。由图9-B可以看出,在邻苯二酚双加氧酶活性测定的10 min内,随着反应时间的延长,260 nm处的吸光值明显增加,但在375 nm处未检测到吸光值的变化,该结果表明菌株BF-6的粗酶液含有邻苯二酚1,2-双加氧酶活性,但不含有邻苯二酚2,3-双加氧酶活性,经计算该粗酶液中邻苯二酚1,2-双加氧酶活力约为13.39 U/mg。上述酶活测定结果表明菌株BF-6对苯酚的降解首先是通过苯酚羟化酶催化苯酚转化为邻苯二酚,然后邻苯二酚在邻苯二酚1,2-双加氧酶的催化下转化为顺,顺-黏糠酸,即菌株BF-6是通过邻位途径实现苯酚降解的。
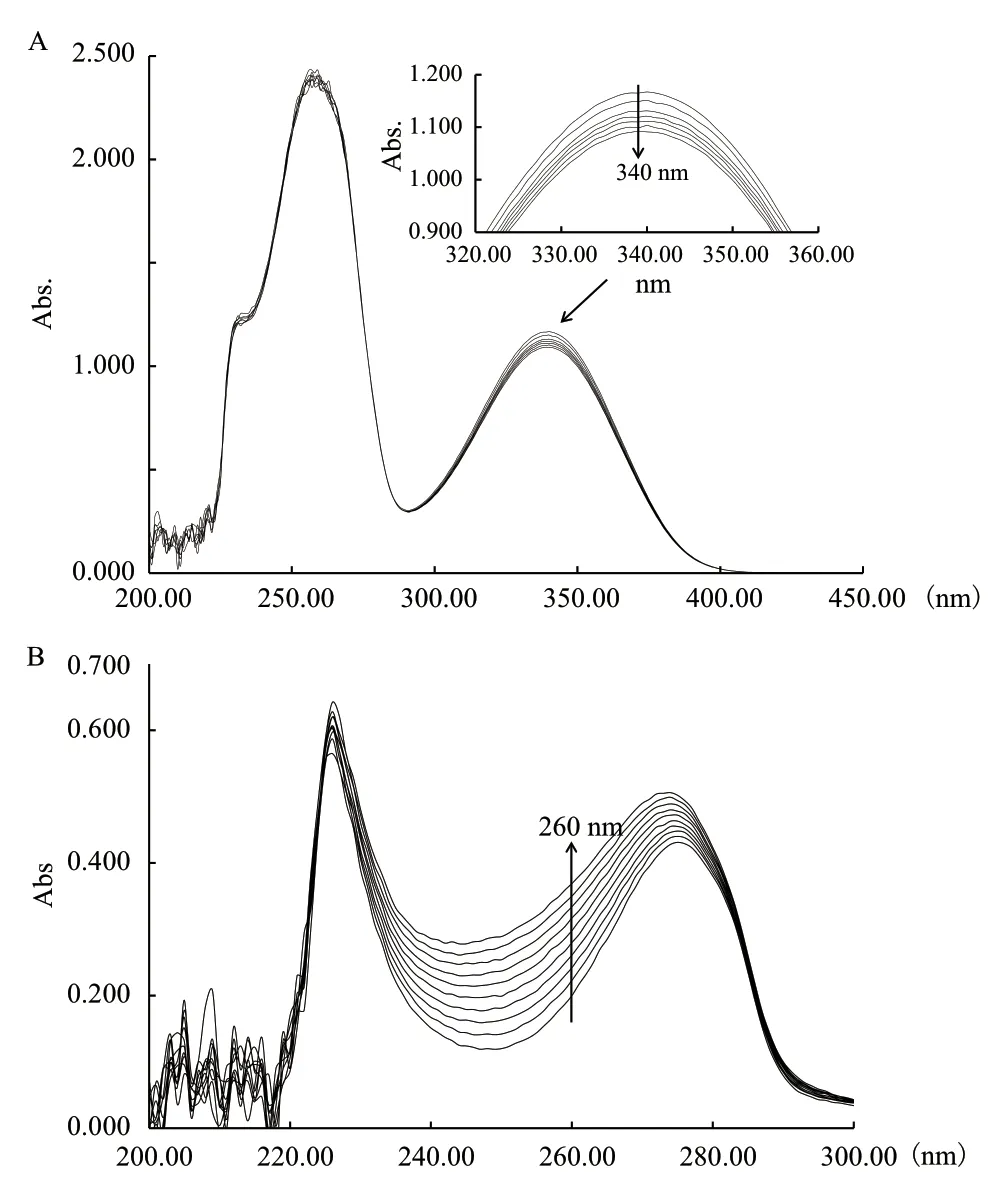
图9 苯酚羟化酶(A)和邻苯二酚双加氧酶(B)活性测定Fig.9 Determination of phenol hydroxylase(A)and catechol dioxygenase(B)
3 讨论
苯酚是最常见的工业有机污染物,利用微生物降解苯酚是解决苯酚环境污染问题最理想的一种方式。自然环境中很多微生物能够降解苯酚,特别是在含有苯酚的工业废水处理系统中,往往可以分离到能够高效降解苯酚的微生物菌株。本研究从农药厂废水处理系统中分离到了能够降解苯酚的菌株BF-6,通过形态特征、生理生化试验和16S rRNA基因序列分析将其鉴定为假黄单胞菌属(Pseudoxanthomonas)。关于微生物降解苯酚的报道虽然已有很多,但关于假黄单胞菌降解苯酚的研究还未见报道。菌株BF-6在温度为20-37℃和pH值为5-10的环境条件下均可实现对苯酚的高效降解,其在37℃、pH8.0和5%接种条件下,36 h内可将100 mg/L苯酚降解97.79%。虽然该菌株对苯酚的降解能力低于已报道的其他菌株[5,9-10],但本研究对于丰富苯酚微生物降解资源亦具有重要意义。
目前苯酚微生物降解的代谢途径研究已较为透彻,特别是有氧代谢途径普遍认为是微生物首先通过苯酚羟化酶使苯酚转化为邻苯二酚,然后邻苯二酚在邻苯二酚双加氧酶作用下打开苯环,并进一步通过TCA循环使其转化为微生物的细胞物质[21]。苯酚羟化酶是一种单加氧酶,含有一个FAD结合域,且需要以NADH或NADPH为辅酶才能表现出催化活性,所以通过测定酶活反应体系中NADH或NADPH含量变化即可检测酶液是否具有苯酚羟化酶活性[20]。本研究在添加有FAD和NADPH的菌株BF-6酶活反应体系中,通过紫外分光光度计检测到了NADPH在340 nm处吸收峰随着反应时间的延长不断降低,说明菌株BF-6粗酶液具有苯酚羟化酶活性,即证明菌株BF-6降解苯酚的第一步是通过苯酚羟化酶催化苯酚转化为邻苯二酚实现的。苯酚在转化为邻苯二酚后,可通过两种途径开环,即邻位途径,由邻苯二酚1,2-双加氧酶催化邻苯二酚转化为顺,顺-黏糠酸,该产物在260 nm有特异性吸收峰以及间位途径,由邻苯二酚2,3-双加氧酶催化邻苯二酚转化为2-羟基黏糠酸半醛,该产物在375 nm处有特异性吸收峰[22]。通过测定以邻苯二酚为底物的酶活反应体系中特异吸收峰的变化情况,可判断粗酶液具有哪种邻苯二酚双加氧酶,从而确定菌株是通过哪种途径使邻苯二酚开环[17]。本研究通过测定以邻苯二酚为底物的菌株BF-6粗酶反应体系特征性吸收峰的变化发现,菌株BF-6是通过邻位途径使邻苯二酚开环的。综上所述,菌株BF-6降解苯酚的途径为好氧途径,即其首先通过苯酚羟化酶催化苯酚转化为邻苯二酚,然后邻苯二酚再在邻苯二酚1,2-双加氧酶的催化下开环,进而进入TCA循环彻底降解,且使菌株以后续产物为碳源进行生长。本结果与金属离子对菌株BF-6降解苯酚的影响中Fe3+对菌株降解苯酚能力没有产生抑制作用相印证,因为大量研究表明邻苯二酚1,2-双加氧酶需要Fe3+作为活性中心[23]。
4 结论
从农药厂废水处理系统中获得了一株可以降解苯酚的菌株BF-6,经16S rRNA序列分析和生理生化试验鉴定其为假黄单胞菌(Pseudoxanthomonas sp.)。菌株BF-6能够以苯酚为唯一碳源进行生长,其在20-37℃和pH值5.0-10.0条件下都可以很好地降解100 mg/L的苯酚,5%接种量条件下36 h内降解率可以达到97.79%。Fe3+、Ca2+和Cr3+对菌株BF-6降解苯酚没有影响,而Fe2+、Mn2+、Co2+、Ni2+和Cu2+均对菌株BF-6降解苯酚产生了明显的抑制作用。经苯酚诱导的菌株BF-6粗酶液具有苯酚羟化酶和邻苯二酚1,2-双加氧酶活性,说明菌株BF-6降解苯酚的途径为好氧邻位途径。
