REV囊膜蛋白的原核表达、抗体制备及鉴定
2021-11-18朱丽霖王后坤陈雪阳高可丽梁雄燕杨玉莹
朱丽霖,王后坤,陈雪阳,高可丽,方 春,梁雄燕,杨玉莹
(长江大学 动物科学学院,湖北 荆州 434025)
【研究意义】禽网状内皮增生症(reticuloendotheliosis,RE)是禽类一种重要的致瘤性和免疫抑制性疾病,临床上将其命名为禽网状内皮组织增生症,是由反转录病毒科丙型逆转录病毒属-禽网状内皮增生症病毒(reticuloendotheliosis virus,REV)引起的鸡、火鸡等其他禽类发生的以急性网状细胞肿瘤、矮小病综合征(生长抑制综合征)、淋巴组织和其他组织的慢性肿瘤形成为特征的综合征[1-2]。该病不仅可导致肝脾肿大、具有显著坏死或淋巴组织增生性病变,还会严重影响鸡的生长发育和免疫反应。该病毒的假型带有禽白血病病毒的囊膜,可与鸡贫血病病毒、马立克氏病病毒等相互作用,引起腺胃炎、急性网状细胞肿瘤淋巴组织与其他组织慢性肿瘤形成[3-4]。REV 所引起的网状内皮组织增生症在世界各地均有报道,并且该病的流行呈逐年扩大趋势,给养禽业带来严重损失[5]。多个流行病学调查报告显示REV 在中国鸡群感染中,特别是地方品系鸡群中已相当普遍,易感宿主比马立克病或禽白血病更为广泛,鸡、火鸡、鸭、鹅和鹌鹑都可发生自然感染和发病,多种鸟类也可感染[6]。该病毒的致病性并不严重,但造成免疫抑制的潜在威胁不能忽视。REV 基因组由3 个结构基因(GAG、POI 和ENV)组成,侧翼是长端重复序列(LTRs)[7]。囊膜蛋白ENV 的主要成熟基因产物是表面糖蛋白(gp90)和跨膜蛋白(gp20)[8]。含有连续和不连续表位的gp90 蛋白作为显性蛋白[6],具有病毒的型特异性,该蛋白负责诱导动物产生保护性抗体引发免疫反应,是应用于REV 诊断的良好选择[9]。【前人研究进展】Witter[10]建立了IFA 检测REV 的方法,可以快速对临床样本做出检测,耗时短、灵敏度高、准确性强,但需要使用荧光显微镜这种精密的仪器进行结果读取,具有明显的环境限制,所以并不太适用于现场诊断。1993 年ALY[11]基于SNV 的LYR 序列设计一对PCR 引物,能从囊淋巴瘤和非肿瘤脑组织中检出REV,而ALV 和MDV 引起的肿瘤组织病料则不能被该引物扩增。其敏感性比ELISA、核酸探针至少高10 倍。【本研究切入点】哈兽研李凯等[12]针对gp90 基因建立了检测REV 的荧光定量PCR 方法,其敏感性是普通PCR 的100 倍。杨叶[11]等对REV 的免疫显性蛋白gp90 的氨基酸序列进行分析和对REV 单抗抗原表位分析结果的基础上,合成了5 段多肽,通过已知的REV 阳性血清与多肽反应结果,筛选获得一条反应性良好的抗原多肽。将筛选出的多肽作为抗原包被酶标板,优化后建立了特异性检测REV 抗体的多肽ELISA 方法。有研究用纯化的REV 重组CA 蛋白免疫新西兰兔制备兔抗CA 蛋白多克隆抗体[4],为REV 的检测及CA 基因的深入研究奠定了基础。【拟解决的关键问题】本研究中,笔者通过构建两种原核表达载体分别表达REV-gp90 蛋白,重组蛋白纯化后制备针对REV-gp90 蛋白的多克隆抗体,间接ELISA 检测抗体效价,并对其特异性进行鉴定,以期为防控禽网状内皮组织增生病奠定基础。
1 材料与方法
1.1 材料
1.1.1 毒株与载体 禽网状内皮增生REV HB2015021(KY581581)、大肠杆菌DH5α 和BL21、表达载体pET-28a和pGEX-6p-1,均由长江大学病原微生物与分子实验室保存。
1.1.2 主要试剂 克隆试剂盒(CV1901),购自北京艾德莱生物科技有限公司;琼脂糖凝胶DNA 回收试剂盒(GK2043)、质粒小提试剂盒(GK2004),均购自上海捷瑞生物工程有限公司;DNA 连接酶(6022),购自TaKaRa 宝生物工程(大连)有限公司;Ni2+琼脂糖柱料(HZ1003-7),购自武汉汇研生物科技有限公司;Bradford蛋白浓度测定试剂盒(P0006),购自上海碧云天生物技术有限公司;弗氏完全佐剂(F5881)、弗氏不完全佐剂(F5506),均购自Sigma 公司;DF-1 细胞购自中科院上海兽医研究所,本实验室冻存;0.25%胰酶(GP3108-100 mL),购自Genview 公司;胎牛血清(900-108),购自Gemini 公司;DMEM 细胞培养基(C11995500BT),购自Gbico 公司;LB 培养基,上海生工生物技术有限公司产品;FITC 标记的山羊抗小鼠IgG(D110105)、HRP 标记山羊抗小鼠IgG(D110087),均购自生工生物工程(上海)股份有限公司;其他试剂均由长江大学动物病原微生物学实验室提供。
1.1.3 试验动物 健康的Balb/c小鼠,购自长江大学医学院实验动物中心。
1.2 方法
1.2.1 目的基因的扩增 根据REV 毒株HB2015021(KY581581),设计了用于扩增gp90 基因的特异性引物,引物序列见表1,以感染REV(HB2015021)DF-1 细胞基因组DNA 为模板扩增REV-gp90。引物由武汉擎科创新生物技术公司合成。PCR 反应体系如下(25 μL):2×Mix:12.5 μL、gp90-F(10 μmol/L)1 μL、gp90-R(10 μmol/L)1 μL、DNA 模板1.5 μL、去离子水9 μL。反应条件为:预变性95 ℃3 min;变性95 ℃15 s、退火58 ℃20 s、延伸72 ℃90 s,共30个循环;终末延伸72 ℃10 min;16 ℃保温。
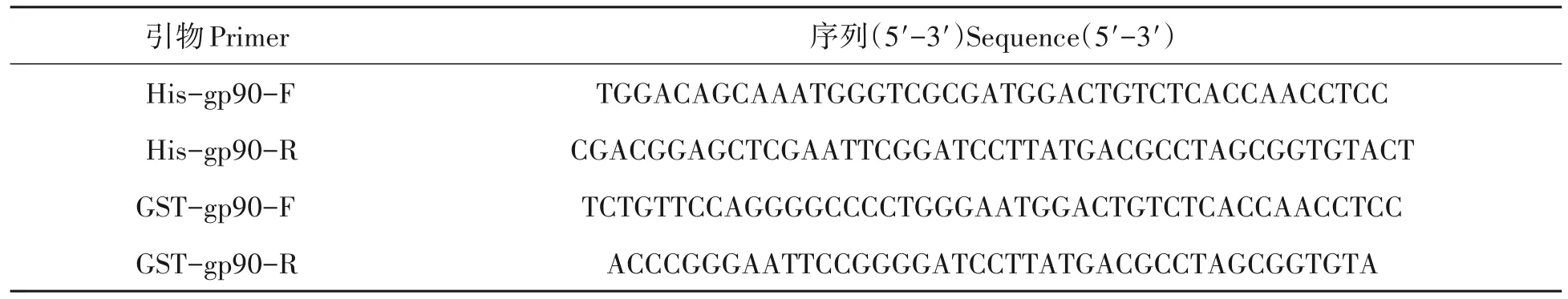
表1 REV-gp90引物序列Tab.1 Primers sequence of REV-gp90
1.2.2 重组表达载体质粒的构建 目的基因gp90 用琼脂糖凝胶回收试剂盒进行回收,并按克隆试剂盒说明书将其分别连接至pET-28a 载体和pGEX-6p-1 载体上,42 ℃,1 h。将连接之后的产物转入感受态DH5α 细菌内,分别涂布于带有卡那霉素(Kana)与氨苄(Amp)抗性平板上,37 ℃过夜培养后,分别挑选5 个单菌落进行PCR鉴定,阳性克隆保存菌液,并通过质粒提取试剂盒提取质粒。
1.2.3 重组融合蛋白的诱导表达 将测序正确的原核重组表达质粒pET-28a-REV-gp90 和pGEX-6p-1-REV-gp90 用热激的方法分别转化进表达菌株BL21中,分别均匀涂布于Kana 和Amp 平板上,37 ℃过夜培养后,挑选阳性菌落接入2 支装有对应抗生素的液体LB 培养基(每支4 mL)中培养,其中一支用于后续试验,另一支用于诱导表达。待菌液培养至OD 值约0.6 时,在EP 管中加入1 mL 菌液和1 μL 的IPTG,至终浓度为1 mmol/L,作为诱导组;取1 mL 菌液作为未诱导对照,His 标签重组蛋白诱导条件:30 ℃、220 r/min 诱导5 h;GST 标签重组蛋白诱导条件:37 ℃、220 r/min 诱导4 h。12 000 r/min 离心3 min收集菌体,用40 μL 的PBS 重悬菌体后,按比例加入Loading Buffer,混匀后在沸水中煮8~10 min,配制12%Gel SDS-PAGE分离胶、5%SDS-PAGE浓缩胶,进行凝胶电泳检测。
1.2.4 重组融合蛋白的纯化 挑选表达量较高的菌株在适宜温度下对其进行大量诱导和蛋白纯化。将用于后续实验的菌液扩大培养,加入诱导剂,按两种标签蛋白诱导条件分别进行诱导表达。纯化前需要对表达的融合蛋白是否为可溶性进行检测,取适量收集的菌体用5 mL PBS 重悬,再用超声波破碎仪裂解,工作条件如下:200 W 破碎5 s,间隔10 s,工作总时间90 min,离心后分别取上清和沉淀进行SDSPAGE凝胶检测。
收集重组质粒pET-28a-REV-gp90 的菌体使用20 mL PBS 洗涤菌体,12 000 r/min 4 ℃冷冻离心5 min,弃去上清,菌体用20 mL PBS 重悬后,在冰水混合物中冰浴30 min,再将重悬的菌液置于超声破碎仪裂解;超声波裂解结束后冷冻离心20 min,用0.45 μm滤器过滤除去杂质,备用。
用2 mL 的Ni2+亲和层析柱料填充装置,按照说明书操作。从小到大依次加入梯度咪唑以洗脱吸附的REV-His-gp90蛋白,每种洗脱液抽取40 μL用于SDS-PAGE检测,剩余蛋白液-80 ℃储存备用。
收集重组质粒pGEX-6p-1-REV-gp90 的菌体使用20 mL Buffer A(Tris base 3.0274 g,EDTA 0.3 g,NaCl 3 g,加400 mL 去离子水调节PH 至8.0,溶解后定容至500 mL,常温保存)。洗涤菌体,12 000 r/min 4 ℃冷冻离心10 min,弃去上清;用Buffer B(Tris base 3.027 4 g,EDTA 0.3 g,NaCl 3 g,5 mL 1% Nonidet P-40,去离子水溶解,定容至500 mL,常温保存)。重新悬浮菌体,加入溶菌酶和PMSF 至终浓度为分别为1 mg/mL 和1 mmol/L,在冰水混合物中冰浴30 min,后将重悬的菌液置于超声破碎仪裂解,破碎5 s,间隔10 s,功率200 W,工作总时间90 min;超声波裂解结束后12 000 r/min。4 ℃冷冻离心20 min;收集上清并用Buffer Ⅰ(3.027 4 g Tris base,0.3 g EDTA,3 g NaCl,120 g 尿素,TritonX-100 2.5 mL,去离子水溶解,调节pH 至8.0,最后定容至250 mL,常温保存)。重悬沉淀,后将重悬的沉淀置于超声破碎仪裂解,破碎5 s,间隔10 s,功率200 W,工作总时间90 min;超声波裂解结束后12 000 r/min。4 ℃冷冻离心20 min;收集上清并用Buffer Ⅱ(3.0274 g Tris base,0.3 g EDTA,3 g NaCl,TritonX-100 15 mL,去离子水溶解后定容至500 mL,常温保存)。重悬沉淀,后将重悬的沉淀置于超声破碎仪裂解,破碎5 s,间隔10 s,功率200 W,工作总时间90 min;超声波裂解结束后12 000 r/min。4 ℃冷冻离心20 min;收集上清并用Buffer Ⅲ(3.027 4 g Tris base,0.3 g EDTA,3 g NaCl,盐酸胍95.5 g,TritonX-100 2.5 mL,去离子水溶解后定容至500 mL,常温保存)。重悬沉淀,后将重悬的沉淀置于超声破碎仪裂解,破碎5 s,间隔10 s,功率200 W,工作总时间90 min;超声波裂解结束后12 000 r/min。4 ℃冷冻离心20 min;依据沉淀的多少加入Buffer C(240 g 尿素,6.054 8 g Tris base,EDTA 0.3 g,脱氧胆酸钠0.414 g,TritonX-100 2.5 mL,β-巯基乙醇360 μL,去离子水溶解,定容至500 mL)。沉淀溶解后,抽取40 μL 用于SDSPAGE 检测,剩余分装于-80 ℃保存。
1.2.5 多克隆抗体的制备 纯化的融合蛋白REV-His-gp90 用Bradford 蛋白定量试剂盒测定蛋白浓度后为免疫用抗原,免疫4 只7 周龄的Balb/c 小鼠。首次免疫用100 μg 融合蛋白与等量的弗氏完全佐剂乳化后皮下多点注射;第二次和第三次免疫用弗氏不完全佐剂进行乳化,每只小鼠抗原用量为100 μg,免疫间隔时间为2 周。三免后3 d 眼球摘除放血处死小鼠,25 ℃水平放置2 h,4 ℃水平放置4 h,4 000 r/min 离心10 min,制备抗血清。
1.2.6 间接ELISA 检测多克隆抗体效价 将纯化的REV-GST-gp90 蛋白作为包被抗原,将包被抗原用0.05 mol/L碳酸盐缓冲液稀释至2 μg/mL,每孔100 μL添加至酶标板中,置于4 ℃过夜。用PBST将酶标板洗涤3次,拍干后加入5%脱脂乳,37 ℃封闭2 h。用PBS将小鼠血清稀释1 000倍,涡旋混匀,取100 μL进行10倍倍比稀释,分别加入酶标板中,37 ℃孵育2 h后用PBST洗涤3次并拍干,用5%脱脂乳1∶2 000倍稀释辣根过氧化物酶标记的羊抗鼠IgG,并加至酶标板中,37 ℃作用1 h。孵育结束后洗涤3 次并拍干,避光加入显色液每孔100 μL,充分反应约15 min 后,每孔加入50 μL 终止液终止显色。将终止显色的酶标板放入多功能酶标仪,测量OD450以P/N≥2为判定标准。
1.2.7 Western blot 检测分析 为了检测制备的多克隆抗体是否能够与REV-gp90特异性发生反应,将BL21-pET-28a-REV-gp90 和BL21-pET-28a 分别接种至Kana 抗性LB 培养基,诱导表达后离心收集菌体。将菌体裂解液经SDS-PAGE 分离后,通过湿转膜法(230 mA,70 min)将分离胶中的蛋白质转移至PVDF 膜上,以重组融合蛋白REV-His-gp90 为检测抗原,以收集诱导的BL21-pET-28a 蛋白为阴性对照,5%的脱脂乳室温封闭2 h,用TBST 洗涤3 次,加入制备的多克隆抗体(1∶500 稀释),室温下孵育2 h,用TBST 洗涤3 次,最后加入HRP 标记山羊抗小鼠IgG(1:5 000 稀释),室温孵育1 h,用TBST 洗涤5 次,通过ECL化学发光显影并拍照。
1.2.8 间接免疫荧光(IFA)按照文献[13]的检测方法,用PBS 将处于对数生长期的DF-1 单层细胞轻轻洗两遍,接种REV 病毒,用含有1%胎牛血清的DMEM 完全培养基培养2 h,弃上清,更换为5%血清的完全培养基,同时设置未接毒的正常DF-1 细胞作为阴性对照,5 d 后弃上清。用PBS 洗两遍,加入预冷的4%多聚甲醛室温固定15 min;PBS 洗两遍,加入0.5%Triton X-100 透膜剂,37 ℃反应15 min;用PBS 洗两遍后加入1% FBS 作为封闭液,37 ℃封闭1 h;PBS 洗两遍,加入1∶500 稀释的多抗,37 ℃作用60 min;用PBS 洗3 遍,再加入稀释的FITC 羊抗鼠荧光二抗,37 ℃避光反应45 min,避光状态下用PBS洗3 遍,每次15 min。在荧光显微镜下观察,空白对照无荧光,而实验组出现亮绿色荧光则为阳性,反之则为阴性。
2 结果与分析
2.1 重组表达质粒的构建
PCR 扩增目的基因gp90 片段,见图1,使用无缝克隆试剂盒将gp90 片段分别与pET-28a 和pGEX-6p-1载体连接。将连接产物转化至感受态DH5α细菌内,过夜培养挑选菌落,并用设计的特异性引物进行PCR鉴定(图2)。

图1 REV-gp90基因扩增PCR鉴定结果Fig.1 Identification of REV-gp90 gene by PCR

图2 重组质粒的PCR鉴定Fig.2 Identification of recombinant plasmid by PCR
2.2 重组蛋白的表达、纯化和浓度测定
将pET-28a-REV-gp90和pGEX-6p-1-REV-gp90重组质粒转化BL21感受态细胞中,分别均匀涂板,挑菌后通过PCR 进行鉴定,阳性克隆加入IPTG 进行诱导,取诱导后裂解菌体的上清和沉淀进行SDSPAGE 检测。结果表明REV-His-gp90 和REV-GST-gp90 均为包涵体蛋白,分别为43 ku 和69 ku(图3)。经过纯化后均获得较为精纯的蛋白(图4)。纯化的蛋白用Bradford 蛋白定量试剂盒测定浓度,分别为0.65 mg/mL和1.16 mg/mL。
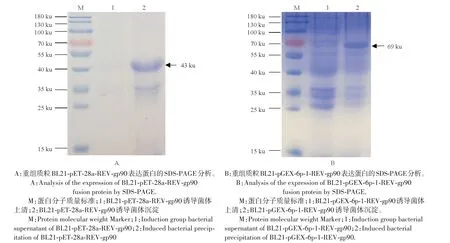
图3 重组质粒表达蛋白的SDS-PAGE分析Fig.3 Analysis of the expression of fusion protein by SDS-PAGE

图4 蛋白纯化的SDS-PAGE分析Fig.4 Analysis of protein purification by SDS-PAGE
2.3 多克隆抗体的制备及鉴定
按前述方法制备多克隆抗体,在第三次免疫后3 d的小鼠经眼球摘除采血获得抗REV-gp90 多抗血清。以纯化的REV-GST-gp90 重组蛋白作为包被抗原,采用间接ELISA 的方法对纯化的方法进行测定,首先将纯化的抗体以1∶1 000 倍的比例稀释,然后,剩余的以等体积稀释进行倍比稀释,以P/N≥2 为判定标准,测得该多抗血清效价为1∶64 000,OD450检测吸光度结果如图5。为了检测制备的多克隆抗体的特异性,通过Western-blot检测,见图6,在预期的位置出现特异性目的条带,且阴性对照组无条带。将制备的多抗血清与感染REV 病毒5 d 的DF-1 细胞进行IFA,均有荧光,如图7 所示,结果表明所制备的多克隆抗体可以与REV 发生特异性反应。表明本实验制备的多抗血清有良好的特异性。

图5 抗血清的效价测定Fig.5 Antiserum titer determination

图7 IFA检测多抗血清特异性Fig.7 Specific detection of polyclonal antibody by IFA
3 讨论与结论
RE 感染在我国地方品系鸡群中已相当普遍[14-16],鸡、火鸡、鸭、鹅、麻雀和鹌鹑等都易染。REV 对低日龄鸡感染力较强[17],主要是通过垂直和水平传播,小鸡感染REV 后如未及时发现将对整个鸡群造成大规模感染的威胁。而REV 与MDV、CAV、ALV 等免疫抑制性病毒在鸡群中混合感染给养禽业带来的危害更加严重[14],同时也给REV的监测带来了困难。因此,特异性强、灵敏性高的REV检测技术亟待发展。本研究以pET-28a 为原核表达载体构建His 标签的重组REV-gp90 蛋白,并通过Ni2+亲和层系柱进行纯化,免疫Balb/c 小鼠,制备抗REV-His-gp90 蛋白的多克隆抗体。为了防止由于识别标签蛋白而出现假阳性结果,本研究另外构建了pGEX-6p-1为载体的REV-GST-gp90蛋白,用其作为间接ELISA中的包被抗原。原核表达的REV-His-gp90蛋白具有良好的免疫原性,可以诱导小鼠产生高水平的免疫应答反应。为了验证所制备的多克隆抗体的特异性,本实验采用Western blot和IFA对其进行分析。WB结果显示该多克隆抗体能与REV-His-gp90 发生特异性反应,同时,间接免疫荧光结果表明所制备的REVgp90 蛋白及其多克隆抗体能与REV 病毒粒子特异结合,可以作为反映REV 感染、诊断病情及预后的新检测系统,且该检测方法简便快速,不需要过多仪器,在临床上也具有实用价值。WB和IFA 结果证明本实验制备的抗REV-gp90多克隆抗体具有良好的特异性。本实验获得的多克隆抗体以及检测方法,将为后期REV-gp90 蛋白生物学及免疫学功能的研究、单克隆抗体的制备以及REV 检测技术发展提供生物材料和研究工具。
