NtPHYB1与储藏温度互作调控烟草种子光休眠和后熟
2021-11-14王尧,董帅,张民,李振华
王尧,董帅,张民,李振华

摘 要:為了解烟草种子光休眠与后熟的分子机理,本研究以野生型(WT)、NtPHYB1过表达(NtPHYB1-OE)和NtPHYB1 RNA干扰(NtPHYB1-RNAi)3种烟草种子为材料,在恒温和变温2种环境下进行后熟。结果表明,与WT新采收种子相比,NtPHYB1-RNAi新采收种子光休眠显著加深,而NtPHYB1-OE新采收种子光休眠未显著变浅。与恒温后熟相比,变温下WT和NTPHYB1-OE种子后熟加快,而NTPHYB1-RNAi种子变化不显著。与WT新采收种子相比,NtPHYB1-RNAi新采收种子中NtABI3的表达量显著提高,NtPHYB1-OE新采收种子中NtABI5的表达量显著降低。在变温下后熟,WT种子中NtNCED6和NtGA2ox2下降变缓,NtCYP707A1和 NtGA3ox2上升变缓;NtPHYB1-RNAi种子中NtNCED6下降变缓,而NtCYP707A1上升变缓;NtPHYB1-OE种子中NtNCED6下降变缓,而NtCYP707A1、NtGA3ox2、NtGA2ox2和NtGAI下降均加快。综上所述,NtPHYB1能够协同储藏温度影响ABA和GA的信号和代谢基因表达从而调控种子光休眠和后熟。
关键词:光休眠;后熟;NtPHYB1;变温;种子萌发;植物激素
NtPHYB1 Interacts with Storage Temperature to Regulate Seed Photodormancy and After-ripening in Nicotiana tabacum L.
WANG Yao, DONG Shuai, ZHANG Min, LI Zhenhua*
(College of Agronomy, Guizhou University, Guiyang 550025, China)
Abstract: To reveal the molecular mechanism of seed photodormancy and after-ripening in tobacco, wild-type (WT), NtPHYB1 over expression (NtPHYB1-OE) and deficient (NtPHYB1-RNAi) tobacco seeds were used in this study, in conducting after-ripening experiments in two environments with constant or natural temperature. The results showed that NtPHYB1-RNAi fresh seeds had a significant increase in photodormant level compared with WT fresh seeds; However, the photodormancy of NtPHYB1-OE fresh seeds did not show significant change. The after-ripening of WT and NtPHYB1-OE seeds was accelerated under variable temperature compared with under constant temperature storage, while that of NtPHYB1-RNAi seeds was not significantly changed. Compared with WT fresh seeds, the expression of NtABI3 in NtPHYB1-RNAi fresh seeds was significantly increased, while the expression of NtABI5 in NtPHYB1-OE fresh seeds was significantly decreased. In WT seeds, expression of NtNCED6 and NtGA2ox2 decreased slowly when after-ripening under variable temperature, while NtCYP707A1 and NtGA3ox2 were up-regulated slowly. In NtPHYB1-RNAi seeds, NtNCED6 expression decreased slowly then, while NtCYP707A1 expression increased slowly. In NtPHYB1-OE seeds, NtNCED6 expression decreased slowly then, while expression of NtCYP707A1, NtGA3ox2, NtGA2ox2 and NtGAI decreased faster. In conclusion, NtPHYB1 interacts with storage temperature to regulate photodormancy and after-ripening by regulating expressions of genes involved in ABA and GA signal and metabolism in tobacco seeds.
Keywords: photodormancy; after-ripening; NtPHYB1; variable temperature; seed germination; phytochrome
种子光休眠(photodormancy)是指具有生活力的种子在黑暗环境下暂时不能萌发的现象。至今,已经在上千物种中发现种子光休眠,特别是小粒种子物种,种子光休眠较为普遍。在生产上,丸化有利于小粒种子播种,但丸化后,喜光性(photophil)种子易出现光休眠,严重影响出苗率。因此,研究种子光休眠和后熟的调控机制,对于指导光敏感种子制种和播种均具有重要意义。
光照和后熟均具有解除种子休眠和促进萌发
的作用。目前关于光解除种子休眠和促进萌发的分子机制研究较为深入,它通过激发光敏色素(Phytochrome,PHY)信号通路解除种子休眠和促进萌发[1-2]。早在1934年,FLINT[3]在莴苣中发现光调控种子休眠和萌发现象。1952年,BORTHWICK等[4]发现莴苣种子萌发受红光和远红光可逆转换调控并发现PHY。90年代末,在莴苣种子中发现PHY调节赤霉素(GA)的合成[5]和脱落酸(Abscisic acid,ABA)的分解[6],从而促进喜光性种子萌发[7-8]。2012年,LEE等[9]在拟南芥中发现了PHYB和PHYA时空特异性调控ABA和GA代谢基因(GA3ox1,GA2ox2,NCED6,NCED9,GA3ox2CYP707A2)与信号基因(ABI3,ABI5,RGA)表达控制种子萌发。空间上PHYA和PHYB分别定位于胚和胚乳中,时间上胚的作用晚于胚乳[10]。2016年,JIANG等[11]发现在拟南芥中PHYB不仅参与调控红光/远红光可逆转换的种子萌发,而且调控种子初生休眠。2019年,MERAI等[12]发现光促进需光性种子萌发和抑制厌光性种子萌发均需要PHY的参与;而且激素ABA和GA调控需光性种子、光中性种子和抑制厌光性种子萌发是保守的,均表现为ABA抑制而GA促进萌发。
新采收的烟草种子普遍存在光休眠,在黑暗条件下,即使延长培育时间,种子亦不能萌发。LEUBNER-METZGER等[13]发现后熟(After-ripening)有利于打破烟草种子光休眠,在自然条件下干燥储藏6个月后,烟草种子将完成后熟,具备在黑暗下萌发的能力。适宜的含水量(7%~10%)加速烟草种子后熟,而含水量过高(>15%)或者过低(<7%)减缓种子后熟。宋碧清等[14]发现较高温度下(25 ℃)下烟草种子后熟时间较低温下(18℃)明显缩短。然而,关于后熟解除种子光休眠的分子机理知之甚少。因此,本研究以野生型(WT)、NtPHYB1过表达(NtPHYB1-OE)和NtPHYB1 RNAi种子为材料,在变温和恒温2种环境下进行储藏,研究新采收和后熟种子萌发差异;在此基础上,研究后熟过程种子对ABA和GA的敏感性变化及ABA和GA代谢和信号基因表达变化。研究结果将有助于深入理解后熟解除种子光休眠和促进萌发的分子机理。
1 材料与方法
1.1 供试材料
烟草品种K326的WT、NtPHYB1-OE和NtPHYB1-RNAi种子由贵州省烟草科学研究院提供。NtPHYB1基因克隆、遗传转化和进化分析详见课题组已公开发表的论文[15]。
1.2 试验设计
以K326的WT、NtPHYB1-OE和NtPHYB1- RNAi T3代种子为供试材料,分析基因型和后熟处理(包括后熟温度和后熟时间)对种子光休眠的影响(表1)。5种处理分别为新采收种子(FS),在变温条件下(日均温15 ℃,日较差6 ℃)后熟1(NT1)和2个月(NT2)的种子,和在恒温(25 ℃)条件下后熟1(CT1)和2个月(CT2)的种子,基因型×后熟共计15个处理。
1.3 试验方法
1.3.1 种子萌发试验 采用本课题组已经公开发表的方法[16]。将经0.5% CuSO4消毒后的100粒种子均匀点播在0.8%的琼脂发芽床表面,将培养皿置于25 ℃全天黑暗的人工气候箱内萌发。重复3次。从第2天开始每隔24 h记录一次种子萌发数(以种子露白计为萌发),连续记录至第7天为止。计算萌发势(第4天)、萌发率(第7天)和萌发指数。
1.3.2 激素敏感性试验 称取一定量的GA3、ABA、PAC(多效唑,GA3合成抑制剂)、FLU(氟啶酮,ABA合成抑制剂)粉末用少量无水乙醇溶解后,分别加入蒸馏水配制成10-6、10-5、10-4、10-3 mol/L的GA3溶液;10-7、10-6、10-5、10-4 mol/L的ABA溶液;5×10-6、5×10-5 mol/L的PAC溶液;5×10-6、5×10-5 mol/L的FLU溶液。在培养皿内分别加入1 mL上述浓度的溶液,然后加入0.8%琼脂灭菌液,制作发芽床。然后用1.3.1的方法测定种子在不同发芽床上的发芽能力。
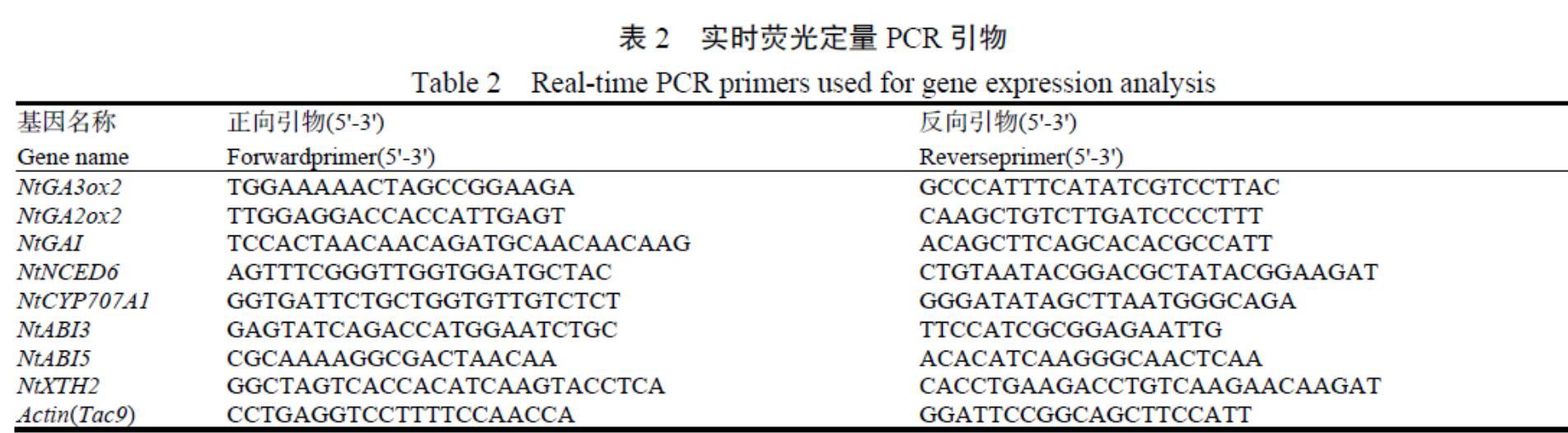
1.3.3 ABA和GA代谢和信号基因表达测定 RT-PCR采用实验室已经公开发表的方法[16]。分别取0.1 g不同基因型FS、NT1、CT1、NT2、CT2、的煙草种子装入1.5 mL的离心管,迅速放入液氮中冷冻3 min,再放入?80 ℃超低温冰箱备用。采用TIANGEN RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司,中国)提取烟草种子RNA。采用TaKaRaPrimeScript? II 1st Strand
cDNA Synthesis 试剂盒(宝生物工程有限公司,中国)进行RNA反转录。采用TaKaRaTB Green? Premix Ex Taq?(TliRNaseH Plus)荧光定量试剂盒进行RT-PCR反应。反应体系为:10 ?L TBGreen Premix Ex TaqII(2X),0.4 ?L ROX Reference Dye(50X),2 ?L稀释为40 ng/?L的cDNA,上下游引物各0.8 ?L(表2),用水补足至20 ?L。PCR反应的条件为:95 ℃预变性0.5 min,然后95 ℃ 5 s,58 ℃ 30 s进行40个循环。采用StepOnePlusReal-Time PCR仪(应用生物系统公司,美国)进行基因的扩增。依据2-△△Ct法计算相对表达水平[17]。目标基因及其引物见表2。
1.3.4 统计分析 用Excel软件进行数据整理。运用SPSS Statistics 25对数据进行多重(图基HSDa)比较;采用GLM模型(General Linear Model, GLM)中的全因子模型及Ⅲ型平方和评价基因型、后熟温度、后熟期及其互作对种子萌发的影响。最后采用Origin 8.5作图。
2 结 果
2.1 NtPHYB1和温度对种子后熟的影响
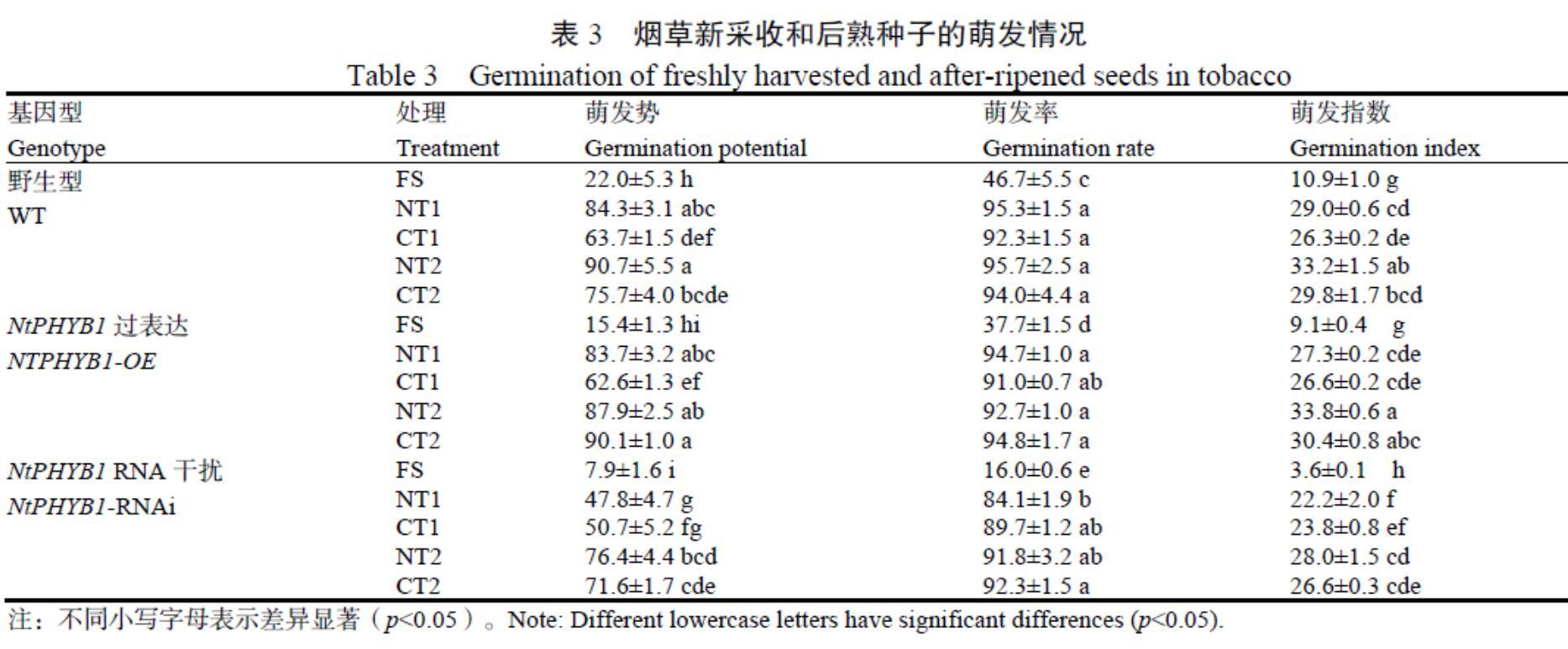
烟草种子萌发情况见表3。3种基因型新采收种子萌发势、萌发率和萌发指数均存在一定差异:NtPHYB1-RNAi种子萌发势、萌发率和萌发指数均显著低于WT种子;NTPHYB1-OE种子萌发势和萌发指数与WT种子无显著差异,但萌发率显著低于WT种子。可见NtPHYB1-RNAi种子光休眠水平加深,而NtPHYB1-OE种子光休眠未显著变浅。方差分析结果(表4)也表明,基因型显著影响了種子光休眠与后熟。
与新采收种子相比,3种基因型种子恒温或变温后熟1月或2月,其种子萌发势、萌发率和萌发指数均显著提高;且后熟2月的种子萌发势和萌发指数均高于或显著高于后熟1个月的处理,而萌发率没有显著差异。后熟1月时,经恒温后熟处理的WT和NTPHYB1-OE种子的萌发势显著低于变温后熟处理;后熟2月时,恒温后熟处理的WT种子的萌发势依然显著低于变温后熟处理。
由方差分析结果(表4)可知,后熟时间和后熟温度均显著影响种子萌发,后熟时间延长更有利于打破种子光休眠,变温储藏种子后熟普遍快于常温储藏。基因型、后熟温度和后熟时间之间存在不同程度的互作,影响种子萌发势、萌发率和萌发指数。
2.2 烟草种子后熟过程中GA和ABA敏感性变化
由图1可知,WT、NtPHYB1-OE和NtPHYB1-RNAi等3种基因型新采收种子萌发率均较低,10-6~10-3 mol/L的GA3可促进种子萌发。变温或恒温后熟处理1或2月,种子萌发率均显著提高,几乎达到最大值,GA3的促进作用不再明显。
由图2-3可知,PAC和ABA具有抑制新采收烟草种子萌发的作用,且随着浓度增加,二者对种子萌发的抑制作用显著增强。后熟1个月,烟草种子萌发率显著提高,二者对种子萌发的抑制作用依然较强且随浓度增加而增强;后熟2个月,抑制作用明显减弱,但高浓度处理仍有较强抑制作用。3种基因型种子和2种后熟温度处理基本表现为相似规律。
由图4可知,5×10-5 mol/L FLU具有抑制WT和NtPHYB1-OE新采收种子萌发的作用,而对
NtPHYB1-RNAi种子的抑制作用不显著。随着后熟期延长,FLU对种子萌发的抑制作用在逐渐减弱。3种基因型种子和2种后熟温度处理基本表现为相似规律。
上述结果说明不同基因型种子后熟过程中对ABA和GA敏感性变化是相似的,新采收种子对GA3和ABA均较为敏感,它们分别促进和抑制种子萌发。随着后熟时间延长,外源GA3促进种子萌发和外源ABA抑制种子萌发的作用在逐渐减弱。
2.3 烟草种子后熟过程中ABA和GA代谢和信号基因表达变化
由图5可知,NtPHYB1-RNAi新采收种子中ABA合成关键基因NtNCED6,ABA分解关键基因NtCYP707A1和ABA信号关键调控基因NtABI3表达量显著高于WT种子;NtPHYB1-OE新采收种子中NtNCED6、NtCYP707A1和NtABI3表达量也显著高于WT种子,而NtABI5表达量则显著低于WT种子。上述结果说明与野生型新采收种子相比,NtPHYB1-RNAi新采收种子中ABA合成和分解代谢水平提高,ABA信号增强;而NtPHYB1-OE新采收种子中仅ABA合成和分解代谢水平提高。
随着后熟的进行,WT种子中NtNCED6和NtABI3,NtABI5表达量逐渐或波动下降,NtCYP707A1表达量逐渐升高;NtPHYB1-RNAi种子中NtNCED6、NtCYP707A1和NtABI3,NtABI5表达变化与WT种子基本一致,说明WT与NtPHYB1-RNAi烟草种子后熟过程中ABA合成代谢水平下降,分解代谢水平提高,信号也减弱,ABA对种子萌发的抑制作用逐渐降低。而NtPHYB1-OE种子中NtNCED6和NtABI3表达变化与WT种子基本一致,但NtCYP707A1和NtABI5表达变化与WT种子相反,显示NtPHYB1-OE烟草种子后熟过程中ABA合成和分解代谢水平均降低。
与恒温后熟相比,变温后熟时WT种子中NtNCED6下降变缓,而NtCYP707A1上升变缓,NtPHYB1-RNAi种子与WT种子变化规律基本一致,说明在变温后熟过程中NtPHYB1-RNAi与WT种子中ABA合成代谢水平下降,分解代谢水平上升,但与恒温后熟相比,变化减缓。NtPHYB1-OE种子中NtNCED6下降变缓,而NtCYP707A1下降加快,显示在变温后熟过程中NtPHYB1-OE烟草种子ABA合成代谢水平下降,但较恒温后熟减缓;ABA分解代谢水平下降,且较恒温后熟加快。
由图6可知,NtPHYB1-RNAi新采收种子中GA合成关键基因NtGA3ox2,GA信号关键基因NtGAI和细胞壁松弛关键基因NtXTH2的表达量显著高于WT新采收种子,但增加幅度较低;而NtPHYB1-OE新采收种子中NtGA3ox2、NtGA2ox2、NtGAI和NtXTH2的表达量均较WT种子显著增加数倍。显示与野生型种子相比,NtPHYB1-RNAi新采收种子中GA代谢和信号变化较小;而NtPHYB1-OE新采收种子GA代谢和信号变化较大。
后熟过程中,WT种子中NtGA3ox2表达量显著增加,NtGA2ox2表达量显著降低,显示烟草种子后熟过程中GA合成代谢水平提高,分解代谢水平降低,GA对种子萌发的促进作用逐渐升高。与WT种子中变化一致,NtPHYB1-RNAi和NtPHYB1-OE种子中NtGA2ox2的表达量随着后熟逐渐或波动下降,显示后熟过程中不同基因型烟草种子GA分解代谢水平均在降低。
与恒温后熟相比,在变温下WT种子中NtGA3ox2上升减缓,而NtGA2ox2下降减缓,显示变温后熟过程中WT种子中GA合成代谢水平提高,分解代谢水平降低,但与恒温后熟相比,变化减缓。恒温后熟NtPHYB1-RNAi种子中NtGA3ox2表达量升高,而变温后熟其表达量降低;显示NtPHYB1-RNAi种子在恒温后熟时GA合成代谢水平提高而变温后熟时GA合成代谢水平降低。在变温下NtPHYB1-OE种子中NtGA3ox2、NtGA2ox2和NtGAI下降加快,显示变温后熟过程中NtPHYB1-OE烟草种子GA合成代谢、分解代谢和信号水平均较恒温后熟显著提高。
3 讨 论
新采收的烟草种子普遍存在光休眠,在黑暗条件下,即使延长培育时间,种子亦不能萌发。LEUBNER-METZGER等[13]研究表明室温储藏6个月后,种子完成后熟,具备在黑暗条件下萌发的能力。与前人研究结果一致,本研究表明3种基因型的烟草新采收种子均呈现光休眠,室温储藏后种子完成后熟。与前人研究结果不同之处在于后熟期明显缩短为2个月,这种差异可能是由于储藏环境不同所致,宋碧清等[14]发现适温(25 ℃)下比相对低温条件下(18 ℃)下利于种子后熟。说明在一定范围内高温更利于种子后熟,而本研究却发现日均温15 ℃自然储藏较25 ℃恒温储藏更利于种子后熟,这可能是源于自然储藏过程中温度在不断变化,而变温较恒温更利于种子后熟,但自然储藏过程中其他多种因素亦影响试验结果,如若得出确切结果还值得今后进一步研究。
后熟解除种子光休眠和促进萌发的机理是较为复杂的,目前学界依然未得出确切结论。LEUBNER-METZGER等[18-19]研究表明后熟促进烟草种子光休眠解除可能是基于以下几个方面的作用:(1)拓宽了种子萌发所需求温度范围;(2)降低种子中ABA水平和其对ABA的敏感性,提升种子对GA的敏感性或者促进种子萌发时失去对GA的需求;(3)解除种子萌发对光的需求;(4)增加在光下不能萌发种子对光的敏感性;(5)促进种皮和胚乳破裂,加速种子萌发。本研究也发现新采收烟草种子萌发需要光的参与,而后熟种子萌发并不依赖于光的存在;新采收烟草种子对ABA和GA3均较为敏感,随着后熟种子对ABA的敏感性在降低,而对GA3的敏感性在升高,这与前人研究结果一致。此外,本研究还发现后熟过程中的ABA和GA3代谢基因和信号基因发生变化,从而影响种子光休眠水平和后熟期。近来。王尧等[16]研究也表明在种子储藏过程ABA代谢和信号被抑制,而GA合成和信号被激发,从而促进种子后熟。
近年来,光调控种子休眠与萌发的分子机制已经取得显著进展,光、ABA和GA调控拟南芥种子休眠与萌发存在交互作用[1-2]。PHY感知光信号从而影响下游的ABA和GA信号和代谢基因表达水平,进而调控种子休眠和萌发[11, 20]。而关于光敏色素是否参与种子光休眠和后熟调控却知之甚少。本研究发现与WT种子相比,NtPHYB1-RNAi种子光休眠水平显著加深,说明NtPHYB1可能负调控种子光休眠。然而,NtPHYB1-OE种子光休眠却未显著變浅,这与预期结果不一致,可能是因为种子休眠和萌发存在不同的调控机制,依据萌发率判断种子光休眠水平和后熟期存在一定局限性。
ARANA等[21]研究表明变温较常温更利于拟南芥种子萌发,在变温下PHYB调节ABA和GA代谢和信号基因(GA3ox1、NCED9、CYP707A2等)及细胞壁松弛基因(Expansion10)的表达,促进GA/ABA比值提高和细胞壁松弛,进而促进种子萌发。而本研究发现NtPHYB1协同变温通过改变种子ABA信号调控烟草种子光休眠和后熟。如:与恒温后熟相比,变温后熟过程中,不同基因型种子中ABA和GA3相关基因表达量上升或下降的趋势有的加速,有的减缓,呈现出不同的变化。上述结果说明NtPHYB1能够协同变温调控种子休眠、后熟与萌发,其调控机制值得今后研究。
4 结 论
新采收的烟草种子存在光休眠,在黑暗条件下萌发困难,而后熟有利于解除种子光休眠,促进种子在暗下萌发。与WT种子相比,NtPHYB1-RNAi种子光休眠水平加深,后熟期延长。与恒温相比,变温加速种子后熟。烟草的基因型与温度协同影响种子后熟,变温下WT和NTPHYB1-OE种子后熟加快,而NTPHYB1-RNAi种子变化不显著。植物激素水平和信号影响种子光休眠和后熟,新采收种子对GA和ABA较为敏感,随着后熟时间延长,外源ABA抑制和GA3促进种子萌发的作用在逐渐减弱;NtPHYB1协同变温通过改变ABA和GA代谢和信号水平调控烟草种子光休眠和后熟。
参考文献
[1] AN Y, ZHONG C. The control of seed dormancy and germination by temperature, light and nitrate[J]. The Botanical Review, 2020, 86: 39-75.
[2] 李振华,徐如宏,任明见,等. 光敏色素感知光温信号调控种子休眠与萌发研究进展[J]. 植物生理学报,2019,55(5):539-546.
LI Z H, XU R H, REN M J, et al. Advances in phytochrome regulating seed dormancy and germination by sensing light and temperature signals[J]. Plant Physiology Journal, 2019, 55(5): 539-546.
[3] FLINT L H. Light in relation to dormancy and germination in lettuce seed[J]. Science,1934, 80(2063): 38-40.
[4] BORTHWICK H A, HENDRICHS S B, PARKER M W, et al. A reversible photoreaction controlling seed germination[J]. Proceedingsof the National Academy of Sciences of the United States of America,1952, 38(8): 662-666.
[5] TOYOMASU T, KAWAIDE H, MITSUHASHI W, et al. Phytochrome regulates gibberellin biosynthesis during germination of photoblastic lettuce seeds[J]. Plant Physiology, 1998, 118(4): 1517-1523.
[6] SAWADA Y, AOKI M, NAKAMINAMI K, et al. Phytochrome- and gibberellin-mediated regulation of abscisic acid metabolism during germination of photoblastic lettuce seeds[J]. Plant Physiology, 2008, 146(3): 1386-1396.
[7] KAMIYA Y, GARCIA-MARTINEZ J L. Regulation or gibberellin biosynthesis by light[J]. Current Opinion in Plant Biology, 1999, 2(5): 398-403.
[8] YAMAGUCHI S, KAMIYA Y. Gibberellins and light-stimulated seed germination[J]. Journal of Plant Growth Regulation, 2001, 20 (4): 369-376.
[9] LEE K P, PISKUREWICZ U, TURECKOVA V, et al. Spatially and genetically distinct control of seed germination by phytochromes A and B[J]. Genes and Development, 2012, 26(17): 1984-1996.
[10] DE WIT M, GALVAO V C, FANKHAUSER C. Light-Mediated hormonal regulation of plant growth and development[J]. Annual Review of Plant Biology, 2016, 67: 513-537.
[11] JIANG Z, XU G, JING Y, et al. Phytochrome B and REVEILLE1/2-mediated signalling controls seed dormancy and germination in Arabidopsis[J]. Nature Communications, 2016, 7: 12377.
[12] MERAI Z, GRAEBER K, WILHELMSSON P, et al. Aethionema arabicum: a novel model plant to study the light control of seed germination[J]. Journal of Experimental Botany, 2019, 70(12): 3313-3328.
[13] LEUBNER-METZGER G. Seed after-ripening and over-expression of classI β-1,3-glucanase confer maternal effects on tobacco testarupture and dormancy release[J]. Planta, 2002, 215(6): 959-968.
[14] 宋碧清,鄭昀晔,马文广,等. 贮藏温度对烟草种子后熟的影响研究[J]. 种子,2017,36(4):77-79.
SONG B Q, ZHENG Y Y, MA W G, et al. Effects of storage temperature on after-ripening of tobacco seed[J]. Seed, 2017, 36(4): 77-79.
[15] ZHAO J H, HAN J, ZHANG J et al. NtPHYB1K326, a homologous gene of Arabidopsis PHYB, positively regulates the content of phenolic compounds in tobacco[J]. Plant Physiology and Biochemistry, 2016, 109: 45-53.
[16] 王尧,李振华,彭忠华. 烟草种子后熟对GA和ABA代谢与信号基因表达及萌发的影响[J]. 分子植物育种,2021,19(7):2312-2319.
WANG Y, LI Z H, PENG Z H. Effects of seed after-ripening on GA and ABA metabolism, signal gene expression and germination in tobacco[J]. Molecular Plant Breeding, 2021, 19(7): 2312-2319.
[17] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCt method[J]. Methods, 2001, 25(4): 402-408.
[18] LEUBNER-METZGER G, MEINS FJ R. Sense transformation reveals a novel role for class I β-1, 3-glucanase in tobacco seed germination[J]. Plant Journal, 2000, 23: 215-221.
[19] LEUBNER-METZGER G, MEINS FJ R. Antisense-transformation reveals novel roles for class Iβ-1,3-glucanase in tobacco seed after-ripening and photodormancy[J]. Journal of Experimental Botany, 2001, 52: 1753-1759.
[20] YANG L W, LIU S R, LIN R C. The role of light in regulating seed dormancy and germination[J]. Journal of Integrative Plant Biology, 2020, 62(9): 1310-1326.
[21] ARANA MV, TOGNACCA RS, ESTRAVIS-BARCALA M, et al. Physiological and molecular mechanisms underlying the integration of light and temperature cues in Arabidopsis thaliana seeds[J]. Plant Cell and Environment, 2017, 40: 3113-3121.
