普通烟草脂氧合酶基因家族鉴定及表达模式分析
2021-11-14李志远,宋青松,刘江,王德勋,范志勇,吴新儒,李晓旭,王奇,孙晋浩,郭存,晁江涛,李功博,刘贯山
李志远,宋青松,刘江,王德勋,范志勇,吴新儒,李晓旭,王奇,孙晋浩,郭存,晁江涛,李功博,刘贯山
摘 要:脂氧合酶(LOX)是脂肪酸代谢途径的关键酶,在植物的生长发育及多种逆境胁迫响应过程中发挥重要作用。本研究对烟草基因组中的LOX家族成员进行鉴定,并利用进化分析、共线性分析和表达分析等方法解析LOX家族成员的潜在生物学功能。结果表明,在普通烟草中共鉴定得到18个LOX基因,其中12个LOX基因被锚定在染色体上。系统进化分析表明,普通烟草中新鉴定的LOX家族成员被分为9-LOX和13-LOX两个亚家族,其中13-LOX又可被分为Type I和Type II两个亚类。共线性分析表明,烟草NtLOX07、NtLOX10基因分别与拟南芥AtLOX05、AtLOX01基因形成同源基因对,并且大部分同源基因之间具有相似的表达模式。表达模式分析发现,普通烟草LOX基因表达具有一定的组织特异性,并且NtLOX06等基因能够被机械损伤和茉莉酸甲脂(MeJA)处理显著诱导。因此,普通烟草LOX家族成员可能在植物胁迫响应过程中发挥着重要的作用。
关键词:烟草;脂氧合酶;机械损伤;茉莉酸甲脂;表达模式
Identification and Expression Analysis of the Lipoxygenase Gene Family in Tobacco (Nicotiana tabacum L.)
LI Zhiyuan1, SONG Qingsong2, LIU Jiang3, WANG Dexun4, FAN Zhiyong4, WU Xinru1, LI Xiaoxu1,5,
WANG Qi1, SUN Jinhao1, GUO Cun1, CHAO Jiangtao1, LI Gongbo1, LIU Guanshan1*
(1. Key Laboratory of Tobacco Gene Resources, Institute of Tobacco Reserch of CAAS, Qingdao 266101, China; 2. Feixian Branch, Linyi Tobacco Company of Shandong, Feixian, Shandong 273400, China; 3. China Tobacco Shandong Industrial Co., Ltd., Jinan 250014, China; 4. Dali Branch, China Tobacco Yunnan Industrial Co., Ltd., Dali, Yunnan 671000, China; 5. China Tobacco Hunan Industrial Co., Ltd., Changsha 410007, China)
Abstract: Lipoxygenase (LOX) is a key enzyme in fatty acid metabolism of plant and plays multiple roles in development and stress responses. The identification and analysis of LOX family members in tobacco can provide a theoretical basis for tobacco resistance breeding. In the current study, a total of 18 LOX family members were identified in tobacco, and 12 of those were anchored on chromosomes successfully. The phylogenetic analysis revealed that the newly identified tobacco LOX family members could be divided in 2 subgroups (9-LOX and 13-LOX). And then, LOX members in the 13-LOX subgroup could be classified in two different types (Type I and Type II). The syntenic analysis revealed that there were two homologous gene pairs between Arabidopsis and tobacco, and they shared similar expression patterns. Notably, the expression pattern analysis indicated that the NtLOX genes expression patterns were different in tested tissues, while several NtLOX genes could be induced by wounding and MeJA treatments, such as NtLOX06. Therefore, LOX family members in tobacco may play a significant role in the process of plant stress response.
Keywords: tobacco; lipoxygenase; wounding; MeJA; expression pattern
植物脂肪酸代謝途径产生的多种代谢产物在植物生长发育、抵御外界逆境胁迫和防卫反应中发挥着重要作用[1-4]。脂肪酸代谢途径中关键基因的鉴定与分析对于解析植物胁迫响应的分子机制具有重要的意义。脂氧合酶(LOX)是脂肪酸代谢途径的第一个酶也是该途径的关键酶,属于含非血红素铁的一类双加氧酶,根据其在催化反应中加氧位置的不同,脂氧合酶可分为两大类:9-LOX和13-LOX,分别在C-9(9-HPs)和C-13(13-HPs)位置引入氧原子[5-6]。另一方面,根据脂氧合酶亚细胞定位结果及序列相似性可将其分为两种类型,其中不含质体转运肽并且序列相似性大于75%的为Type I型,带有假定的质体转运肽并且序列相似性在35%以上的为Type II型。迄今为止,所发现的Type I型LOX均属于13-LOX[7]。
脂氧合酶催化形成的脂肪酸氢过氧化物(HPs)可进一步形成其他代谢产物。其中一条途径是从丙二烯氧合酶(AOS)开始的,然后通过一系列酶的修饰最终形成茉莉酸(JA)[8]。茉莉酸作为一种植物重要的信号分子,不仅参与生长和发育过程,还参与介导植物对食草动物和微生物病原体的防御反应[9]。另一条路线则是通过氢过氧化物裂解酶(HPLs)催化脂肪酸氢过氧化物(HPs)裂解形成C6-和C12-化合物,随后生成相应的绿叶挥发物(GLVs)[10]。绿叶挥发物被报道参与植物防御反应,诱导相关防御响应基因表达的同时也对病原菌、害虫具有直接或间接的抑制作用[11]。可见,脂氧合酶在植物对外界环境的防御反应中发挥着重要作用。
目前,LOX基因家族成员已在拟南芥[12]、番茄[13]、猕猴桃[14]、甜瓜[15]和杨树[16]等多种植物中得到鉴定。在拟南芥中共鉴定得到6个不同的脂氧合酶基因,其中AtLOX01参与叶片中病原体的防御反应[17];AtLOX02参与茉莉酸(JA)的生物合成[18];AtLOX03和AtLOX04在花发育和雄性育性调控中发挥重要作用[19];AtLOX05参与植物侧根发育和防御反应[20];AtLOX06在根中表达并参与茉莉酸(JA)的合成[21]。前人在渐窄叶烟草(Nicotiana attenuata)中鉴定到3个不同的脂氧合酶基因,其中NaLOX01属于9-LOX家族,在根中特异表达[22];NaLOX02和NaLOX03属于13-LOX家族,主要在地上部的组织中表达;NaLOX02主要与绿叶挥发物的合成相关而NaLOX03则参与茉莉酸的生物合成[23-24]。
烟草是一种重要经济作物,由外界环境引起的生物和非生物胁迫对烟草品质及产量有重要影响。在四倍体普通栽培烟草LOX基因家族成员的鉴定与功能研究尚未见报道。为解析脂氧合酶基因在烟草生长发育和胁迫响应中的作用,本研究根据普通栽培烟草K326的基因组数据,利用比较基因组学和生物信息学手段,对烟草基因组中的脂氧合酶基因进行鉴定与分析,为阐明烟草逆境胁迫响应的分子机制和脂氧合酶家族成员的功能解析奠定基础。
1 材料与方法
1.1 试验材料
普通烟草品种K326保存并于2020年4月在烟草行业基因资源利用重点实验室内种植。实时荧光定量PCR仪采用美国Applied Biosystems公司的ABI 7500型号。激光共聚焦显微镜是来自德国Leica公司的TCS-SP8型号。RNA提取及反转录和荧光定量试剂盒购自艾克瑞(湖南)有限公司。
1.2 试验方法
1.2.1 烟草LOX基因家族成员的鉴定与分析 在NCBI数据库下载拟南芥(Arabidopsis thaliana)和番茄(Lycopersicon esculentum L.)、水稻(Oryza sativa L.)、大豆(Glycine max)、大麥(Hordeum vulgare L.)和渐窄叶烟草(Nicotiana attenuata)的LOX家族成员的蛋白质序列。利用茄科基因组数据库(http://solgenomics.net/)下载烟草全基因组蛋白质序列。以拟南芥和番茄的LOX蛋白质序列为种子序列,进行本地BLASTP检索(E-value<0.01),获得候选序列。利用Pfam数据库(http://pfam.sanger.ac.uk/)和SMART数据库(http://smart.embl-heidelberg.de/)对候选序列进行筛选[25-26],去除不含有Lipoxygenase结构域的序列,其余普通烟草LOX成员根据其染色体定位信息进行命名。使用ExPASy ProtParam(https://web.expasy.org/protparam/)工具,在线分析NtLOX家族成员的分子量和理论等电点[27]。
1.2.2 系统进化分析 使用MAFFT软件对拟南芥、番茄、水稻、大豆、大麦及野生烟草LOX家族成员和新鉴定的普通烟草LOX家族成员的蛋白质序列进行多序列比对[28]。基于多序列比对的结果,使用MEGA X软件采用邻接法(NJ)构建系统进化树,Bootstrap检验值设置为1000次[29]。
1.2.3 基因结构及保守基序分析 使用MEME工具(http://meme.sdsc.edu/meme)检测烟草LOX家族成员的保守基序,参数设为:待检测保守基序数为15,基序长度最小为6个氨基酸,最长为50个
氨基酸[30]。从茄科基因组数据库(http://solgenomics. net/)下载烟草LOX家族成员的CDS和基因组序列,并将其上传至GSDS网站(http://gsds.cbi.pku. edu.cn/)用于生成烟草LOX家族成员的内含子/外显子结构图[31]。
1.2.4 启动子分析 截取烟草LOX基因上游2000 bp序列作为启动子区,在烟草全基因组数据库中下载启动子序列。将获得的启动子序列提交至PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)网站鉴定烟草LOX基因启动子区域上存在的顺式元件[32]。
1.2.5 共线性分析 利用TBtools软件对拟南芥和普通烟草K326全基因组序列进行比对。根据比对结果,利用McScan X软件分析拟南芥和普通烟草基因组之间的共线性区块,建立拟南芥和烟草之间的同源基因对,随后使用TBtools软件进行可视化展示[33-34]。
1.2.6 转录组数据处理及结果分析 普通烟草K326不同组织的转录组数据下载自NCBI的GEO数据库(登录号:GSE95717)[35]。在转录组数据中提取烟草LOX基因在根、茎和茎尖的表达数据并进行标准化,利用TBtools软件中的HeatMap程序进行可视化分析。
1.2.7 K326胁迫处理 普通烟草品种K326于2020年4月在中国农业科学院烟草研究所的培养室内培养(光周期16/8 h,25 ℃)。选取出苗后8周的烟草植株进行非生物胁迫处理[36]。使用95%乙醇按1:10稀释MeJA,然后用含有0.1% Triton X-100
的蒸馏水进一步稀释至终浓度为100 μmol/L。对烟草幼苗进行喷施处理。选取烟草幼苗第3片叶(由基部至顶部)为处理叶,使用消毒的手术刀片沿叶脉对称划4道伤口进行机械损伤处理。分别在MeJA和机械损伤处理后0、1、3、6 h采集组织样品,并转移至液氮或?80 ℃冰箱中保存备用。
1.2.8 烟草总RNA提取和反转录 将采集的胁迫处理的样品在液氮中研磨成粉末,使用Trizol试剂提取各样品的总RNA,使用2%琼脂糖凝胶电泳和紫外分光光度计检测RNA质量和纯度。随后利用PrimeScript RT reagent Kit进行cDNA第一链的合成,将反转录后的cDNA置于?20 ℃保存。
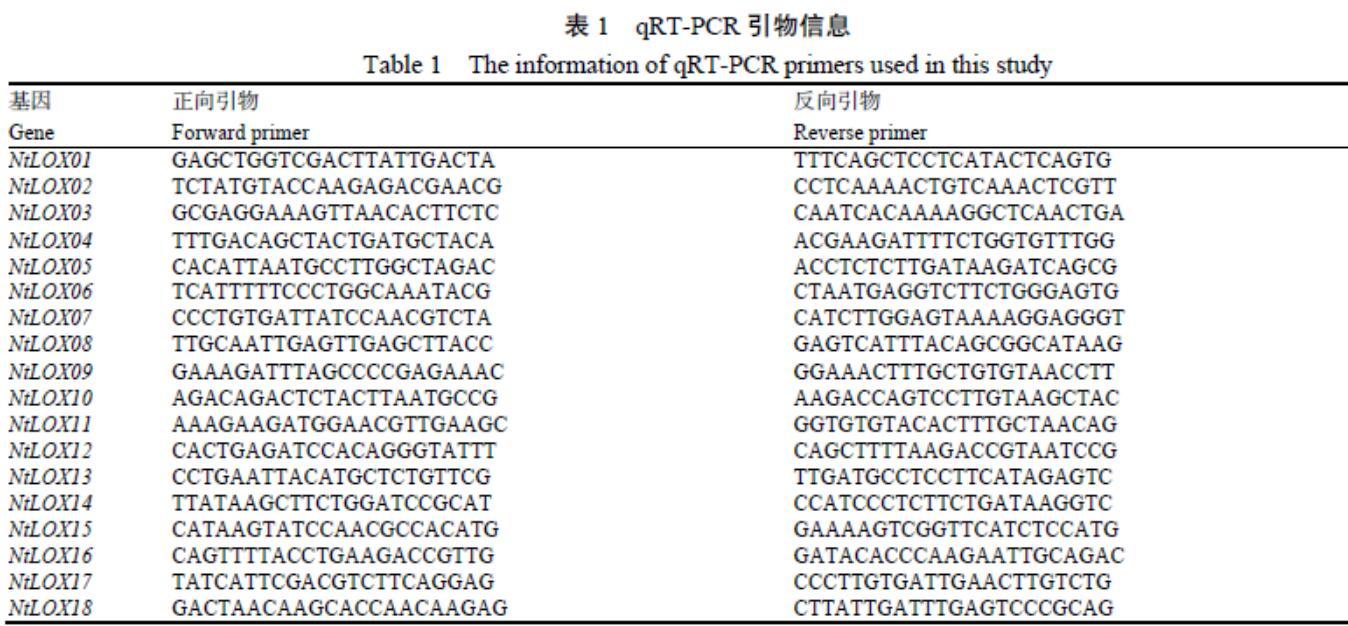
1.2.9 表达模式分析 根据NtLOX基因的CDS序列,使用Primer 3 Plus在线程序设计qRT-PCR引物,随后通过NCBI中的Primer-blast工具进行引物特异性检测(表1)。使用ABI 7500荧光定量PCR仪(Applied Biosystems)进行qRT-PCR检测。以烟草核糖体蛋白基因L25(GenBank No. L18908)为内参,并进行了3个生物学重复,试验结果分析采用2-ΔΔCt方法[37]。
2 结 果
2.1 烟草LOX基因鉴定及理化性质分析
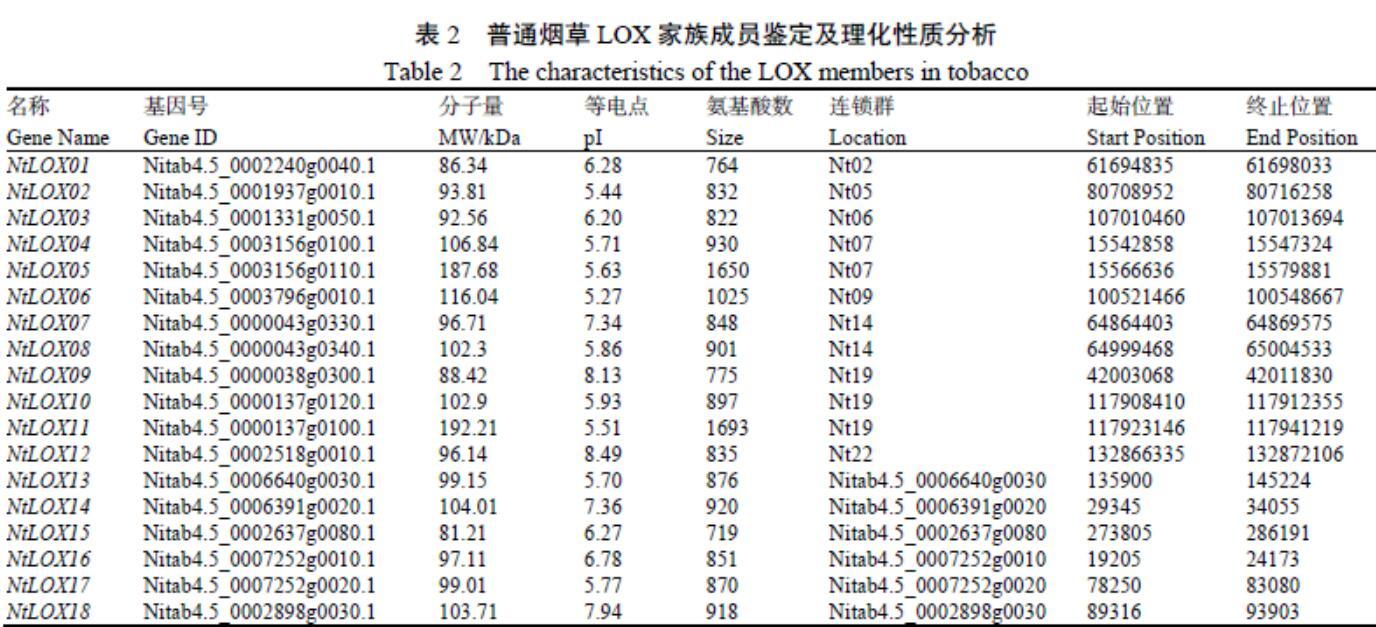
以拟南芥、番茄和马铃薯中已公布的LOX家族成员的蛋白序列为种子序列,进行本地BLASTP检索,獲得候选烟草LOX家族成员。随后利用SMART和Pfam数据库对候选LOX家族成员的结构域进行分析,去除不含有LOX结构域的序列,最终鉴定到18个烟草LOX家族成员。
根据英文缩写将烟草LOX简写为NtLOX,并依据烟草LOX基因的染色体定位信息对其进行命名(NtLOX1-NtLOX18)。新鉴定的18个烟草LOX基因中有12个被锚定在8条不同染色体上,分别分布在2、5、6、7、9、12、19、22染色体上。通过ProtParam工具分析烟草LOX家族成员的理化性质,结果表明,新鉴定的烟草LOX家族成员的长度在719~1693个氨基酸之间,蛋白分子量则介于81.21~192.21 kDa之间。同时,新鉴定的烟草LOX家族成员蛋白理论等电点在5.27~8.49之间(表2)。
2.2 系统进化分析
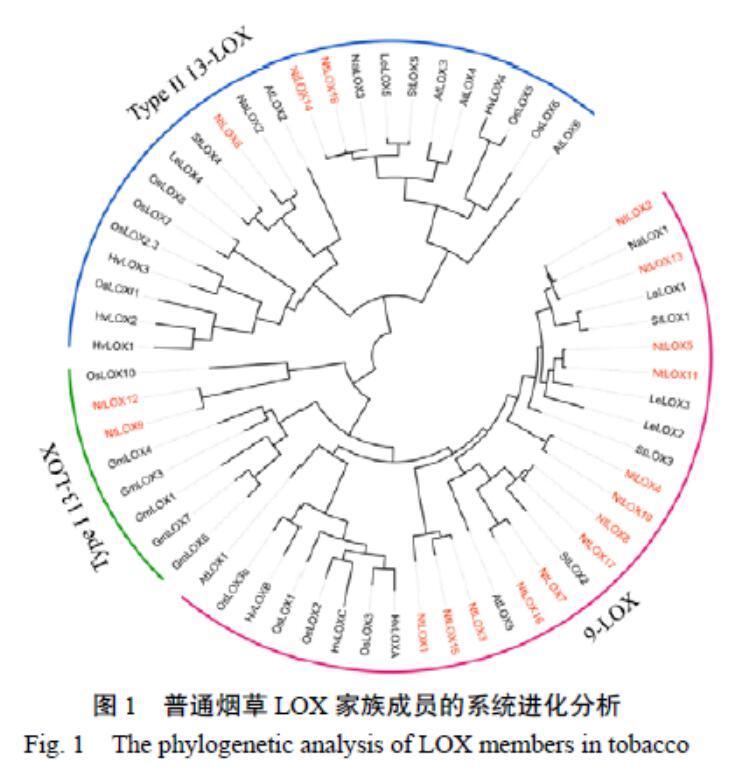
为明确烟草LOX基因家族的进化关系,对烟草LOX家族成员和已报道的其他物种LOX家族成员的蛋白质序列进行多序列比对,并利用MEGA X软件进行系统进化分析(图1)。系统发育分析表明,烟草LOX家族成员被划分为9-LOX和13-LOX两个亚家族,根据序列相似性及是否含有质体信号肽将13-LOX分为Type I和Type II两种类型。Type I型13-LOX亚类包含两个成员(NtLOX09和NtLOX12),而Type II型13-LOX亚类包含3个成员(NtLOX06、NtLOX14和NtLOX18),剩余LOX家族成员则隶属于9-LOX亚家族。单子叶植物和双子叶植物中的9-LOX家族成员被分为两个不同的类群。
2.3 烟草NtLOX基因结构及保守基序分析
利用GSDS工具对烟草LOX基因的内含子/外显子的组成进行了鉴定(图2B)。结果显示,在9-LOX亚家族中,除了NtLOX05和NtLOX11含有18个外显子,剩余大部分9-LOX亚类成员含有的外显子数为9至12个。Type I型13-LOX亚类中NtLOX09和NtLOX12均含有9个外显子。Type II型13-LOX亚类中NtLOX06基因长度超过25 kb,共含有17个外显子,而NtLOX14和NtLOX18仅含有8个外显子。
为探究18个NtLOX家族成员的潜在功能,利用MEME保守基序进行分析工具对LOX家族成员的蛋白序列进行分析(图2C)。结果表明,Motif 1(LOX结构域)在烟草NtLOX家族成员中高度保守,包括一段由38个氨基酸组成的富含组氨酸结构(His-X4-His-X4-His-X17-His-X8-His),该结构在维持脂氧合酶结构稳定性上发挥着重要的作用。所有的NtLOX家族成员均含有典型的LOX结构域,其中NtLOX05和NtLOX11含有2个LOX结构域。
2.4 普通烟草LOX家族成员的共线性分析
为对烟草NtLOX基因的潜在生物学功能进行分析,本研究通过共线性分析建立拟南芥与烟草之间的同源基因对(图3)。分析结果表明,普通烟草NtLOX07与拟南芥AtLOX05为同源基因对,普通烟草NtLOX10与拟南芥AtLOX01为同源基因对。
2.5 普通烟草LOX家族成员的启动子分析
为了研究烟草NtLOX基因的表达调控规律,利用PlantCARE在线工具对18个NtLOX基因启动子区的顺式作用元件进行了分析(图4)。结果表明,在7个NtLOX基因(NtLOX01、NtLOX04、NtLOX10、NtLOX12、NtLOX13、NtLOX14和NtLOX15)的启动子区域检测到发育相关顺式作用元件,例如分生组织发育相关元件(CAT-box)。同时,在一些NtLOX基因的启动子区还存在激素响应元件,包括ABRE、ERE和CGTCA-motif,它们分别介导植物对脱落酸(ABA)、乙烯(ETH)和茉莉酸甲酯(MeJA)的响应。此外,在大多数NtLOX基因的启动子区域中存在大量与逆境响应相关的顺式作用元件,包括W-box、MYC、MYB、LTR、WUN-motif和ARE等。
2.6 普通烟草LOX基因不同组织表达模式分析
利用普通烟草转录组数据[35]对NtLOX基因在不同组织的表达模式进行分析,结果(图5)表明,烟草LOX家族编码基因具有显著的组织表达特异性。进一步的分析发现,NtLOX03、NtLOX05和NtLOX11等基因在测试组织中均有表达,但在茎尖中的表达量最高。同时,NtLOX02、NtLOX07、NtLOX10、NtLOX13和NtLOX16等基因特异性地在烟草根中表达。此外,NtLOX06基因在烟草茎尖和茎中高表达,而在根中没有检测到表达。
2.7 普通烟草LOX基因胁迫处理下表达模式分析
为进一步解析烟草LOX家族成员的潜在功能,对18个烟草LOX家族成员在MeJA和机械损伤处理下的表达模式进行了分析。在MeJA处理下(图6),NtLOX01、NtLOX02、NtLOX11和NtLOX15的表达量逐步升高并且在6 h达到最高,而NtLOX05、NtLOX09、NtLOX10和NtLOX16则呈现出逐渐下降的表达趋势。此外,NtLOX04、NtLOX06、NtLOX07、NtLOX08、NtLOX13、NtLOX04和NtLOX17的表达量均呈现先升高后下降的趋势。
在机械损伤处理下(图7),NtLOX07、NtLOX11和NtLOX15的表达量逐渐升高并在处理后6 h达到峰值,而NtLOX01、NtLOX02、NtLOX03、NtLOX08、NtLOX13和NtLOX17的表达量均呈现出先升后降的趋势。
在13-LOX的Type I型亚类中,NtLOX09经MeJA处理后下调表达且在3 h的表达量最低,而机械损伤处理则诱导其上调表达;NtLOX12在两种处理后均下调表达。Type II型13-LOX中,NtLOX06、NtLOX14和NtLOX18经MeJA和机械损伤处理后均上调表达。其中NtLOX06在3 h的表达量最高,而NtLOX14表达量则在1 h最高随后逐渐下降。
3 讨 论
在植物中,脂氧合酶是脂肪酸代谢途径的关键酶,并且在调控植株生长发育和胁迫响应中有着至关重要的作用。本研究在普通栽培烟草中鉴定到18个脂氧合酶基因,所有普通烟草LOX蛋白均含38个氨基酸残基组成的高度保守的Lipoxygenase结构域。系统发育分析结果表明,普通烟草LOX蛋白可被划分为9-LOX和13-LOX两个亚家族。单子叶植物和双子叶植物中的9-LOX基因被分为两个不同的簇,表明这一分支可能是在单/双子叶植物分化事件之后出现的。基因结构及保守结构域分析表明,来自同一亚族的NtLOX成员具有相似的基因结构
和保守结构域组成,上述结果证明了系统进化分析的准确性。启动子分析表明,在烟草LOX基因的启动子区域含有大量的ABRE、G-box、W-box和MYB等胁迫响应元件,说明烟草LOX家族成员在烟草的多种逆境响应中发挥重要作用。
在拟南芥中,AtLOX05在根中高表达并且被证实影响侧根的发育[20]。为探究烟草LOX家族成员在生长发育中的潜在功能,利用已公布普通烟草K326的RNA-seq数据对NtLOX基因在根、茎和茎尖的表达模式进行分析。结果表明,AtLOX05的同源基因NtLOX07同样也在根中高表达,这表明NtLOX07基因可能参与烟草根系的生长发育过程。此外,AtLOX05参与拟南芥的免疫反应。在机械损伤和MeJA处理下,其直系同源基因NtLOX07均上调表达,表明NtLOX07基因同样也具有免疫应答功能。特别地,拟南芥中AtLOX01参与叶片中防御反应[17],但其直系同源基因NtLOX10在机械损伤和MeJA处理后均下调表达,暗示烟草中NtLOX10基因与拟南芥中AtLOX01基因可能出现了功能分化。
植物在自然环境中遭受病原菌或害虫刺激后,会释放防御信号分子绿叶挥发物。绿叶挥发物的释放在MeJA介导的植物防御反应中发挥重要作用。前人在野生烟草中鉴定到控制绿叶挥发物合成的關键基因NaLOX02,该基因可受昆虫取食或MeJA诱导[23]。系统进化分析表明,普通烟草中NtLOX06与野生烟草中NaLOX02聚在一起,并且该基因的表达受机械损伤和MeJA的诱导。上述结果表明,NtLOX06基因可能在普通烟草绿叶挥发物的合成过程中发挥重要作用。
4 结 论
本研究在普通栽培烟草中鉴定到18个脂氧合酶基因,所有普通烟草LOX蛋白均含38个氨基酸残基组成的高度保守的Lipoxygenase结构域。同时,新鉴定的烟草NtLOX家族成员被分为9-LOX和13-LOX两个亚家族,而13-LOX又可分为Type I和Type II两类。共线性分析表明,烟草和拟南芥之间存在2个同源基因对,并且大部分同源基因之间存在相似的表达模式。表达模式分析表明,部分NtLOX家族成员存在组织表达特异性。普通烟草中多数LOX家族成员对机械损伤和MeJA处理均有响应,证明烟草LOX家族成员可能在植物防御反应中具有重要作用。
参考文献
[1] BAILLY C, BOGATEK-LESZCZYNSKA R, C?ME D, et al. Changes in activities of antioxidant enzymes and lipoxygenase during growth of sunflower seedlings from seeds of different vigour [J]. Seed Science Research, 2002, 12(1): 47.
[2] LELI?VRE J M, LATCH? A, JONES B, et al. Ethylene and fruit ripening[J]. Physiologia Plantarum, 1997, 101(4): 727-739.
[3] KESSLER A, HALITSCHKE R, BALDWIN I T. Silencing the jasmonate cascade: induced plant defenses and insect populations[J]. Science, 2004, 305(5684): 665-668.
[4] YAN L, ZHAI Q, WEI J, et al. Role of tomato lipoxygenase D in wound-induced jasmonate biosynthesis and plant immunity to insect herbivores[J]. PLoS Genet, 2013, 9(12): e1003964.
[5] FEUSSNER I, WASTERNACK C. The lipoxygenase pathway[J]. Annual Review of Plant Biology, 2002, 53(1): 275-297.
[6] SARDE S J, KUMAR A, REMME R N, et al. Genome-wide identification, classification and expression of lipoxygenase gene family in pepper[J]. Plant Molecular Biology, 2018, 98(4): 375-387.
[7] BRASH A R. Lipoxygenases: occurrence, functions, catalysis, and acquisition of substrate[J]. Journal of Biological Chemistry, 1999, 274: 23679-23682.
[8] SCHALLER F, SCHALLER A, STINTZI A. Biosynthesis and metabolism of jasmonates[J]. Journal of Plant Growth Regulation, 2004, 23(3): 179-199.
[9] BROWSE J. Jasmonate passes muster: a receptor and targets for the defense hormone[J]. Annual Review of Plant Biology, 2009, 60: 183-205.
[10] BATE N J, ROTHSTEIN S J. C6-volatiles derived from the lipoxygenase pathway induce a subset of defense-related genes[J]. The Plant Journal, 1998, 16(5): 561-569.
[11] PROST I, DHONDT S, ROTHE G, et al. Evaluation of the antimicrobial activities of plant oxylipins supports their involvement in defense against pathogens[J]. Plant Physiology, 2005, 139(4): 1902-1913.
[12] UMATE P. Genome-wide analysis of lipoxygenase gene family in Arabidopsis and rice[J]. Plant signaling and Behavior, 2011, 6(3): 335-338.
[13] FERRIE B J, BEAUDOIN N, BURKHART W, et al. The cloning of two tomato lipoxygenase genes and their differential expression during fruit ripening[J]. Plant Physiology, 1994, 106(1): 109-118.
[14] 張波. 猕猴桃脂氧合酶基因家族的功能解析及其调控[D]. 杭州:浙江大学,2007.
ZHANG B. Function and regulation of lipoxygenase gene family members in Kiwifruit[D]. Hangzhou: Zhejiang University, 2007.
[15] 张冲. 甜瓜脂氧合酶基因家族成员鉴定、表达调控及CmLOX8在果实香气合成中的作用[D]. 沈阳:沈阳农业大学,2016.
ZHANG C. Identification, expression and regulation of lipoxygenase gene family in melon (Cucumis melo var. makuwa Makino) and the role of CmLOX18 in synthesis of fruit aroma volatiles[D]. Shenyang : Shenyang Agricultural University, 2016.
[16] CHEN Z, CHEN X, YAN H, et al. The lipoxygenase gene family in poplar: identification, classification, and expression in response to MeJA treatment[J]. PLoS One, 2015, 10(4): e0125526.
[17] MELAN M A, DONG X, ENDARA M E, et al. An Arabidopsis thaliana lipoxygenase gene can be induced by pathogens, abscisic acid, and methyl jasmonate[J]. Plant Physiology, 1993, 101(2): 441-450.
[18] BELL E, CREELMAN R A, MULLET J E. A chloroplast lipoxygenase is required for wound-induced jasmonic acid accumulation in Arabidopsis[J]. Proceedings of the National Academy of Sciences, 1995, 92(19): 8675-8679.
[19] CALDELARI D, WANG G, FARMER E E, et al. Arabidopsis lox3 lox4 double mutants are male sterile and defective in global proliferative arrest[J]. Plant Molecular Biology, 2011, 75(1): 25-33.
[20] VELLOSILLO T, MART?NEZ M, L?PEZ M A, et al. Oxylipins produced by the 9-lipoxygenase pathway in Arabidopsis regulate lateral root development and defense responses through a specific signaling cascade[J]. The Plant Cell, 2007, 19(3): 831-846.
[21] GREBNER W, STINGL N E, OENEL A, et al. Lipoxygenase 6-dependent oxylipin synthesis in roots is required for abiotic and biotic stress resistance of Arabidopsis[J]. Plant Physiology, 2013, 161(4): 2159-2170.
[22] ALLMANN S, HALITSCHKE R, SCHUURINK R C, et al. Oxylipin channelling in Nicotiana attenuata: lipoxygenase 2 supplies substrates for green leaf volatile production[J]. Plant, Cell & Environment, 2010, 33(12): 2028-2040.
[23] VANDOORN A, KALLENBACH M, BORQUEZ A A, et al. Rapid modification of the insect elicitor N-linolenoyl-glutamate via a lipoxygenase-mediated mechanism on Nicotiana attenuata leaves[J]. BMC Plant Biology, 2010, 10(1): 1-11.
[24] HALITSCHKE R, BALDWIN I T. Antisense LOX expression increases herbivore performance by decreasing defense responses and inhibiting growth-related transcriptional reorganization in Nicotiana attenuate[J]. The Plant Journal, 2003, 36(6): 794-807.
[25] FINN R D, COGGILL P, EBERHARDT R Y, et al. The Pfam protein families database: towards a more sustainable future[J]. Nucleic Acids Research, 2016, 44(D1): D279-D285.
[26] LETUNIC I, DOERKS T, BORK P. SMART: recent updates, new developments and status in 2015[J]. Nucleic Acids Research, 2016, 43: D257-60.
[27] GARG V K, AVASHTHI H, TIWARI A, et al. MFPPI-multi FASTA protparam interface[J]. Bioinformation, 2016, 12(2): 74-77.
[28] KATOH K, KUMA K, TOH H, MIYATA T. MAFFT version 5: improvement in accuracy of multiple sequence alignment[J]. NucleicAcids Research, 2005, 33(2): 511-518.
[29] 孫晋浩,牛文利,陈志华,等. 烟草NtbHLH112基因的克隆、鉴定及表达模式分析[J]. 中国烟草科学,2020,41(5):8-14.
SUN J H, NIU W L, CHEN Z H, et al. Cloning, characterization and expression pattern analysis of NtbHLH112 gene in Nicotiana tabacum[J]. Chinese tobacco science, 2020, 41(5): 8-14.
[30] BAILEY T L, BODEN M, BUSKE F A, et al. MEME SUITE: tools for motif discovery and searching[J]. Nucleic. Acids. Research, 2009, 37: W202-W208.
[31] HU B, JIN J, GUO A Y, ZHANG H, et al. GSDS 2.0: an upgraded gene features visualization server[J]. Bioinformatics, 2015, 31(8): 1296-1297.
[32] LESCOT M, D?HAIS P, THIJS G, et al. PlantCARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research, 2002, 30(1): 325-327.
[33] WANG Y, TANG H, DEBARRY J D, et al. MCScanX: a toolkit for detection and evolutionary analysis of gene synteny and collinearity [J]. Nucleic Acids Research, 2012, 40(7): e49.
[34] CHEN C, CHEN H, ZHANG Y, et al. TBtools: an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant, 2020, 13(8): 1194-1202.
[35] EDWARDS K D, FERNANDEZ-POZO N, DRAKE-STOWE K, et al. A reference genome for Nicotiana tabacum enables map-based cloning of homeologous loci implicated in nitrogen utilization efficiency[J]. BMC Genomics, 2017, 18(1): 1-14.
[36] 陳竹. 杨树脂氧合酶(LOX)家族的全基因组分析及PtLOX11基因的功能研究[D]. 合肥:安徽农业大学, 2017.
CHEN Z. Genome-wide identification of lipoxygenase gene family in poplar and function analysis of PtLOX11 [D]. Hefei: Anhui Agricultural University, 2017.
[37] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C (T)) method[J]. Methods, 2001, 25(4): 402-408.
