烟草细胞质雄性不育系SK01的胞质效应及特异性分子标记
2021-11-14刘艳芳,刘志文,孙玉合,杨爱国,李凤霞
刘艳芳,刘志文,孙玉合,杨爱国,李凤霞

摘 要:為了鉴定项目组发现的K326雄性不育自然突变株SK01与生产应用的不育胞质sua-CMS的异同,分析其在烟草育种和生产中的应用潜力,本研究以tab1-CMS不育系SK01和其同核异质系K326为母本,分别与4个烤烟品种杂交构建2组F1代杂交种,在两个地点和人工气候室中比较8个F1代以及SK01和K326之间的主要农艺性状和抗病性差异,开展了tab1-CMS特异的DNA标记筛选。结果表明,SK01细胞质增强烟草杂交种F1代对CMV、黑胫病的抗性,对株高、茎围等农艺性状以及PVY、TMV抗性无显著的细胞质效应;叶绿体基因组trnC-trnD基因区间,扩增到可有效区分烟草不育胞质类型的1个588 bp的特异性片段。本研究发现的不育胞质tab1-CMS与生产应用的sua-CMS类型不育系有明显差异,对农艺性状和抗病性无明显的不利影响,是一种有一定应用潜力的不育细胞质新突变类型。
关键词:烟草;细胞质雄性不育;农艺性状;抗病性;特征标记
Cytoplasmic Effects and Specific Molecular Markers of Tobacco Cytoplasmic Male Sterile Line SK01
LIU Yanfang1,2, LIU Zhiwen3, SUN Yuhe1, YANG Aiguo1, LI Fengxia1*
(1. Tobacco Research Institute of Chinese Academy of Agricultural Sciences, Qingdao 266101, China; 2. Chinese Academy of Agricultural Sciences, Beijing 100081, China; 3. East China Normal University, Shanghai 201100, China)
Abstract: Cytoplasmic male sterile line (CMS line) is an effective genetic tool for tobacco hybrid breeding. At present, there is a single type of CMS used in tobacco hybrid breeding in China. In order to identify the similarities and differences between the male sterile natural mutant SK01 and the sterile cytoplasm used in production, and to analyze its application potential in tobacco breeding and production, tab1-CMS sterile line SK01 and its homokaryon heterogeneous line K326 were used as the female parents in crossing with four flue-cured tobacco varieties to construct two sets of F1 hybrids. Eight F1 lines, SK01 and K326 were compared in two locations in the field or in artificial climate rooms. The main agronomic traits and disease resistance differences between tab1-CMS-specific DNA marker screening were carried out. The results showed that the SK01 cytoplasm enhanced the resistance of tobacco hybrid F1 to CMV and black shank, and had no significant cytoplasmic effect on resistance to PVY and TMV, plant height, stem circumference or other agronomic traits. A 588 bp specific fragment was amplified from the trnC-trnD gene interval of the chloroplast genome, to that can effectively distinguish the sterile cytoplasm of tobacco. It shows that the sterile cytoplasmic tab1-CMS identified in this study is significantly different from the sua-CMS type sterile line used in production and has no obvious adverse effects on agronomic traits and disease resistance. It is a new type of cytoplasmicsterility with certain application potential.
Keywords: tobacco; cytoplasmic male sterility; agronomic traits; disease resistance; characteristic markers
细胞质雄性不育(cytoplasmic male sterility, CMS)是植物因雄蕊退化、花粉败育或功能不育等原因造成的雄蕊不能正常授粉而雌蕊功能正常的一种母性遗传性状。杂种优势是作物提高单产、改进品质、增强抗逆的重要途经[1]。利用雄性不育系生产杂交种可降低种子生产成本并保证种子的纯度,水稻、十字花科蔬菜等多种植物的杂交种在生产中具有重要地位。烟草(Nicotiana tabacum)杂种优势明显,杂种F1代在生长势、生长量、抗逆性以及品质等方面都比双亲平均值有明显提高[2]。杂交种逐渐成为烟草品种培育的趋势。目前烟草不育系和杂交种的种植面积占我国烤烟总面积的70%,但只有胞质来源于N. suavelens的sua-CMS类型不育系被广泛使用。作物长期使用单一不育胞质遗传基础脆弱,易受病害虫侵害,在生产上具有很大风险性。上世纪70年代美国玉米杂交种的不育胞质几乎全部为T-CMS,由于T-CMS易感小斑病菌(Elminthosporium Maydis Shoemaker),造成了全美范围内玉米的严重减产,T胞质被停用[3]。因此,急需开展烟草不育胞质创制、鉴定和评价等研究,打破烟草杂交育种中长期、大面积使用单一不育胞质的局面。
由于核质互作的影响,不育细胞质对作物多种性状有显著的细胞质遗传效应[4]。水稻h2s细胞质对结实率、穗重、产量等性状具有显著的正效应[5-6],棉花不育细胞质对产量性状具有明显负效应[7]。在抗病性方面,据水稻、小麦、油菜等作物的相关报道,不同细胞质对抗病性一般表现为负效应,但多个外源胞质在小麦抗病性上表现为正效应[8]。烟草不育细胞质对后代的影响研究表明,与对照相比,不育胞质来源于N. bigelovii、N. megalosiphon、N. plumbaginifolia的不育系有效叶数减少;不育胞质来源于N. undulata的不育系开花期推迟[2],sua-CMS细胞质对烟草的农艺性状和品质性状没有显著的负效应[9]。
鉴定胞质雄性不育系类型的方法有形态学、细胞学和分子标记,其中分子标记是鉴定胞质雄性不育类型的主要方法[10-13],包括线粒体特异基因[14-16]、线粒体/叶绿体简单序列重复(simple sequence repeat, SSR)[17-19]、单核苷酸多态性(single nucleotide polymorphisms,SNP)[20-22]等。叶绿体是与CMS有关的一个细胞器,在叶绿体基因组的基因间区和内含子区有大量的SNP、InDel、易位、重复、点突变以及基因组结构变异,具有比核基因组更高的核苷酸替代率[23],可用于区分细胞质雄性不育系[24-25]。叶绿体trnC-trnD约为3000 bp,包括trnC、petN、psbM、trnD 4个基因。该区域在多个物种中具有丰富的多态性,研究人员利用trnC-trnD序列构建了人参[26]、山矾属[27]等物种的系统发育树[28]。
SK01(tab1-CMS)是2010年7月在K326的试验田中发现的一株雄性不育自然突变体,表现为完全败育。2011—2016年间在青岛和西昌两地连续8代对SK01进行K326回交,回交后代均表现雄性不育,且为细胞质雄性不育。
本研究以SK01(tab1-CMS)及其同核异质系K326为母本、4个烤烟品种为父本配制8个杂交组
合,由此产生5组成对的細胞核基因组相同而细胞质不同的杂交种,以此评价SK01不育细胞质在烟草主要农艺性状和抗病性等方面的胞质效应;通过比较tab1-CMS不育系、sua-CMS不育系及其可育对照的叶绿体trnC-trnD多态性,鉴定tab1-CMS的特定分子标记。这将为丰富烟草不育胞质源及烟草优异不育胞质在育种和生产上使用奠定基础。
1 材料与方法
1.1 试验材料
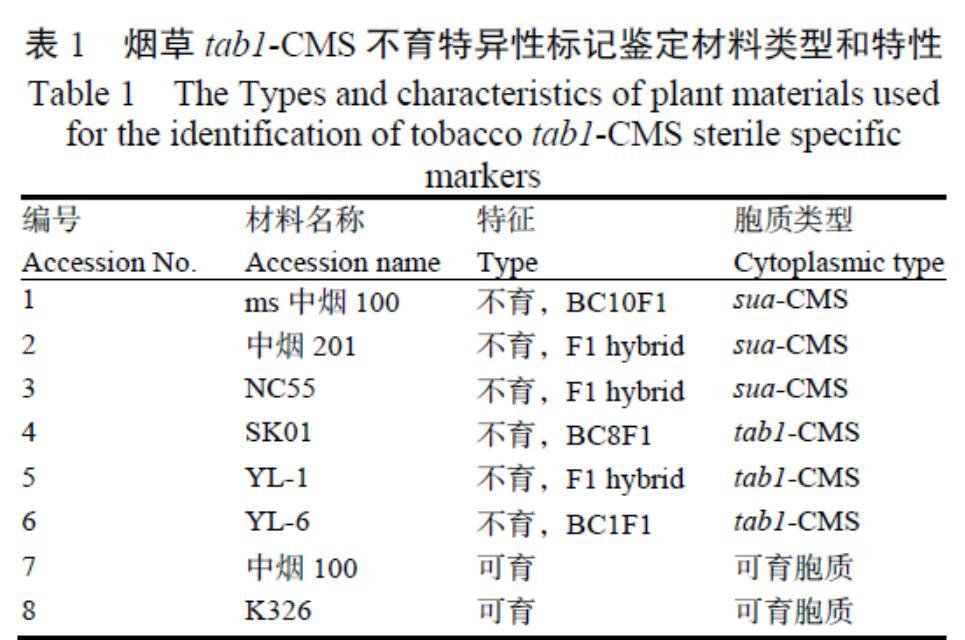
1.1.1 植物材料 SK01(K326的同核异质系,tab1-CMS),可育对照K326,以及以SK01(S)和K326(F)为母本,以中烟100(M1),NC82(M2),红花大金元(M3)和Speight G-28(M4)为父本分别杂交的F1代。tab1-CMS组包括S以及S与M1-M4的4种杂交组合;对照组包括F以及F与M1-M4的杂交组合。
1.1.2 供试毒株及菌种 烟草花叶病毒(TMV)、黄瓜花叶病毒(CMV)、马铃薯Y病毒(PVY)、黑胫病菌种,均由中国农业科学院烟草研究所育种研究中心保存。
1.2 试验方法
1.2.1 农艺性状调查 在山东省诸城市(北纬35°95',东经119°19',海拔65 m)和四川省西昌市(北纬27°84′,东经102°37′,海拔2100 m)两个不同的烟草生态区分别种植SK01,K326和8个F1代杂交组合,采用完全随机区组设计,设置2次重复,每个重复50株,在50%植株中心开放时,每个重复选取长势相对均一的10个单株,按照烟草行业标准YC/T 142—2010测定株高、有效叶数、节距、茎围、最大叶叶长和最大叶叶宽[29]。
1.2.2 抗病性调查 抗性鉴定在中国农业科学院烟草研究所人工气候室进行,温度为25 ℃,湿度为60%,每个材料设2次重复,每个重复25株。
TMV、CMV、PVY的抗性鉴定:将新鲜繁毒叶片研磨、过滤,滤液经纯净水5倍比例稀释,待烟苗长至5~6片真叶时进行人工摩擦接种。接种30~35 d后,参照我国烟草病虫害分级及调查方法B/T23222—2008进行抗病性调查。病情等级划分为0、1、3、5、7、9六个等级。
黑胫病抗性鉴定:采用茎基部菌谷接种的方法,待烟苗长到4~5叶期时,在每株烟苗的茎基部用小刀轻轻划一条大小相同的伤口,然后在根部接种3~5 g菌谷,立即覆土并灌水保湿。接种3周后调查每株发病情况,病害分级按国家行业标准YC/T39—1996规定执行,病情等级划分为0、1、3、5、7、9六个等级。
1.2.3 数据处理 (1)农艺性状数据处理:使用SAS PROC GLM(版本9.3;SAS Institute Inc.)中的III型平方和固定模型和ANOVA进行数据分析。如果细胞质、细胞核、环境之间相互作用显著,则采用固定效应的最小二乘法(LS-均值)分析环境和细胞核的细胞质效应。细胞质效应、细胞质与核及环境相互作用的多重比较采用Duncan多极差检验。tab1-CMS细胞质对农艺性状的影响估计计算如下:[S/M(M1-M4)]F1-[异核同质系F/M(M1-M4)]F1[30]。
(2)抗病性数据处理:使用SAS 9.3软件的协因素方差分析,对SK01,K326和8个F1代杂交组合进行病情指数分析(LSD分析p<0.05为有显著差异)。
1.2.4 特征标记扩增 选用sua-CMS,tab1-CMS两种不育类型的不育系以及可育烟草共8个材料(表1),用试剂盒提取叶片总DNA(TIANGEN Biotech,中国)。根据烟草叶绿体基因组序列(GenBank No:Z00044),设计两对特异性引物(S1:5'-GAGTGGTAAGGCAGAGGAC-3'和5'-AAATCA ATGAAGGAAAAGC-3';S2:5'-TATCGCTTTTCC TTCATTG-3'和5'-ATTTTC TGCTAGATCCCGT-3')扩增叶绿体trnC-trnD基因间区域。PCR程序如下:94 ℃预变性5 min,PCR扩增30个循环,每循环94 ℃变性30 s,51 ℃退火30 s,72 ℃延伸45 s,最后72 ℃延伸7 min。用1%琼脂糖凝胶电泳检测扩增到的PCR产物。
使用PCR纯化试剂盒(TIANGEN Biotech,中国)回收DNA片段,并将其连接到pMD18-T载体(TAKARA,日本)中。每个片段挑选5个阳性克隆进行测序,测序结果一致。根据sua-CMS、tab1-CMS和可育烟草中1738位点和2321位点的序列特征,用Primer 5设计特异引物S3:5'-AGGGGGCAGCAACTACAAT-3'和5'-CGGAAA AAATGATAAATAAAT-3'以扩增tab1-CMS的特异性标记。PCR扩增程序为94 ℃预变性5 min,PCR扩增30个循环,每循环94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,最后72 ℃延伸7 min。用1.5%琼脂糖凝胶电泳检测扩增到的PCR产物。
2 结 果
2.1 tab1-CMS胞质对烟草农艺性状的影响
在诸城、西昌两个烟草生态区种植SK01(tab1-CMS)和可育对照K326,以及8对杂交组合,中心花开放期对其株高、节距、有效叶数、茎围、最大叶叶长、最大叶叶宽等农艺性状进行调查(表2)。
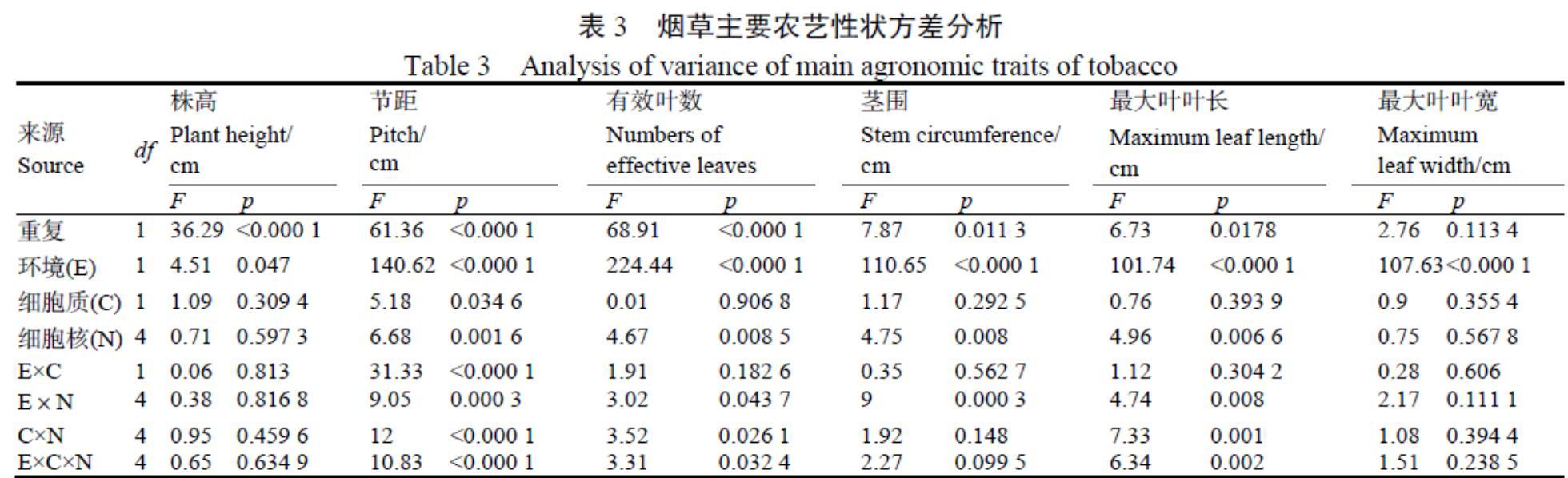
方差分析(表3)发现,tab1-CMS细胞质对所调查的农艺性状除节距外无显著影响,环境是影响农艺性状的最重要因素,而核基因组对节距、有效叶数、茎围和最大叶叶长等农艺性状有显著影响,对株高、最大叶叶宽无显著影响。细胞质与环境互作对节距有显著影响,细胞质-细胞核组互作、细胞质-细胞核-环境三因素互作均对节距、有效叶数、叶长等性状有显著影响。
2.2 tab1-CMS对产量性状的胞质效应
对每一对具有相同父本的两个杂交组合(例如S/M1-F/M1,S/M2-F/M2,S/M3-F/M3,S/M4-F/M4)以及S-F进行统计分析,可以估算tab1-CMS对烟草产量相关性状的细胞质效应。结果表明(表4),在两个烟草生态区,tab1-CMS的胞质效应不一致。在西昌生态区,tab1-CMS细胞质对产量相关性状均无显著的细胞质效应;在诸城生态区,tab1-CMS细胞质对大多数杂交组合的产量相关性状均表现出细胞质效应,正效应和负效应的个数相同。对于有效叶数,tab1-CMS胞质在S/M1-F/M1、S/M2-F/M2、S/M4-F/M4三个组合上表现为正胞质效应,在组合S-F中表现为有负胞质效应,在S/M3-F/M3中表现为无显著胞质效应。对于最大叶叶长,tab1-CMS细胞质在S/M1-F/M1、S/M2-F/M2两个组合中表现为负胞质效应,在组合S-F中表现为有正效应,在其他两个组合S/M3-F/M3、S/M4-F/M4中无显著细胞质效应。对于最大叶宽,tab1-CMS细胞质在S/M1-F/M1、S/M3-F/M3两个组合中表现为有负效应,在组合S-F中表现为正效应,在S/M2-F/M2、S/M4-F/M4中则无显著细胞质效应。表明tab1-CMS的细胞质效应与其互作的核基因组有关。
2.3 tab1-CMS胞质对烟草抗病性的影响
抗病性是胞质评价的重要内容,对SK01和K326以及它们分别与M1、M2、M3、M4四个烟草品种的各杂交F1代的病情指数进行统计分析(表5),结果显示,tab1-CMS细胞质对黑胫病抗性有显著影响(p=0.0369),对CMV抗性有极显著影响(p<0.0001),对TMV、PVY抗性无显著影响。细胞质-细胞核互作对黑胫病、CMV有显著影响,对TMV、PVY则无显著影响。
比较父本相同、母本细胞核一致而细胞质不同的两个F1代杂交种的病情指数差异(表6),可以看出当父本为中烟100(M1)、NC82(M2)時,F1代的黑胫病病情指数存在显著差异,细胞质为tab1-CMS的F1代病情指数显著低于可育胞质,表现出tab1-CMS胞质在黑胫病抗性上的正效应。在CMV抗性上,父本为中烟100(M1)时,tab1-CMS的F1代病情指数显著低于可育胞质;SK01和K326两个材料在黑胫病抗性和CMV抗性上均存在显著差异。在TMV、CMV抗性上,细胞质不同、细胞核相同的成对杂交组合间病情指数的差异不显著。
2.4 tab1-CMS特异的DNA标记
设计S1、S2两对引物在sua-CMS(MS中烟100、中烟201、NC55)、tab1-CMS(SK01、YL-1、YL-6)两种不育胞质类型的不育系和可育烟草(中烟100、K326)共8个烟草材料中扩增trnC-trnD的完整基因间区域,扩增结果(表7)显示每个样品的扩增产物单一,且同一引物在不同材料间的扩增长度一致,其中S1扩增长度为1492 bp,S2扩增长度为1756 bp。对每个片段的5个克隆测序结果表明每个PCR片段序列完全一致。而S1和S2的扩增区域在tab1-CMS不育系、sua-CMS不育系与可育烟草间存在25个多态性位点,含有相同细胞质的烟草材料序列具有100%的相似性(表7)。在可育烟草和tab1-CMS与sua-CMS之间存在16个差异位点,sua-CMS和可育烟草与tab1-CMS之间存在5个差异位点,tab1-CMS和sua-CMS与可育烟草之间存在3个差异位点。在3种细胞质中,trnC-trnD基因间区域的s1738位点各不相同。在s1738位点,sua-CMS不育系为TTTTATTCCAGG GGGG,tab1-CMS不育系为GGGGGCAA,可育烟草为GGGGGCAGCT TTATAA,而在s2321位点,sua-CMS不育系和可育烟草均为ATCATT,而tab1-CMS不育系该位点缺失。根据sua-CMS、tab1-CMS和可育烟草中trnC-trnD基因间区域中s1738和s2321位点的序列特征,设计特异性引物S3在tab1-CMS不育系中特异性地扩增到一个588 bp的片段,该片段在sua-CMS不育系和可育烟草中未得到扩增(图1)。
3 讨 论
烟草不育系或杂交种的种植面积占总种植面积的70%以上,但不育胞质来源单一,急需扩大不育胞质来源。本研究对一个新的不育胞质tab1-CMS在农艺性状和抗病性上的胞质效应进行评价,结果显示tab1-CMS细胞质对农艺性状无显著影响,对黑胫病、CMV抗性具有正效应,对TMV、PVY无显著影响,表明tab1-CMS表现优异,有望用于烟草杂交育种和不育系转育。
农艺性状是品种选育的基础。在本研究中,一年两点的试验结果表明tab1-CMS细胞质对烟草株高、节距、茎围、最大叶叶长、最大叶叶宽,有效叶数等农艺性状无显著影响,但在西昌、诸城两个烟叶生态区,不育细胞质对农艺性状的影响各不相同:在西昌,tab1-CMS细胞质对所调查的6个农艺性状均无显著的细胞质效应;在诸城,tab1-CMS细胞质对62.9%(17/27)的性状有显著影响,有些表现为正效应,有些表现为负效应。以云烟87和G13-5为材料配制正反交组合F1代农艺性状分析显示,株高、有效叶数、腰叶长正反交存在显著差异,而节距、茎围、腰叶宽不存在正反交差异[31],说明细胞质在一定程度上会影响烟草F1代的农艺性状。
环境是影响农艺性状的重要因素,本研究中的诸城和西昌两个烟草生态区海拔、纬度不同,环境因素对所调查的6个农艺性状均有显著或极显著影响。其他研究者的研究也表明,环境因素对不同品种的烟草农艺性状有一定的影响[32]。核基因组(品种)是影响农艺性状的主要因素,在本研究中,核基因组对茎围和最大叶叶长等部分农艺性状有显著影响,对株高、最大叶叶宽无显著影响。黄鹏等[33]对毕纳1号等7个烟草品种的农艺性状比较也显示,在株高等农艺性状上不同品种间的表现不同,暗示品种间的农艺性状差异与品种间的亲缘关系有一定的关系。细胞质-环境、细胞质-细胞核、细胞质-细胞核-环境之间存在相互作用,互作对节距等部分性状有显著影响。总的来说,在配置杂交组合和不 育系转育时,需要考虑父本的核背景以及品种的种植区域等因素。
在本研究中,tab1-CMS细胞质在黑胫病、CMV抗性上表现为正效应,在PVY和TMV抗性上与可育胞质无显著差别。烟草其他不育胞质在抗病性上也观察到显著的胞质效应,孙玉合等[34]的研究表明,不育胞质来源于N. glauca的不育系86-6与其保持系革新一号相比,在黑胫病、赤星病的抗性上好于革新一号,而不育胞质来源于N. bigelovii、N. megalosiphon和 N. plumbaginifolia的不育系抗病性减弱[2]。因此,在烟草抗病育种中,除了发掘优异的抗病种质外,还需要考虑细胞质对抗病性的影响。
高等植物葉绿体基因组在结构和组成上高度保守,但在叶绿体基因组的非编码区(如内含子或基因间区)存在大量的SNP、InDel和基因组结构变异[35-36],叶绿体中这些快速进化的序列片段为快速准确地识别物种提供了大量的分子标记信息[37-38]。本研究中,通过比较tab1-CMS,sua-CMS和可育烟草中trnC-trnD基因间区域的序列,获得了25个变异位点。变异频率为0.7%,显示了在trnC-trnD的基因间区域变异丰富。
4 结 论
本研究通过比较tab1-CMS不育系YK01和同核异质系K326与4个烤烟品种杂交F1代在农艺性状和抗病性上的差异,认为tab1-CMS细胞质对后代的农艺性状和抗病性上没有显著的负效应,有的性状还表现为正效应,可作为烟草育种中的优异不育胞质来源。但是烟草农艺性状和抗病性的影响因素很多且存在着复杂的相互作用,尚需更多研究明确tab1-CMS细胞质在烟草遗传改良中的利用规律,以对其胞质效应进行更全面的评价。
参考文献
[1] KUMAR B V, VENUGOPAL M, BARWALE Z U, et al. Heterosis: emerging ideas about hybrid vigour[J]. Journal of Experimental Botany, 2012, 63(18): 6309-6314.
[2] 佟道儒. 烟草育种学[M]. 北京:中国农业出版社,1997:279-294.
TONG D R. Tobacco breeding[M]. Beijing: China Agricultural Press, 1997: 279-294.
[3] GRACEN, GROGAN. Diversity and Suitability for Hybrid Production of Different Sources of Cytoplasmic Male Sterility in Maize[J]. Agronomy Journal, 1974, 66(5): 654-657.
[4] TRAVEN A, WONG J M S, XU D, et al. Interorganellar Communication[J]. Journal of Biological Chemistry, 2001, 276(6): 4020-4027.
[5] QIN P, WANG Y, LI Y Y, et al. Analysis of cytoplasmic effects and fine-Mapping of a genic male sterile line in rice[J]. Plos One, 2013, 8(4): e61719.
[6] YAO S, CHEN T, ZHANG Y D, et al. Transferring translucent endosperm mutant gene wx-mq and rice stripe disease resistance gene stv-bi by marker-assisted selection in rice (Oryza sativa)[J]. Rice Science. 2011, 18(2): 102-109.
[7] 王學德. 棉花细胞质雄性不育的研究与利用[J]. 中国农业科学,2019,52(8):1341-1354.
WANG X D. Overview of the study and application of cytoplasmic male sterility in cotton[J]. Scientia Agricultura Sinica, 2019, 52(8): 1341-1354.
[8] 黄得润,沈君辉,刘光杰,等. 作物抗病虫性的细胞质遗传效应研究进展[J]. 中国农学通报,2006(9):333-337.
HUANG D R, SHEN J H, LIU G J, et al. Recent advances in inheritance of cytoplasmic effects on crop resistance to diseases and insect pests[J]. Chinese Agricultural Science Bulletin, 2006(9): 333- 337.
[9] 马文广,张恒,白永富,等. 烤烟雄性不育系与其同型可育品种性状比较[J]. 湖南农业大学学报(自然科学版),2005(5):38-41.
MA W G, ZHANG H, BAI Y F, et al. Comparison of traits of the mail sterile lines and their maintainer lines of flue-cured tobacco[J]. Journal of Hunan Agricultural University (Natural Sciences), 2005(5): 38-41.
[10] KIM S, PLAGNOL V, HU T T, et al. Recombination and linkage disequilibrium in Arabidopsis thaliana[J]. Nature Genetics, 2007, 39(9): 1151.
[11] YU X L, LIU Y P, LV Y X, et al. Development of molecular markers specific to petaloid-type cytoplasmic male sterility in tuber mustard (Brassica juncea var. tumida Tsen et Lee)[J]. Mol.Biol. Rep, 2014, 41(2): 769-778.
[12] TAN Y P, XU X, WANG C T, et al. Molecular characterization and application of a novel cytoplasmic male sterility-associated mitochondrial sequence in rice. BMC Genet 16, 45 (2015). https://doi.org/10.1186/s12863-015-0205-0.
[13] HENG S, LIU S S, XIA C X, et al. Morphological and genetic characterization of a new cytoplasmic male sterility system (oxa CMS) in stem mustard (Brassica juncea)[J]. Theoretical and applied genetics. Theoretische und angewandte Genetik, 2018, 131(1): 59-66.
[14] HENNG S P, SHI D Y, HU Z H, et al. Characterization and classification of one new cytoplasmic male sterility (CMS) line based on morphological, cytological and molecular markers in non-heading [J]. Chinese cabbage (Brassica rapa L.), 2015, 34(9): 1529-1537.
[15] SHU J, LIU Y, LI Z, et al. Detection of the diversity of cytoplasmic male sterility sources in Broccoli (Brassica Oleracea var. Italica) using mitochondrial markers[J]. Frontiers in Plant Science, 2016, 7: 927-927.
[16] LI N, ZHENG Y Q, DING H M, et al. Development and validation of SSR markers based on transcriptome sequencing of Casuarina equisetifolia[J]. Trees, 2018, 32(1): 41-49.
[17] 李鳳霞,杨爱国,崔萌萌,等. 四种细胞质来源的烟草不育系线粒体SSR位点差异[J]. 作物学报,2011,37(12):2285-2285.
LI F X, YANG A G, CUI M M, et al. Mitochondrial microsatellite variability of tobacco cms lines with four different cytoplasms[J]. Acta Agronomica Sinica, 2011, 37(12): 2285-2285.
[18] 孙炳蕊,范芝兰,李晨,等. 含不同地区野生稻胞质的水稻雄性不育材料线粒体SSR标记分析[J]. 分子植物育种,2016,14(9):2392-2404.
SUN B R, FAN Z L, LI C, et al. The analysis of rice cytoplasmic male sterility lines with different wild rice cytoplasm using the mitochondrial SSR markers[J]. Molecular Plant Breeding, 2016, 14 (9): 2392-2404.
[19] 袁凯,张婷,史晓芳,等. K、V、T型小麦细胞质雄性不育系叶绿体DNA的SSR分析及RuBP羧化酶活性比较[J]. 西北植物学报,2019,39(3):97-104.
YUAN K, ZHANG T, SHI X F, et al. Comparison of chloroplast DNA and RuBP carboxylase (rubisco) activity with K, V, T-type cytoplasmic male-sterile wheat lines[J]. Acta Botanica Boreali- Occidentalia Sinica, 2019, 39(3): 97-104.
[20] 刘光照. 辣椒细胞质雄性不育系细胞学观察和mtDNA-AFLP分析[D]. 咸阳市:西北农林科技大学,2010.
LIU G Z. Cytological observation of pepper CMS and mtDNA-AFLP analysis[D]. Xianyang: Northwest A & F University, 2010.
[21] CHRISTOPHER V, AGNIESZKA K, MICHAEL H. Sequencing and annotation of the chloroplast DNAs and identification of polymorphisms distinguishing normal male-fertile and male-sterile cytoplasms of onion[J]. Genome, 2013, 56(12): 737-742.
[22] LIN H, HONG X, ZHOU P, et al. Combination of microRNA expression profiling with genome-wide SNP genotyping to construct a coronary artery disease-related miRNA-miRNA synergistic network[J]. Bioscience trends, 2014, 8(6): 297-307.
[23] DANIELL H, LIN C S, YU M, et al. Chloroplast genomes: diversity, evolution, and applications in genetic engineering[J]. Genome Biology, 2016, 17(1): 1-29.
[24] LIN D, GONG X, JIANG Q, et al. The rice ALS3 encoding a novel pentatricopeptide repeat protein is required for chloroplast development and seedling growth[J]. Rice, 2015, 8(1): 17.
[25] KOHN C V, KIELKOWSKA A, HAVEY M J. Sequencing and annotation of the chloroplast DNAs and identification of polymorphisms distinguishing normal male-fertile and male-sterile cytoplasms of onion[J]. Genome 2013, 56: 737-742.
[26] LEE C, WEN J. Phylogeny of Panax using chloroplast trnC-trnD intergenic region and the utility of trnC-trnD in interspecific studies of plants[J]. Molecular Phylogenetics & Evolution, 2004, 31(3): 894-903.
[27] FRITSCH, PETER W, CRUZ, et al. Phylogeny of Symplocos Based on DNA Sequences of the Chloroplast trnC-trnD Intergenic Region[J]. Systematic Botany, 2006. 31(1): 181-192.
[28] TALEBI, MAJID, AKBARI, et al. Molecular polymorphism in Pistacia vera L. using non-coding regions of chloroplast DNA[J]. Genetic Engineering and Biotechnology Journal, 2016, 14(1): 31-37.
[29] 国家烟草专卖局. 烟草农艺性状调查方法:YC/T 142—2010[S]. 北京:中国标准出版社,2003:227-231.
State Tobacco Monopoly Administration. Investigation method of tobacco agronomic traits: YC/T 142—2010[S]. Beijing: China Standards Press, 2003: 227-231.
[30] 张维军,袁汉民,王小亮,等. 宁夏春小麦抗旱性的遗传多样性分析[J]. 干旱地区农业研究,2017,9(6):95-103.
ZHANG W J, YUAN H M, WANG X L, et al. Genetic diversity of spring wheat germplasm resources based on drought resistance in Ningxia[J]. Agricultural Research in the Arid Areas, 2017,9(6):95-103.
[31] QIN P, WANG Y, LI Y, et al. Analysis of cytoplasmic effects and fine-mapping of a genic male sterile line in rice[J]. PLoS One, 2013, 8: e61719.
[32] 宋鵬飞,陈兴位,马迅,等. 纬度和海拔二维因素对云南烤烟农艺性状的影响[J]. 西南农业学报,2017,30(10):2345-2351.
SONG P F, CHEN X W, MA X, et al. Effects of latitude and altitude on agronomic traits of flue-cured tobacco in Yunnan[J]. Southwest China Journal of Agricultural Sciences, 2017, 30(10): 2345-2351.
[33] 黄鹏,徐庆国. 不同烤烟品种农艺性状与经济性状的差异研究[J]. 作物研究,2016,2(2):126-130.
HUANG P, XU Q G. The Differences of agronomic and economic characters in different flue-cured tobacco cultivars[J]. Crop Research, 2016, 2(2): 126-130.
[34] 孙玉合,丁昌敏,张历历,等. 烟草新胞质雄性不育系86-6的创造及其利用[J]. 中国烟草学报,1999(1):3-5.
SUN Y H, DING C M, ZHANG L L, et al. Creation and utilization of new cytoplasmic male sterile line 86-6 in tobacco[J]. Acta Tabacaria Sinica, 1999(1): 3-5.
[35] NIELL H, LIN C S, YU M, et al. Chloroplast genomes: diversity, evolution, and applications in genetic engineering[J]. Genome Biology, 2016, 17(1): 1-29.
[36] BAO H, XIONG Y, GUO H, et al. MapNext: a software tool for spliced and unspliced alignments and SNP detection of short sequence reads[J]. BMC Genomics, 2009, 10(16): 1851-1858.
[37] JANSEN RK, CAI Z, RAUBESON LA, et al. Analysis of 81 genes from 64 plastid genomes resolves relationships in angiosperms and identifies genome-scale evolutionary patterns[J]. Proc Natl Acad Sci, 2007, 104: 19369-19374.
[38] HAN Y W, DUAN D, MA X F, et al. Efficient identification of the forest tree species in Aceraceae using DNA barcodes[J]. Front Plant Sci, 2016, 7: 1707.
