混合盐辅助燃烧合成纳米ZrC粉体及影响机制*
2021-11-13占发琦吴浩恺郑月红喇培清
许 珂,占发琦,张 华,安 宁,吴浩恺,朱 敏,郑月红,喇培清
(兰州理工大学 省部共建有色金属先进加工与再利用国家重点实验室, 兰州 730050)
0 引 言
ZrC是一种极具潜力的超高温陶瓷材料。它具备优异的性能,其中最优异的性能是极高的熔点(3420 ℃)和超高的硬度(25.5 GPa),此外还具有高弹性模量、高热导率和电导率、优良的抗热震性以及适中的热膨胀率等,在高温条件下也能保持很高的强度[1-5]。正是这样优异的性能,使ZrC被广泛应用于切削工具[6-7]、耐磨涂层[8-9]、电极材料[10]、核燃料包覆材料[11-12]以及超音速飞行器和火箭推进的材料[13-14]等。但包括ZrC在内的大多数高熔点化合物普遍存在烧结性能差的问题[15]。而纳米粉体材料,由于具备极高的比表面积和表面原子活性,表现出较好的烧结性能,可以很好的解决这一问题。因此,纳米ZrC粉体的制备越来越受到专家学者的关注。
值得注意的是,粉体的纯度、粒度和颗粒形貌对其性能有极大的影响,这些都是由制备方法和工艺所决定的。目前常用的制备方法有溶胶凝胶法(Sol-Gel)[16-17]、自蔓延高温合成法(SHS)[18-20]、机械合金化法(MA)[21-22]、化学气相沉积法(CVD)[5]、放电等离子烧结法(SPS)[23,24]等。而对于纳米粉体的规模化制备,在提高产量的同时保证其高纯度和粒度可控是最基本的要求,但这也是一项极具挑战性的工作。总结了近几年报道中存在的一些问题:(1)制备的粉体纯度低,粒度粗大,团聚严重;(2)大多数制备方法需要很高的预热温度;(3)对盐助燃烧合成过程中稀释剂作用机理的研究文献较少;(4)大部分研究是在小规模合成(100 g以下)的前提下进行的,缺乏大规模(500 g以上)制备高纯度超细纳米粉体的数据支持。
在本文中,采用一种新型的盐助燃烧合成工艺,在ZrO2-Mg-C体系中,加入混合盐NaCl-KCl作为稀释剂,利用引燃剂诱发反应,可以大规模的制备纯相的纳米ZrC粉体。该方法的优点是:(1)引燃剂的燃烧温度很低,具有很低的起始反应温度;(2)极高的生产率,一次可制备公斤级的纯相纳米粉体。另外,采用NaCl-KCl混合盐作为稀释剂的优势在于混合盐按照一定的比例混合后拥有比单一盐更低的共熔点。本研究的主要目的是研究混合盐NaCl-KCl的加入量对ZrC的纯度和粒度的影响规律及作用机制。
1 实 验
1.1 样品制备
以ZrO2(>99.5%,1 μm)和石墨(99.95%)分别作为Zr源和C源,Mg(>99.5%,325目)作为还原剂,同时在该体系中加入NaCl-KCl(99.95%)作为稀释剂,之后的提纯用盐酸(工业级)、以及蒸馏水(自制)。
按照方程式(1)化学计量称取原料。其中Mg容易挥发损失,过量25%(质量分数)。另外,将NaCl和KCl按照摩尔量n(NaCl) ∶n(KCl)=1∶1混合,加入量w按照原料总量的质量分数称取,分别称取0%、10%、20%、30%、40%。在配置原料前首先将原料放在干燥箱中,在50 ℃下烘24 h。然后将混合粉末装罐置于球磨机中,球磨介质为氧化锆球,球料比为2∶1,转速为150~200 r/min,球磨时间为8 h。球磨结束后,在单轴单向施加30 MPa的压力,将粉料压制成80 mm×40 mm的圆饼状胚体,之后将引燃剂和胚体置于反应釜内铜坩埚中。然后,密封反应釜,充入2 MPa的氩气保护气氛,加热升温至200~300 ℃时引燃剂点燃自蔓延反应。反应结束后,自然冷却6 h,将黑色块状试样取出粉碎后,用9.6 mol/L的盐酸浸出48 h,之后用蒸馏水反复清洗。最后将分离出的固体放置在真空烘箱中,在70 ℃下干燥12 h。反应的总化学反应式如下:
ZrO2+C+2Mg+wNaCl-KCl=ZrC+2MgO+wNaCl-KCl
(1)
1.2 表 征
利用D/MAX-2400型的X射线衍射仪(XRD)对浸出前后的产物进行物相鉴定。采用JSM-6700型场发射扫描电子显微镜(FESEM)和JEM-2010场发射透射电子显微镜(TEM)观察样品颗粒尺寸和微观形貌。利用Image-Pro Plus 6.0图像统计软件分析样品的SEM图像的粒度分布。利用岛津AXIS SUPRA型X射线光电子能谱仪(XPS)测定样品的表面元素含量和化学价态。采用LabRAM HR Evolution型显微激光拉曼光谱仪定性测定产物中游离碳的存在。采用JW-BK200C比表面及孔径分析仪,测定样品粉末的比表面积。
2 结果与讨论
2.1 热力学计算
绝热温度Tad是指在理想的绝热条件下,体系所能达到的最高温度。根据经验,一般在Tad≥1 800 K时才能维持自发反应。如果Tad<1 800 K,可以利用预热、化学炉以及热爆等方法对体系补热来维持反应的进行。
体系的绝热温度计算公式[25]:
(2)
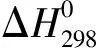
Cp可以近似计算:
Cp=A1+A2×10-3T+A3×105T2+A4×10-6T2
(3)
式中,A1,A2,A3,A4分别为物质恒压摩尔热容计算公式中各温度项的系数,通过查找热力学手[26]获得。
将各组分的Cp代入公式(2)中:
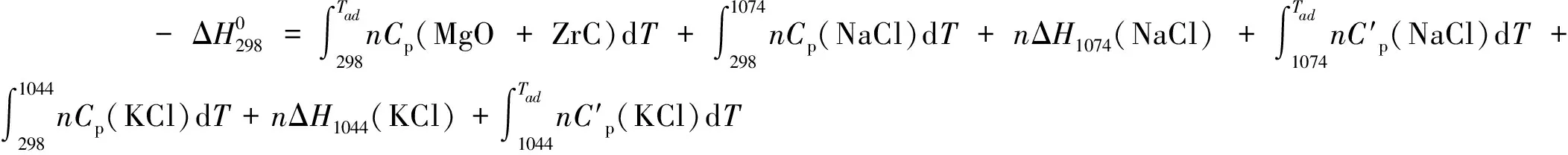
(4)
由式(4)计算出不同NaCl-KCl加入量时体系的绝热温度,如图1所示。

图1 NaCl-KCl加入量对系统绝热温度的影响Fig 1 The effect of NaCl-KCl addition on the adiabatic temperature of the system
图1为体系绝热温度与稀释剂含量的关系图。从图1中可以看出随着NaCl-KCl加入量的增加体系的绝热温度从2233 K降至1534 K,这是由于NaCl-KCl的熔、沸点要小于1 800 K,在反应过程中发生相变吸收了大量的热量。如图2相图中所示,NaCl-KCl按照n(NaCl)∶n(KCl)=1∶1混合后其共熔点降至657 ℃(930 K)远小于1800 K。当加入量超过20%(质量分数)时,绝热温度降至1 800 K以下。但根据实际的实验结果,当w=30%时,体系依然发生了自蔓延反应,考虑到反应发生在充入2 MPa氩气的反应炉中且预热到260 ℃左右,所以实际状态下体系的绝热温度已经满足自蔓延反应的要求,可以维持自发反应的进行。但是,当w=40%时,反应没有发生,实际状态下未达到热力学要求,不能维持自发反应。因此,在满足自蔓延反应的热力学条件下,NaCl-KCl作为稀释剂是可以有效降低体系绝热温度的。

图2 NaCl-KCl相图Fig 2 NaCl-KCl binary phase diagram
查找无机热力学手册[26],分别计算出体系中可能发生的反应的吉布斯自由能变,如图3,表1所示。

表1 ZrO2-Mg-C系统中反应的标准吉布斯能变化(ΔG=A+BT)Table 1 Standard Gibbs energy change of reaction in ZrO2-Mg-C system
从图3可以看出,在恒温恒压的标准状态下,在体系反应的温度范围内,反应(8)、(9)、(10)的吉布斯能始终大于零不会自发进行,相应的副产物很难产生。相比较而言,反应(7)的吉布斯自由能最负,说明该反应的生成趋势最大,生成物是最稳定的,产物相为ZrC和MgO。将反应(7)拆分后,可以分为两个阶段,第一阶段为镁热还原阶段的反应(5),第二阶段发生碳热还原反应(6)。当温度低于1800 K时,反应(5)、(6)、(7)的吉布斯能均小于零,反应都能自发的进行。而反应(5)的ΔG随着温度的升高而增大,当温度高于1 800 K后ΔG﹥0,很可能会出现反应不完全的现象,导致最终产物中出现Zr(CxOy)相。

图3 ZrO2-Mg-C体系中反应的ΔG-T关系图Fig 3 ΔG-T of reaction in ZrO2-Mg-C system
2.2 NaCl-KCl加入量对ZrC粉体物相成分的影响
图4为不同NaCl-KCl含量样品的XRD图谱。从图4(a)中可以看出,加入10%~30%的NaCl-KCl的样品浸洗前,相组成包括ZrC、MgO、NaCl和KCl相,并没有出现的ZrO2的峰,表明反应比较充分。而且NaCl和KCl的峰强度随着加入量w的增加而增强,说明熔盐没有完全挥发。样品浸洗后,MgO和剩余的盐可以通过酸洗和水洗除去,最终得到纯相的ZrC粉末,如图4(b)所示。从图4(b)中的放大图像可以看到,制备出的ZrC相的(111)衍射峰的峰位与标准的纯相ZrC(PDF#35-0784)接近,说明ZrC的纯度很高。发生细小偏差的原因可能是非化学计量的ZrCx相中x总是小于1的,一般不超过0.98,当C:Zr大于0.98时,C是以游离态出现的[6];还有一个原因是ZrC晶胞中原子半径较小的C不可避免的会被半径较大的O取代,形成Zr(CxOy)相,晶格常数增大,因此制备出的样品比标准ZrC的峰位向低角度偏移。图4(b)中,由于氧取代引起ZrC的晶格膨胀,导致(111)衍射峰的峰位置与标准的纯相ZrC相比向小角度偏移。加入NaCl-KCl作为稀释剂后,随着稀释剂加入量的增加,(111)衍射峰的峰位置向大角度偏移,逐渐接近标准相,这是由于稀释剂的加入促进物质传输,有利于碳热还原反应,Zr(CxOy)相中O被C还原,C含量增加,引起晶格缩小。另外,从图中还可以看到,随着w的增加,衍射峰的强度变低且逐渐宽化,表明晶粒尺寸减小,这与表2中Scherrer公式计算出的结果一致。

表2 不同NaCl-KCl含量的样品在(111)衍射面计算出的晶粒尺寸Table 2 Grain sizes of samples with differentNaCl-KCl contents at (111) diffraction plane
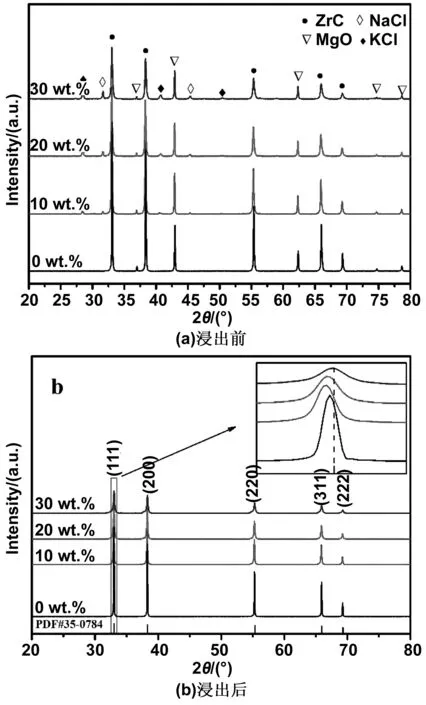
图4 不同NaCl-KCl含量的样品的XRD图谱Fig 4 XRD patterns of samples of different NaCl-KCl content before and after leaching
图5为NaCl-KCl的样品的拉曼图谱。可以看出在1 350和1 580 cm-1处分别出现D峰和G峰,D峰是代表石墨的无序振动峰,出现的原因是石墨结构中或者结构的边缘处存在缺陷,而G峰是石墨结构的主要特征峰,是由sp2碳拉伸振动引起的,两峰同时出现也证实ZrC粉末的碳成分中存在游离态的碳,并且与不加稀释剂相比,加入30%的NaCl-KCl的样品游离碳的含量增加,这是由于颗粒尺寸减小,比表面积增加,在颗粒表面吸附的碳含量增加。
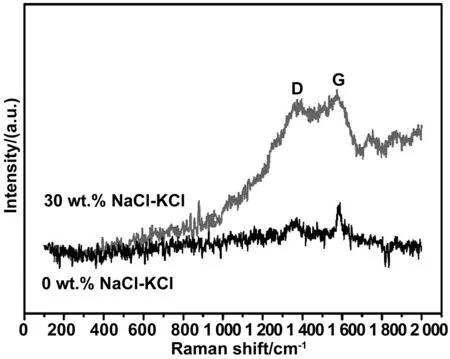
图5 NaCl-KCl的样品浸出后的拉曼光谱Fig 5 Raman patterns of 30wt% NaCl-KCl samples after leaching
利用XPS对颗粒表面的元素组成进行分析,如图6所示,ZrC粉体的表面主要分布Zr、C、O 3种元素。从表3可以看出,颗粒表面的氧和碳的含量都很高,而且随着w的增大,Zr元素变化不大,C元素含量减小,O元素含量增加,表明C和O元素在颗粒表面富集,随着NaCl-KCl含量的增加,ZrC颗粒表面氧化加剧,O不断取代表面的C元素。当加入量为30%时,体系的绝热温度较低,导致C还原Zr不充分,残留了少量的碳,同时颗粒尺寸减小,会增加颗粒表面的吸附碳。

图6 不同NaCl-KCl含量的样品浸出后的XPS图谱Fig 6 XPS map of samples with different NaCl-KCl content after leaching

表3 不同NaCl-KCl含量的样品浸出后的表面元素原子比Table 3 Surface element atomic ratio of samples withdifferent NaCl-KCl content after leaching
图7是不同NaCl-KCl含量的样品浸出后的C1s、O1s、Zr3d峰的高分辨XPS光谱及各化学态相对含量比。图7(a)中对C1s光谱分峰拟合得到5个峰分别是C=O、C-O、sp3C-C、Zr(O,C)和ZrC,峰位分别为288.85、286.35、284.8、284.0和281 eV[6]。其中,表面的碳含量过高,主要是因为反应中残留的游离碳sp3C-C吸附在表面。另外,从图7(b)可以看出,随着盐含量w的增加C-C有减小的趋势,而Zr(O,C)有增加的趋势,证明颗粒表面存在氧取代现象。图7c是O1s光谱,3个峰分别是位于531.2、529.1和527.4 eV[6]。而从图7(d)中可以看出,随着w的变化各化合态的相对含量变化不大。图7(e)中两对双峰ZrO23d3/2、ZrO23d5/2、ZrC 3d3/2、ZrC 3d5/2分别出现在182.3、179.9、178.4和176 eV[6],Zr 3d3/2与Zr 3d5/2面积比为2∶3,其自旋轨道分裂为2.4 eV。如图7(f)所示,随着NaCl-KCl的增加,Zr-O呈增长趋势,Zr-C呈下降趋势,样品表面存在氧取代。

图7 不同NaCl-KCl含量的样品浸出后的C1s、O1s、Zr3d峰的高分辨XPS光谱及化学态相对含量比Fig 7 High resolution XPS of C1s, O1s and Zr3d peaks after leaching of samples with different NaCl-KCl content and the relative content ratio of chemical states
图8是加入不同稀释剂制备产物的EDS图谱。从图中可以看出燃烧合成的产物浸洗后,元素组成包括Zr、C和O 3种元素。表4中给出了各元素的占比,其中O元素随着稀释剂含量的增加而增加,通过XRD分析已知燃烧合成产物中没有ZrO2相,并结合XPS分析的结果得出颗粒细化导致表面氧化加剧。从表中得到的数据可以看出,各组样品中Zr和C的总百分比均在90%以上,当NaCl-KCl加入量为30%时,Zr和C的含量占比为97.26%。

图8 不同NaCl-KCl含量的样品的能谱图Fig 8 EDS of samples with different NaCl-KCl content

表4 不同NaCl-KCl含量的样品的元素含量占比
2.3 NaCl-KCl加入量对ZrC粉体粒度和微观形貌的影响
图9是在不同NaCl-KCl加入量的条件下制备出的ZrC粉末浸出后的SEM图像。从图中可以看出,ZrC粉体的粒度随着NaCl-KCl加入量的增加而减小,颗粒的形貌逐渐趋于球型。结合图10可以更直观的看出,随着NaCl-KCl的加入量从0%增加到30%,粉体的平均粒径从476 nm减小到47 nn。表5直接给出了3种粒度指标,从结果来看,NaCl-KCl的加入量在20%和30%时,ZrC粉体的粒度分布完全进入纳米级别,这与Scherrer公式计算出的晶粒尺寸相互印证。另外,图11给出了BET测试的结果,当NaCl-KCl的加入量为30%时,样品的比表面积为18.192 m2/g。因此,选取NaCl-KCl作为稀释剂可以有效的减小颗粒尺寸。

表5 不同NaCl-KCl加入量的样品的粒度指标Table 5 Grain size index of samples with addingdifferent amount of NaCl-KCl

图9 不同NaCl-KCl加入量的样品的SEM图像(a, b: 0wt%;c, d: 10 wt%;e, f: 20 wt%;g, h: 30 wt%)Fig 9 SEM images of samples with different amounts of NaCl-KCl added

图10 不同NaCl-KCl加入量的样品的粒度分布统计图Fig 10 Grain-size distribution statistics of samples with different NaCl-KCl addition amounts

图11 加入30%(质量分数)NaCl-KCl的产物的等温吸附曲线Fig 11 Isothermal adsorption curve of the product adding 30wt% NaCl-KCl
图12给出了透射电镜的测试结果,可以看出产物颗粒形貌大部分为类球状的,粒度分布和前文给出的结果是一致的。从图13中高分辨图像测出的晶面间距(图13(a))和选区电子衍射图谱(图13(d))来看,ZrC是立方晶体结构,颗粒完整,结晶度较好。另外,从图13(b)中可以看到,在ZrC颗粒的表面形成一层厚度为2.9 nm的壳层,结合XPS分析,确定这是Zr(CxOy)壳层。

图12 不同NaCl-KCl加入量样品的TEM图像(a, d: 10 wt%;b, e: 20 wt%;c, f: 30 wt%)Fig 12 TEM images of samples with different NaCl-KCl addition amounts

图13 不同NaCl-KCl加入量样品的HRTEM、SAED图像Fig 13 Different NaCl-KCl addition sample of HRTEM and SAED image
表6总结了近几年ZrC纳米粉体制备的报道。本文采用盐助燃烧合成工艺,通过加入NaCl-KCl作为稀释剂,可以调控产物的平均粒径从500 nm降至50 nm左右。与报道中的方法相比,该方法预热温度低,能耗成本低,工艺流程简单,产率高,可以宏量(公斤级)制备高纯超细ZrC纳米粉体,且产物粒度细小均匀,在目前的报道中处于领先水平。

表6 ZrC粉末的合成Table 6 Synthesis of ZrC powder
2.4 NaCl-KCl混合盐辅助合成纳米ZrC的作用机制
如图14(a)所示,将ZrO2-Mg-C胚体置于反应炉中,开始通过外部设备预热,当预热温度达到533 K左右,置于胚体试样表面的引燃剂发生放热反应,瞬间释放出的热量辐射到附近的原料上,导致该区域的原料温度达到1800 K以上,此时,体系的自蔓延反应开始。图14(b)所示的是快速升温阶段,Mg还原ZrO2放出的热量为体系升温提供能量。当温度达到923 K时,固态的Mg开始融化,活性较高的液相Mg在固相颗粒间渗透,形成包覆层,与ZrO2颗粒的接触面积增大,镁热反应加剧,升温速率进一步加快。温度很快达到930 K,NaCl-KCl开始融化,不断吸收周围传导出的热量,升温速率变缓。当局部温度达到1054 K时,Mg开始大量挥发,大量的Mg蒸汽出现,充满整个密闭空间,镁热反应程度达到顶点,体系的升温速率达到最大。当局部温度快速的达到1700 K左右时,NaCl-KCl剧烈挥发,瞬间带走大量的热量,体系的升温速率急剧降低,当体系升温速率为零时,温度不再升高,体系达到绝热温度。冷却阶段如图14(c)所示,NaCl-KCl不断发生相变吸热,体系温度开始降低。此时,熔融态的NaCl-KCl为反应提供液相传质,有利于游离态的Zr*和C反应生成ZrC,ZrC晶体开始形核和长大,当稀释剂不断相变吸热加速体系冷却,导致过冷度增加,晶体的成核速率增加,晶体长大速率减小。虽然晶体长大速率受到热力学和动力学的共同作用,但随着过冷度的增加,晶体成核速率远大于晶体的生长速率,因此最终产物的粒度减小。当温度低于NaCl-KCl的凝固点时,NaCl-KCl凝固结晶,被固相NaCl-KCl包覆着的ZrC晶粒停止长大,如图14(d)所示。
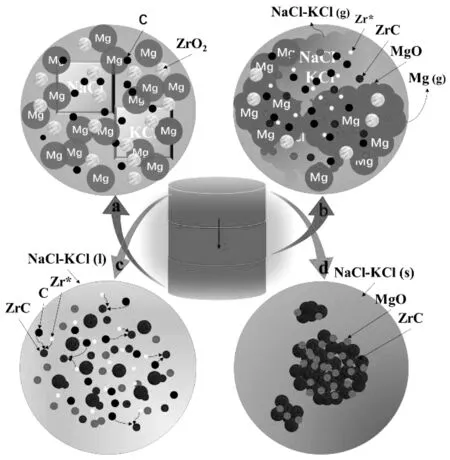
图14 在ZrO2-Mg-C体系中NaCl-KCl的生成机制图(a:初始阶段;b:燃烧升温阶段;c:冷却阶段;d:熔盐结晶阶段)Fig 14 The formation mechanism of NaCl-KCl in the ZrO2-Mg-C system
3 结 论
本文采用新型熔盐辅助自蔓延燃烧合成技术,通过在ZrO2-Mg-C体系中加入NaCl-KCl作为稀释剂成功的制备出高纯纳米ZrC粉体,并研究了NaCl-KCl含量对体系绝热温度、粉体纯度和粒度的影响规律,探讨其作用机理。
(1)在ZrO2-C-Mg体系中,稀释剂NaCl-KCl的加入有利于获得纯相的ZrC,产物ZrC的纯度在90%以上,当NaCl-KCl的加入量为30%时,ZrC的纯度为97.26%。另外,ZrC粉体中存在游离态的碳,随着NaCl-KCl加入量的增加,ZrC颗粒表面的碳含量减少,氧含量增加,在颗粒表面形成一层Zr(CxOy)壳层,厚度在2.9 nm左右。
(2)通过改变NaCl-KCl的含量可以将ZrC粉体的颗粒尺寸从500 nm降至50 nm。当NaCl-KCl的加入量为30%时,获得粉体的粒度指标为:中位径D50=46 nm,平均粒径为47 nm,比表面积为18.192 m2/g。
(3)熔盐稀释剂的作用过程分为4个阶段,分别为初始阶段;燃烧升温阶段;冷却阶段以及熔盐结晶阶段,熔盐稀释剂的作用机制是通过相变吸热降低体系的绝热温度和降温速率,增大过冷度,提高晶体成核速率,减小晶粒尺寸。另外,熔融盐提供的液相加速物质传输,有利于纯相ZrC的生成。晶体长大速率受到热力学和动力学的共同作用,随着NaCl-KCl加入量的增加,晶体成核速率大于晶体长大速率,导致最终产物的粒度减小。
