碳氮源优化提高兼养三角褐指藻生物量和岩藻黄素产量
2021-11-12杨润青宋培钦
王 珊,杨润青,宋培钦,魏 东
(华南理工大学 食品科学与工程学院,广东 广州 510640)
岩藻黄素(fucoxanthin)是一种广泛存在于大型褐藻、硅藻和金藻等海洋藻类中的类胡萝卜素,具有抗氧化、抗肿瘤、减肥、预防阿兹海默症、调节血糖和血脂等多种生物活性[1],在生物医药、功能性食品等领域具有重要应用价值。目前,岩藻黄素的主要商业来源是从海带等大型褐藻中提取,提取物中岩藻黄素含量低、生产成本高、藻油稳定性差、生产受季节性局限等固有缺陷,无法满足快速增长的国际市场需求。
海洋硅藻作为海洋生态系统中重要的初级生产者,其胞内岩藻黄素的含量是大型褐藻的上百倍[2],被认为是藻基岩藻黄素的新来源。三角褐指藻(Phaeodactylum tricornutum)是一种生长快、适应性强的海洋硅藻,可进行利用CO2的光合自养生长,也可利用外源有机碳氮源(甘油、醋酸钠、蛋白胨、尿素等)进行兼养(光发酵)生长[3]。研究发现,与其它有机碳源(如葡萄糖、果糖、甘露糖等)相比,以甘油为有机碳源兼养培养三角褐指藻可以获得最大生物量和色素含量[5]。在半连续补料模式下,以0.14 mol/L甘油为碳源对三角褐指藻进行兼养培养,生物量产率最高可达1.50 g/(L·d);在分批补料模式下,添加0.10 mol/L甘油时胞内类胡萝卜素含量达到最高,约占干质量的0.45%[4]。与自养相比,以甘油为有机碳源的兼养培养可显著提高三角褐指藻的生物量,但胞内类胡萝卜素含量普遍偏低,其中岩藻黄素的含量更低[5],亟须开发有效手段在兼养培养中提高岩藻黄素的含量。
岩藻黄素是海洋硅藻的重要捕光色素,它与蛋白质和叶绿素组成FCP复合物,共同存在于光合膜系统[6]。氮素是海洋硅藻中参与蛋白质和叶绿素合成的重要营养元素,尿素循环在硅藻氮代谢途径中至关重要[7]。三角褐指藻可利用多种氮源进行快速生长并积累岩藻黄素。有研究发现,尿素可显著促进三角褐指藻生物量积累,但对岩藻黄素积累无显著促进作用[8]。以云杉水解物(葡萄糖质量浓度达2.00 g/L)为碳源、酵母提取物 (总氮质量分数为11.60%)为氮源培养三角褐指藻,可获得最大生物量和岩藻黄素产量分别为3.31 g/L和0.52 mg/L[9]。另有研究[10]发现,在f/2培养基中添加10倍的硝酸钠培养三角褐指藻,可获得最高岩藻黄素质量分数为59.20 mg/g。转录组学分析发现,在氮充足条件下多数编码岩藻黄素合成的基因会被上调,从而促进岩藻黄素的积累[11]。因此,充足的氮源浓度与合适的氮源种类是促进三角褐指藻中岩藻黄素积累的必要条件。
目前对于三角褐指藻兼养培养的研究大多集中在油脂生产方面,关于兼养条件下岩藻黄素的高效生产的报道极少。作者以三角褐指藻为研究对象,系统研究兼养条件下有机碳源(甘油)浓度、氮源种类及浓度对细胞生长、生物量和岩藻黄素积累的影响,筛选获得优化兼养培养基和培养策略,为利用三角褐指藻高效生产岩藻黄素提供新技术支撑。
1 材料与方法
1.1 藻种与培养基
三角褐指藻藻株CCMP 2561由中国科学院水生生物研究所胡晗华研究员惠赠。藻种用f/2人工海水培养基[12],在恒温光照培养箱(温度:20℃,光照强度:2 000 lx)中进行斜面培养,于4℃ 冰箱中保存。
1.2 试剂与仪器
岩藻黄素标准品:购于美国Sigma公司;胰蛋白胨:购于广东环凯微生物科技有限公司;总氮试剂:购于美国HACH公司;乙腈、叔丁基甲醚、甲醇:色谱纯,购于广州卯林仪器有限公司;甘油、尿素、硝酸钠、丙酮等:均为分析纯,购于广州卯林仪器有限公司;1339R型光照强度测定仪:购于台湾泰仕电子工业股份有限公司;DRB200型消解器:购于美国HACH公司;BD Accuri C6型流式细胞仪:购于美国Beckman Coulter公司;Modulyod冷冻干燥机:购于美国热电公司;6890-5975型气相质谱联用仪:购于美国安捷伦科技有限公司;TDL-4013型高速离心机:购于上海安享科学仪器厂。
1.3 研究方法
1.3.1 种子液制备 从改良的f/2培养基 (表1)[13]斜面上挑取三角褐指藻藻苔,接种至含有已灭菌改良的f/2培养基的250 mL三角瓶中,装液量为100 mL,置于持续光照的恒温摇床中培养,培养温度为(20±1) ℃,冷白日光灯光照强度为(2 000±500) lx,摇床转速为150 r/min,培养10 d。
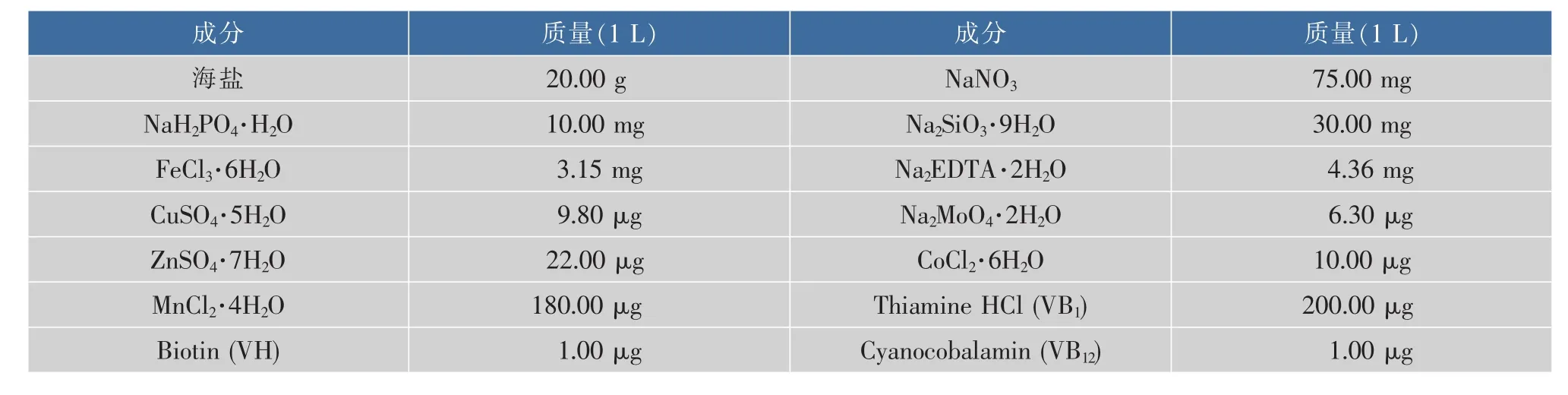
表1 改良的f/2培养基组成Table 1 Composition of modified f/2 medium
1.3.2 甘油浓度对三角褐指藻生长和岩藻黄素质量分数及产量的影响 将培养好的三角褐指藻种子液转接至新的f/2培养基,以硝酸钠为氮源(含氮量0.01 mol/L),加入不同浓度甘油为有机碳源,浓度分别设置为 0、0.05、0.10、0.15 mol/L。 控制初始细胞密度为1×106个/mL,调节 pH 8.0,每组 3个平行样,在恒温光照摇床中培养,培养温度为(20±1)℃,冷白日光灯光照强度为(2 000±500)lx,转速 150 r/min,培养10 d。每两天取样,测定三角褐指藻细胞密度。培养结束时测定其生物量和岩藻黄素质量分数与产量。所有实验结束后收集剩余藻液,并于5 000 r/min离心3 min,弃上清液,将藻泥进行真空冷冻干燥以获得藻粉,藻粉于-20℃冰箱中储存作后续分析检测使用。
1.3.3 氮源种类对兼养三角褐指藻生长和岩藻黄素质量分数及产量的影响 将培养好的三角褐指藻种子液转接至新的无氮f/2培养基,以0.10 mol/L甘油为碳源,分别加入不同种类的氮源 (硝酸钠0.85 g/L、尿素 0.30 g/L、胰蛋白胨 1.17 g/L),使总氮浓度均为0.01 mol/L。其余培养条件和分析测试同1.3.2。
1.3.4 胰蛋白胨浓度对兼养三角褐指藻生长及岩藻黄素质量分数及产量的影响 将培养好的三角褐指藻种子液转接至新的无氮f/2培养基,以0.10 mol/L甘油为碳源,分别加入不同质量浓度胰蛋白胨(0.58、1.17、1.75、2.33 g/L)为氮源,使含氮量分别达到 0.005、0.010、0.015、0.020 mol/L,其余培养条件和分析测试同1.3.2。
1.3.5 混合氮源对兼养三角褐指藻生长和岩藻黄素质量分数及产量的影响 将培养好的三角褐指藻种子液转接至新的无氮f/2培养基,以0.10 mol/L甘油为碳源,加入不同种类氮源,分别设置纯胰蛋白胨(2.33 g/L)、胰蛋白胨:尿素(1.17 g/L 和 0.30 g/L,含氮量 1∶1)、胰蛋白胨:硝酸钠(1.17 g/L 和 0.85 g/L,含氮量1∶1)。混合氮源按等摩尔含氮量1∶1进行混合,总氮浓度为0.02 mol/L,其余培养条件和分析测试同1.3.2。
1.4 分析测试
1.4.1 细胞密度 采用流式细胞仪进行细胞密度测定。吸取2 mL三角褐指藻培养液于2 mL离心管中离心,去除上清液,用超纯水洗涤、重悬至上机浓度(约 1×106个/mL~5×106个/mL),经 300 目尼龙筛绢过滤后上流式细胞仪进行细胞密度绝对计数[14]。
1.4.2 生物量 采用烘干差重法测定生物量。测量已烘至恒质量的离心管质量,记为空管质量M1。吸取2 mL藻液于该离心管中,8 000 r/min离心3 min,弃上清液,蒸馏水洗涤离心两次后将藻泥置于烘箱中,80℃烘干至恒质量,测定并记录总质量M2。每个样品设置3个平行,取平均值并计算标准差[15]。
1.4.3 比生长速率 以生物量计算比生长速率μ(d-1)[16],比生长速率计算公式如下:
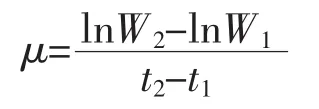
式中:W2、W1分别是在 t2、t1时测定的生物量,g/L。
1.4.4 培养基总氮质量浓度 培养基总氮质量浓度采用哈希DR2700分光光度计测定[17],配套试剂为No.2714100。取待测培养基上清液,稀释质量浓度至总氮为2~150 mg/L,加入配套试剂后在消解器DRB200上105℃消解30 min。消解完成后冷却至室温,加入粉剂包(TNA、TNB)反应 5 min 后,用分光光度计DR2700进行测定,直接读出总氮质量浓度。
1.4.5 岩藻黄素质量分数 将准确称量的藻粉10 mg装入有陶瓷珠的冻存管中,加入事先预冷的提取溶剂(V甲醇∶V丙酮=1∶1),用量为 1 mL/次,冻存管在细胞破碎振荡器上振荡30 s,用液氮浸提5 min,离心收集上清液于15 mL离心管中,多次反复提取直至藻粉变成白色[18]。合并所有上清液,在通风橱内用氮气流将离心管内有机溶剂吹干,用甲醇和叔丁基甲醚(MTBE)混合液(体积比 1∶1,含质量分数 0.1%BHT)准确定容至1 mL,用于岩藻黄素的HPLC分析,全程在无光或弱光条件下进行。
岩藻黄素采用HPLC测定 (HPLC系统采用Waters双1525泵和2996二极管阵列检测器):采用YMC色谱柱(Carotenoid column C 30柱,4.6 mm×150 mm,3 μm);流动相流速为 0.80 mL/min,柱温为40℃,进样量为20 μL。PDA检测器上设置检测波长为440 nm,测定岩藻黄素质量分数。流动相由甲醇(A)和叔丁基甲醚MTBE(B)进行梯度洗脱,洗脱条件为:0~6 min,95%→80%A、5% →20%B;6~12 min,80%→60%A、20%→40%B;12~19 min,60%→55%A、40%→45%B;19~20 min,55%→95%A、45%→5%B;20~23 min,95%A、5%B。以岩藻黄素标准品的保留时间和可见光特征吸收光谱进行定性,外标法标准曲线对色谱图中岩藻黄素峰进行定量分析[13],计算藻粉中的岩藻黄素质量分数(mg/g)。
1.4.6 数据分析 采用Origin 9.0和SPSS软件对数据进行处理和统计学分析,所有实验数据均采用平均值±标准误差(mean±SD)表示。采用单因素方差分析法和成对数据t-检验进行显著性检验分析,不同字母之间表示显著性差异(P<0.05)。
2 结果与讨论
2.1 甘油浓度对三角褐指藻生长和岩藻黄素质量分数与产量的影响
甘油浓度对三角褐指藻生长和岩藻黄素质量分数的影响见图1。由图1可知,与自养培养(甘油为0 mol/L)相比,添加甘油浓度为 0.05、0.10、0.15 mol/L,可显著提高三角褐指藻的细胞密度(P<0.05)。培养结束时,0.15 mol/L甘油条件下细胞密度及比生长速率达到最大值,分别为1.72×108个/mL和0.26 d-1,是自养的 1.35 倍和 1.18 倍(P<0.05),见表2。如图1所示,随着甘油浓度的增加,藻细胞的生物量和岩藻黄素质量分数均呈现出先升高、后下降的变化趋势。在0.10 mol/L甘油浓度下,生物量和产率、岩藻黄素质量分数和产量分别达到最高值,比自养分别提高了 30.40%、43.49%、200.00% 和291.52%。
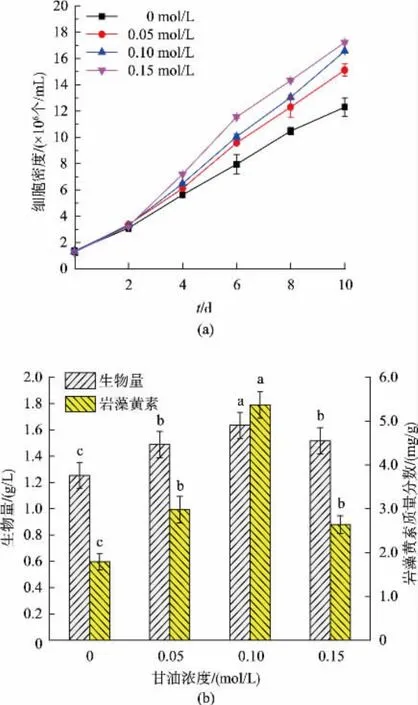
图1 甘油浓度对三角褐指藻细胞密度、生物量和岩藻黄素质量分数的影响Fig.1 Effects of glycerol concentrations on thecell density,biomassconcentration and fucoxanthin content in P.tricornutum
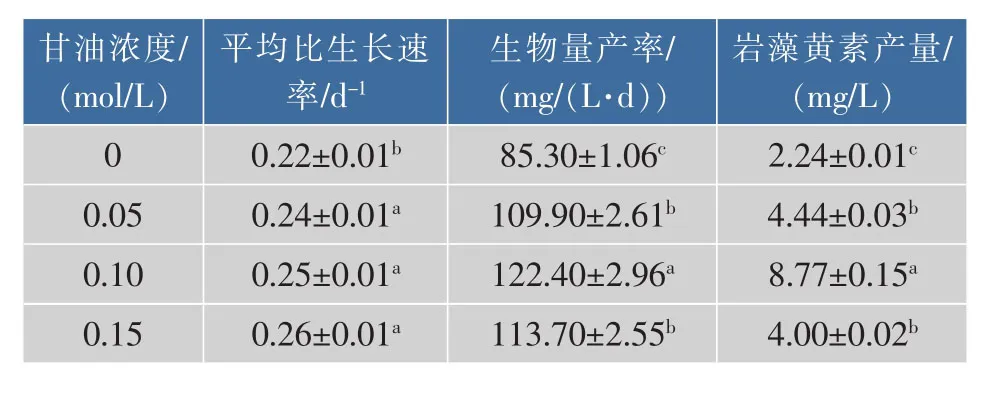
表2 甘油浓度对三角褐指藻生产性能的影响Table 2 Production capability of P.tricornutum under different glycerol concentrations
Ceron Garcia等人利用0.10 mol/L甘油培养三角褐指藻,可以获得最大的生物量产率为168.96 mg/(L·d),是自养条件下的 7 倍[5]。 Liu 等人发现三角褐指藻在0.10 mol/L甘油的平均比生长速率和生物量分别是光自养条件下的1.64倍和1.60倍[3],均与本实验结果类似。通过同位素标记法,利用13C-甘油研究三角褐指藻中甘油的代谢途径,发现甘油通过消耗光合磷酸化产生的ATP代谢为磷酸二羟丙酮(DHAP)和 3-磷酸甘油醛(GAP),并进入卡尔文循环参与中心碳代谢[19]。这表明在兼养条件下,三角褐指藻可以通过质体和线粒体之间广泛的能量交换将呼吸作用和光合作用耦合在一起,从而驱动三角褐指藻中CO2和有机碳的同化[19-20]。研究还发现,在混养条件下,胞内50%氨基酸合成的碳骨架来源于甘油代谢[19],这可能导致了蛋白质的高效积累,从而促进岩藻黄素合成。本研究结果表明,选取甘油浓度为0.10 mol/L为最适甘油浓度,可促进三角褐指藻的生长和提高岩藻黄素的产量。
2.2 氮源种类对兼养三角褐指藻生长和岩藻黄素质量分数与产量的影响
不同种类氮源对兼养三角褐指藻的细胞生长和岩藻黄素质量分数与产量的影响见图2。由图2(a)可知,相对于等摩尔氮素的硝酸钠和尿素,细胞利用胰蛋白胨进行生长的延滞期缩短了2 d。培养结束时细胞密度达到最大值,为1.21×108个/mL,分别是硝酸钠和尿素为氮源时的2.16倍3.00倍 (P<0.05)。同时,平均比生长速率为0.39 d-1,显著高于硝酸钠和尿素为氮源时(P<0.05),见表3。梁英等人发现,在自养条件下以尿素为氮源培养三角褐指藻,其平均比生长速率显著高于硝酸钠和氯化铵(P<0.05),这表明有机氮源可以显著促进三角褐指藻的生长[21]。如图2(b)和表3所示,胰蛋白胨为氮源时,生物量和产率、岩藻黄素质量分数和产量都达到最高值,显著高于硝酸钠和尿素为氮源时(P<0.05)。
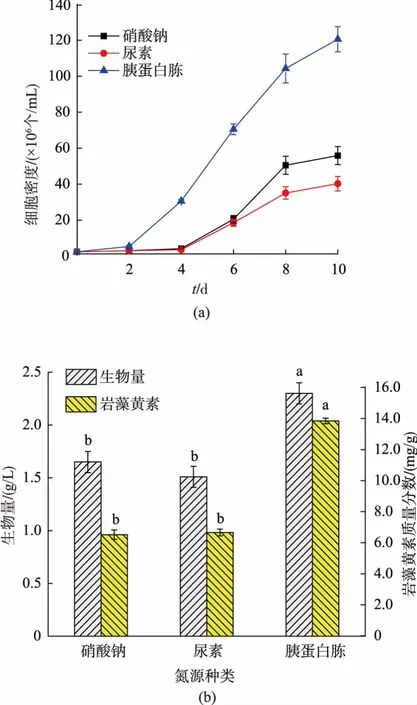
图2 氮源种类对兼养三角褐指藻细胞密度、生物量和岩藻黄素质量分数的影响Fig.2 Effects of different nitrogen sources on cell density,biomass concentration and fucoxanthin content inmixotrophic P.tricornutum
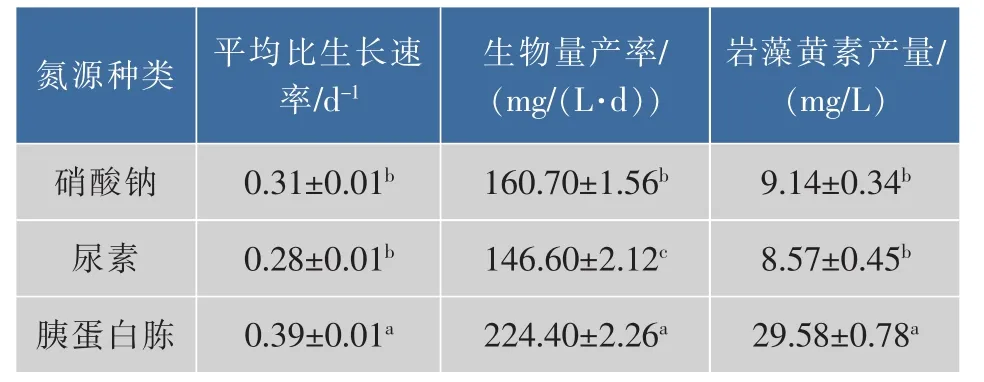
表3 氮源种类对兼养三角褐指藻的生产性能的影响Table 3 Production capability of mixotrophic P.tricornutum under different nitrogen sources
张文源等人发现在自养条件下以尿素为氮源时,三角褐指藻的生物量显著高于硝酸钠条件下,但岩藻黄素质量分数无显著性差异[8]。有研究表明,微藻细胞在相同条件下吸收利用尿素所需的能量消耗比硝酸盐更少,因此尿素可显著促进三角褐指藻的生物量积累[7]。三角褐指藻在尿素条件下的生物量与硝酸钠无显著性差异,见图2(b)。这可能是因为在兼养条件下以甘油为碳源时,三角褐指藻细胞通过甘油代谢产生大量的ATP和NADPH,为硝酸盐的转化提供能量与还原力,从而促进了三角褐指藻对硝酸根的吸收,导致尿素作为有机氮源的优势并不明显。同时,岩藻黄素质量分数在硝酸钠和尿素条件下无显著性差异,与文献报道一致。研究中还发现,三角褐指藻更倾向于利用胰蛋白胨中的游离氨基酸,可以促进细胞快速生长和岩藻黄素积累。因此,确定胰蛋白胨为最适宜三角褐指藻生长及岩藻黄素积累的氮源种类。
2.3 胰蛋白胨浓度对兼养三角褐指藻生长和岩藻黄素质量分数和产量的影响
胰蛋白胨浓度对兼养三角褐指藻的生长和岩藻黄素质量分数与产量的影响见图3。由图3(a)可知,细胞密度随着胰蛋白胨浓度升高而提高。培养结束时,在0.02 mol/L胰蛋白浓度下细胞密度达到最大值,为 1.61×108个/mL,显著高于其他浓度(P<0.05)。如图3(b)所示,随着胰蛋白胨浓度的提高,生物量和岩藻黄素质量分数也随之增加。在0.02mol/L胰蛋白胨条件下,生物量和产率、岩藻黄素质量分数和产量均达到最大值,见图3(b)和表4。与低浓度胰蛋白胨 (0.005 mol/L)相比,分别提高了110.71%、112.50%、156.89% 和441.11%。因此,提高胰蛋白胨浓度能够显著促进三角褐指藻的生物量和岩藻黄素产量。
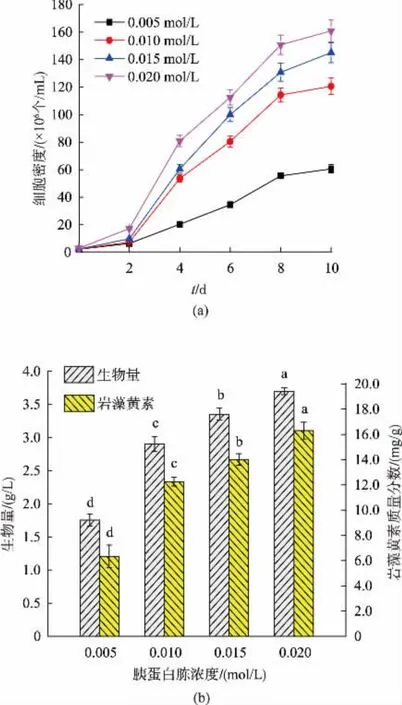
图3 胰蛋白胨浓度对兼养三角褐指藻细胞密度、生物量和岩藻黄素质量分数影响Fig.3 Effects of tryptone concentrations on the cell density,biomassconcentration and fucoxanthin content in mixotrophic P.tricornutum
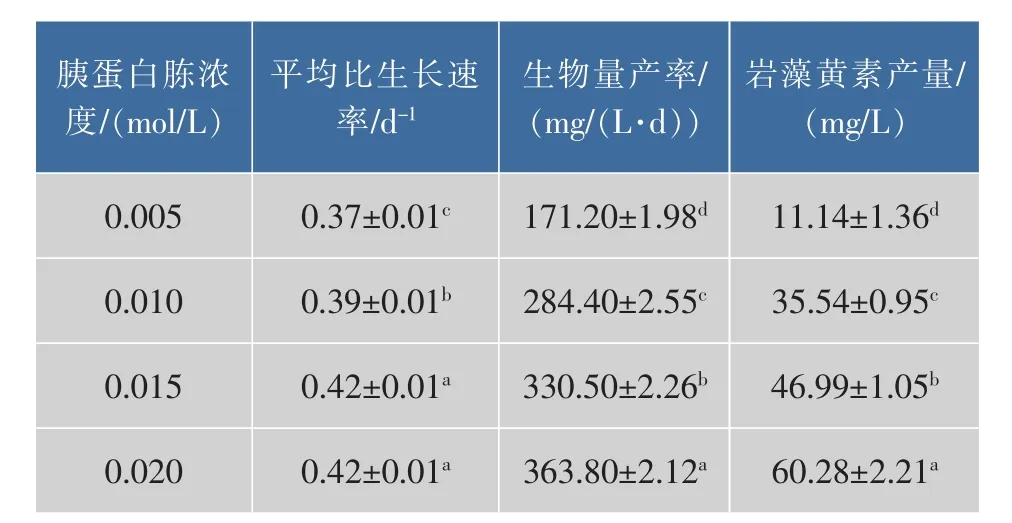
表4 不同胰蛋白胨浓度对兼养三角褐指藻生产性能的影响Table 4 Production capability of mixotrophic P.tricornutum under different tryptone concentrations
与本研究结果类似,以高质量浓度硝酸钠(64.29 mg/L)为氮源培养三角褐指藻获得的生物量产率是低质量浓度硝酸钠(32.09 mg/L)的1.44倍[22];在高氮(300 mg/L硝酸钠)时三角褐指藻的生物量和岩藻黄素质量分数是低氮(75 mg/L硝酸钠)下的1.75倍和1.30倍[15]。转录组学研究发现,在缺氮条件下,大多数氨基酸的合成途径及编码色素合成的基因均受到抑制,导致胞内叶绿素a和岩藻黄素质量分数降低[11],这说明充足的氮是三角褐指藻生物量及岩藻黄素快速积累的必要条件。因此,确定0.020 mol/L胰蛋白胨是最适宜三角褐指藻生长及岩藻黄素积累的氮源浓度。
2.4 混合氮源对兼养三角褐指藻生长和岩藻黄素质量分数与产量的影响
混合氮源对兼养三角褐指藻的生长和岩藻黄素质量分数与产量的影响见图4。由图4(a)可知,在使用胰蛋白胨与尿素为混合氮源下,细胞密度在培养第10天时达到最大值,为1.82×108个/mL,是纯胰蛋白胨条件下细胞密度的1.13倍(P<0.05)。平均比生长速率在不同氮源下无显著性差异,见表4。以胰蛋白胨和尿素为混合氮源时,三角褐指藻的总氮消耗速率为16.10 mg/(L·d),是以纯胰蛋白胨为氮源时的1.14倍(P<0.05),但与胰蛋白胨和硝酸钠为混合氮源条件下无显著性差异,见表5。三角褐指藻的生物量和岩藻黄素质量分数在两组混合氮源条件下无显著差异,但均显著高于纯胰蛋白胨(P<0.05)。在胰蛋白胨与硝酸钠和尿素为混合氮源的条件下,三角褐指藻的生物量、生物量产率、岩藻黄素质量分数和产量分别达到 3.94 g/L、389.52 mg/(L·d)、20.83 mg/g和81.97 mg/L,分别是使用纯胰蛋白胨时的1.07倍、1.36倍、1.28倍和1.08倍,见表5。结果表明,三角褐指藻细胞在混合氮源下的生长状况优于单一氮源组,可能是在纯胰蛋白胨条件下培养过程中产生的胞外分泌物抑制了细胞的生长积累。已有研究报道,使用混合氮源培养微藻较单一种类氮源培养微藻,对微藻的生长和生物量的积累有更好的效果[23]。王菊芳等人[24]的研究表明,与单一氮源相比,以蛋白胨和硝酸钾为混合氮源培养隐甲藻可以获得最大的生物量,这与本研究结果类似。因此,以胰蛋白胨和尿素为混合氮源获得的三角褐指藻生物量和岩藻黄素产量最高,可作为三角褐指藻生长及岩藻黄素积累的最适混合氮源。
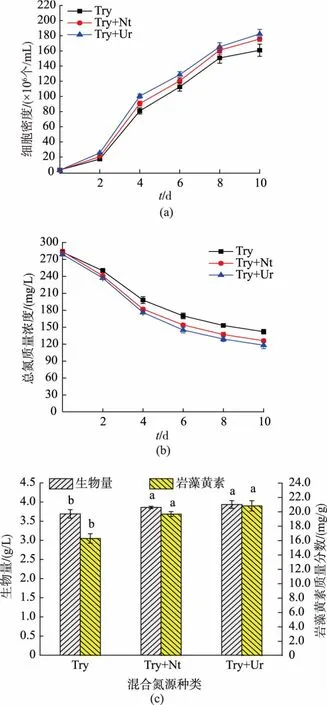
图4 混合氮源对兼养三角褐指藻细胞密度、总氮浓度、生物量和岩藻黄素质量分数的影响Fig.4 Effects of mixed nitrogen sources on the cell density,total nitrogen concentration,biomass concentration and fucoxanthin content in mixotrophic P.tricornutum
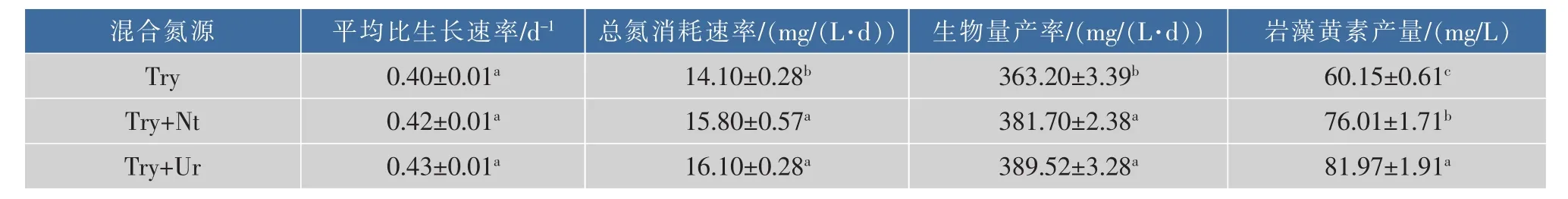
表5 不同氮源种类对兼养三角褐指藻生产性能的影响Table 5 Production capability of mixotrophic P.tricornutum under different nitrogen sources
目前,三角褐指藻在混养培养方式下,以0.10 mol/L甘油、0.01 mol/L尿素为初始碳氮源进行分批补料培养,可获得最高的生物量为15.40 g/L,是目前报道中最高的生物量,但该条件下获得的类胡萝卜素只占干质量的0.49%[25]。本研究通过对三角褐指藻混养体系中的碳氮源进行优化,可显著提高三角褐指藻的生物量、岩藻黄素的质量分数和产量。结果表明,以0.10 mol/L的甘油为碳源、以含氮量0.02 mol/L的胰蛋白胨和尿素混合氮源(1∶1)为氮源进行混养培养时,三角褐指藻获得的最终细胞密度、生物量、岩藻黄素质量分数和产量分别是1.82×108个/mL、3.94 g/L、20.83 mg/g和 81.97 mg/L,分别是优化前的14.80倍、3.15倍、11.64倍和36.59倍。同时,本实验中最优条件下三角褐指藻获得的岩藻黄素产量(81.97 mg/L)已经达到目前已报道的最高水平。
3 结语
通过系统比较和优化甘油浓度、氮源种类与浓度及其组合,确定了三角褐指藻生长的最佳兼养培养基配方和培养策略,极大提高了细胞生长速率、生物量和岩藻黄素产量。采用建立的兼养条件(0.10 mol/L甘油为碳源,含氮量0.02 mol/L的胰蛋白胨和尿素混合氮源(1∶1)为氮源),获得的岩藻黄素产量(81.97 mg/L)是目前已知报道的最高水平,为后续规模化培养生产藻基岩藻黄素提供了技术支撑。
