改造细胞质膜促进途径酶组装及N-乙酰氨基葡萄糖合成
2021-11-12吕雪芹李江华堵国成
张 成 ,吕雪芹 ,金 柯 ,李江华 ,堵国成 ,刘 龙 *
(1.江南大学 未来食品科技中心,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122)
微生物在自然进化过程中,主要通过形成多酶复合体来生成底物通道,防止有毒中间代谢物扩散至细胞质,以此来提高代谢途径连续多步反应的催化效率[1]。因此,如何模拟多酶复合体,将产物合成途径中的关键酶类进行空间组装,目前已成为代谢工程领域的一个研究热点。近年来,研究者发现,将途径酶通过人工构建的蛋白质支架、DNA支架、RNA支架、微室结构等空间支架进行组装,可以减少反应中间物传递壁垒,从而显著提高反应效率[2-7]。为了减少上述外源支架对细胞造成的代谢负担,课题组前期开展了一系列内源性空间支架的研究工作,最终发现枯草芽孢杆菌中功能膜微域(FMMs)具有较高的空间和时间稳定性,可作为内源平台在基因组水平组装的多种途径酶,最终显著提高产物的合成量[8]。进一步分析显示,当使用质粒对途径酶进行过表达时,由于菌株自身FMMs数量有限,无法提供足够的空间满足途径酶的组装,最终导致代谢效率无法进一步提高[9]。针对上述问题,研究者通过对FMMs进行理性改造,提高了质膜上FMMs的占比。以GlcNAc合成为例,发现FMMs的理性改造促使GlcNAc的产量提高了292%[9]。然而,当进一步改造FMMs时,菌株形态发生弯曲并且菌株生长受到抑制,且GlcNAc产量下降。推测造成该现象的主要原因是质膜上FMMs区和非FMMs区需要维持一定的平衡,当这种平衡被打破时,细胞的生长等过程即会受到抑制。
细胞质膜主要由磷脂构成,磷脂酸(PtdOH)是磷脂合成的前体,同时也是细胞质膜的重要结构成分[10],因此调节PtdOH合成是改造细胞质膜的有效策略[11]。PtdOH在枯草芽孢杆菌中的合成途径如下:首先,PlsX催化酰基-ACP生成酰基-磷酸,之后由PlsY将酰基转移到甘油-磷酸的1位形成1-酰基甘油-磷酸,最后PlsC将酰基转移到1-酰基甘油-磷酸的 2 位形成 PtdOH[10,12-13]。 因此 PlsX、PlsY、PlsY是枯草芽孢杆菌细胞质膜改造的关键靶点。该研究以本课题组前期获取的菌株BSGN6-Y1为出发菌株,首先通过过表达PlsX、PlsY和PlsC对细胞质膜进行改造;之后,以枯草芽孢杆菌合成GlcNAc为例,将GNA1和YqaB两个异源途径酶通过SPFH结构域组装到FMMs。发酵结果显示,GlcNAc产量得到显著提高;同时还发现细胞质膜改造能够降低FMMs自身过度修饰对菌株形态和生长产生的不利影响。这些结果表明,改造细胞质膜能够改善FMMs的途径酶组装,最终增加GlcNAc的产量。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒 本研究中使用的菌株、质粒见表1。BSGY1:本研究的出发菌株,由BSGN6(野生型菌株B.subtilis 168衍生菌株)改造而成;大肠杆菌Escherichia coli JM109 (E.coli JM109):用于重组DNA实验;菌株和质粒全部保藏在作者所在实验室。
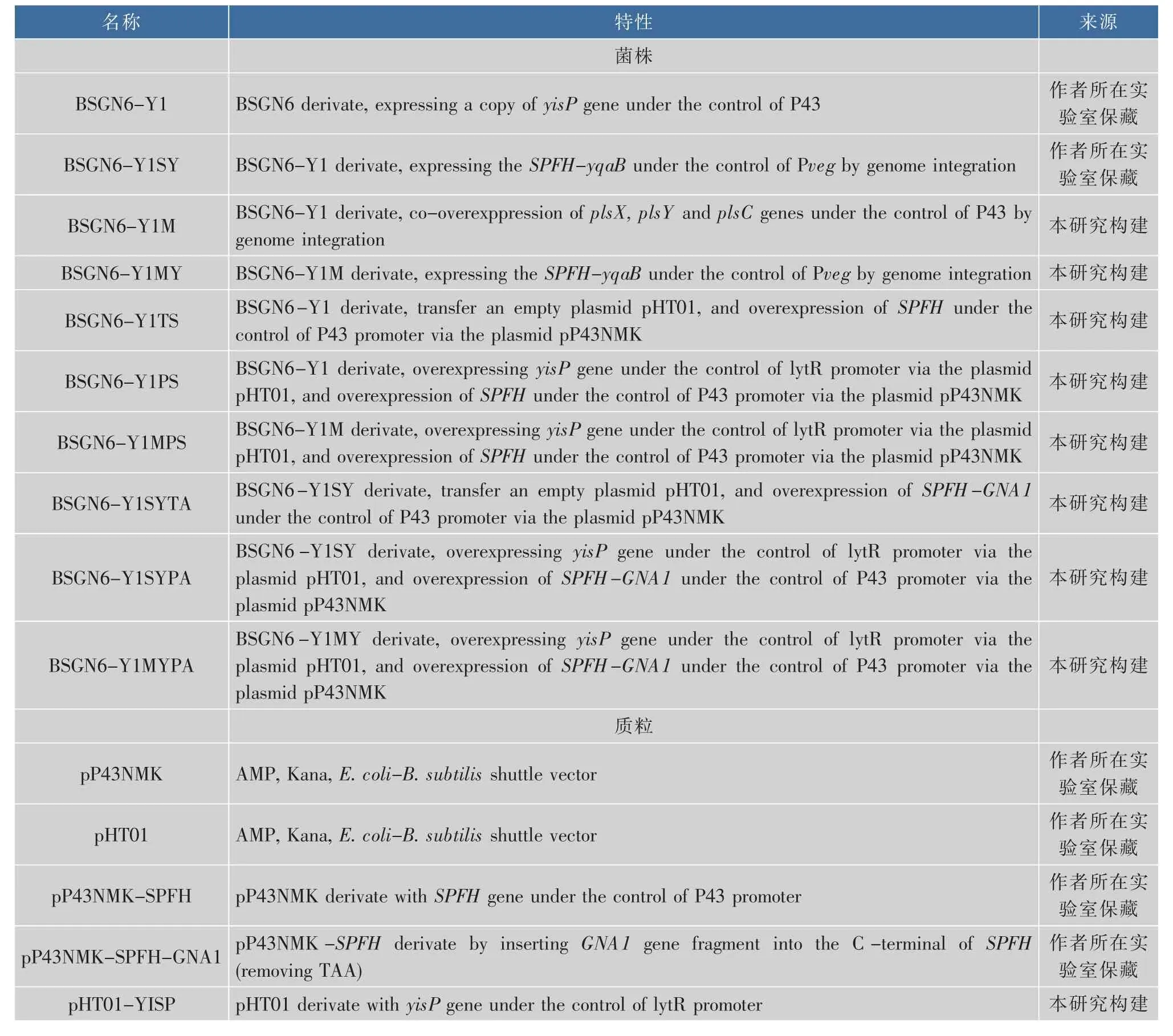
表1 本研究所用菌株和质粒Table 1 Strains and plasmids used in this study
1.1.2 培养基与试剂 Luria-Bertani(LB)培养基:蛋白胨 10 g/L,酵母粉 5 g/L,NaCl 10 g/L。
发酵培养基:蛋白胨6 g/L,酵母粉12 g/L,(NH4)2SO46g/L,KH2PO42.5g/L,K2HPO4·3H2O 12.5 g/L,葡萄糖60 g/L,微量金属溶液10 mL/L(CaCl24.0 g/L,MnSO4·5H2O 1.0 g/L,CoCl2·6H2O 0.4 g/L,FeSO4·7H2O 4.0 g/L,ZnSO4·7H2O 0.2 g/L,CuCl2·H2O 0.1 g/L,AlCl3·6H2O 0.1 g/L,NaMoO4·2H2O 0.2 g/L,H3BO40.05 g/L)。
培养基中添加抗生素的剂量分别为:氨苄青霉素 100 μg/mL,卡那霉素 50 μg/mL,氯霉素 5 μg/mL,壮观霉素 100 μg/mL。
TaqDNA 聚合酶、Prime STAR (max)DNA 聚合酶、DNA marker:购自TaKaRa公司;试剂和试剂盒:均购自上海生工生物工程有限公司。
1.2 实验方法
1.2.1 表达载体的构建和异源基因的融合 使用引物F-yisP和R-yisP,从B.subtilis 168基因组上扩增出yisP基因,同时使用引物对F-PHT01和RPHT01将质粒pHT01线性化,最后利用Gibosen将yisP基因和线性化质粒无缝组装。将组装后质粒转化E.coli JM109,次日使用引物F-yisP和R-yisP进行菌落PCR,将条带大小约为1 200 bp的克隆子测序确认,得到重组质粒pHT01-YISP,所用引物见表2。
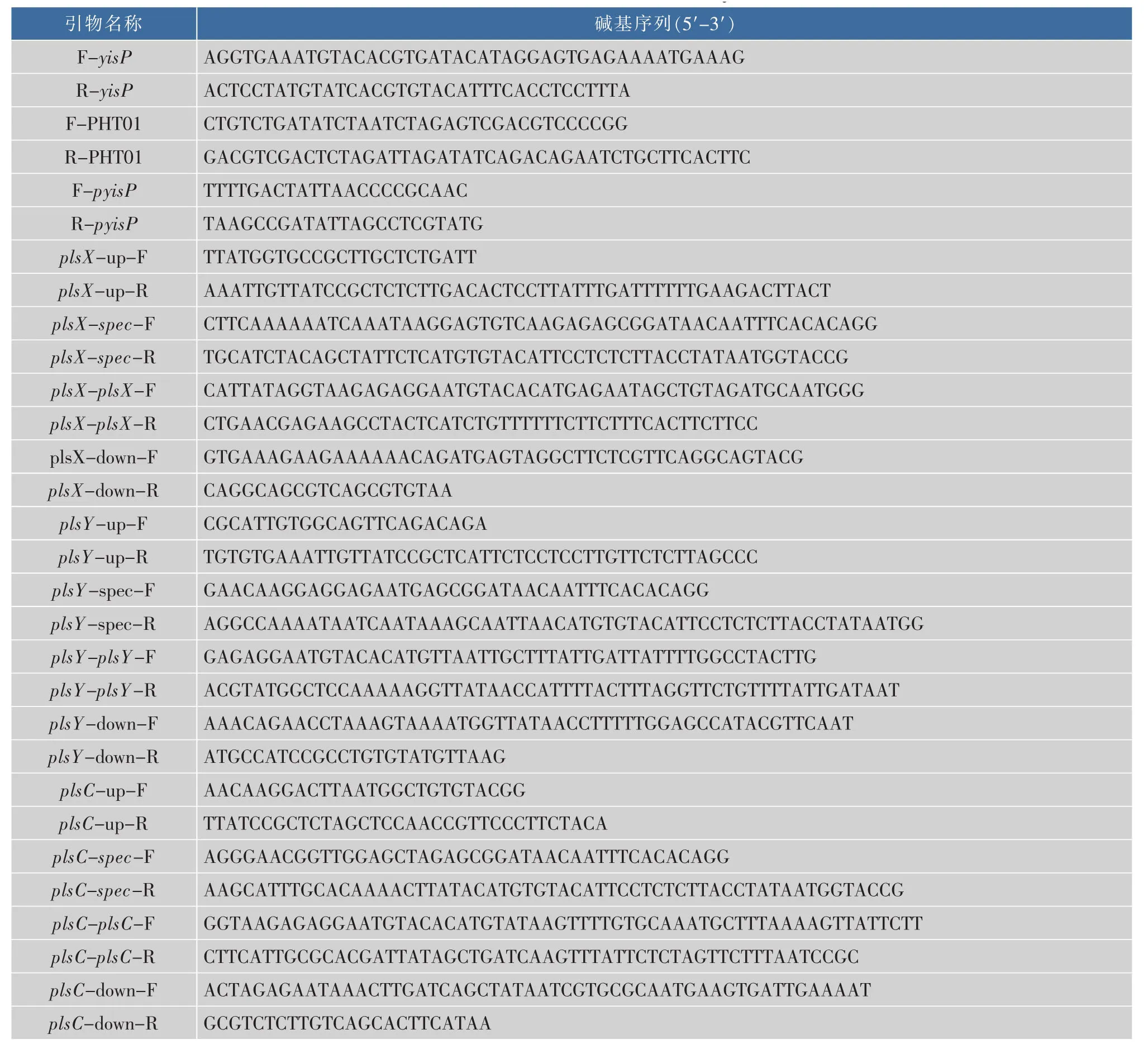
表2 本研究所用引物Table 2 Primers used in this study
异源基因的表达采用强启动子P43,其通过质粒P43NMK扩增而来。通过融合聚合酶链反应(PCR)将整合位点两侧的上下游序列 (800~1 000 bp)、lox71-Spec-lox66盒、P43启动子和目的基因进行连接,将纯化后的融合PCR产物转化枯草芽孢杆菌感受态细胞,筛选阳性转化子。为了避免多重抗性标记的影响,在下一轮基因过表达之前,用Cre/lox系统将抗性标记消除,所用引物见表2。
1.2.2 GlcNAc摇瓶发酵 将新鲜转化的单菌落接种到装有5 mL LB培养基的50 mL离心管中,于37℃、220 r/min培养10 h;取种子液1 mL接种到装有25 mL发酵培养基的250 mL摇瓶中,于37℃、220 r/min培养48 h。
1.2.3 细胞密度的检测 通过测量600 nm处的光吸收值(OD600)来检测细胞密度。OD600值按公式1 OD600=0.35 g/L换算为细胞干质量(DCW)。
1.2.4 扫描电镜样品的制备 先用体积分数5%戊二醛(0.1 mol/L磷酸盐缓冲液,pH 7.2)进行预固定,再用0.1 mol/L磷酸盐缓冲液漂洗,最后用体积分数1%锇酸(0.1 mol/L磷酸盐缓冲液,pH 7.2)后固定。样品用0.1 mol/L磷酸盐缓冲液洗涤3次,分别经体积分数 20%、40%、60%、80%、100%、100%、100%、100%梯度乙醇洗脱后,样品在临界点(LEICA CPD-300)烘干,离子溅射(LEICA,ACE-600)镀膜后粘贴在样品台面上,置于冷场发射扫描电镜(HITACHI SU8220)中测试。
1.2.5 中间代谢产物的测定 将新鲜转化后的单菌落接种到装有5 mL LB培养基的50 mL离心管中,于 37℃、220 r/min培养 8~10 h,然后将 1 mL种子液接种到装有25 mL发酵培养基的250 mL摇瓶中,在 37 ℃和 220 r/min 下培养,并于 12、24、36、48 h分别取3 mL发酵液,于4℃离心机冷冻离心,弃上清液。然后加入 1.2 mL 萃取液(V乙腈∶V甲醇∶V水=4∶4∶2),于4℃下萃取过夜。10 000 g离心15 min后,取上清液冷冻干燥。向样品中加入100 μL超纯水,1 000 g离心15 min后取上清液测定细胞内代谢物浓度。采用液相色谱-质谱联用(LC-MS)检测代谢产物。
1.2.6 GlcNAc的测定方法 使用高效液相色谱法(HPLC)测定发酵液中GlcNAc质量浓度。HPLC检测条件如下:检测器为示差折光检测器;色谱柱为Bio-Rad Aminex HPX-87H;流动相为硫酸水溶液(5 mmol/L);流量 0.6 mL/min,温度 40 ℃,进样体积10 μL。样品处理条件:发酵液经10 000 g离心5 min,取上清液用超纯水稀释到一定倍数,再用0.22 μm滤膜过滤稀释液。
2 结果与分析
2.1 质膜改造重组菌的构建
目前,质膜改造策略主要集中在操纵一个或几个已知的能够影响质膜组分或合成的基因、调节因子和信号转导途径等方面[14],通过这些改造能够改变质膜功能[15-16]、质膜的生理特性[17-19]和质膜形态[20-21],达到提高底物利用率、改善细胞生长性能和提高代谢效率等目的。PtdOH是细胞质膜的重要组成成分,枯草芽孢杆菌PtdOH合成途径见图1(a)。PlsX、PlsY和PlsC是该途径的关键酶,构建plsX、plsY和plsC表达盒,见图1(b)。先后将上述3个重组片段转化到BSGN6-Y1菌株中,结合抗生素筛选和抗性标记消除,最终获得质膜改造菌株BSGN6-Y1M。
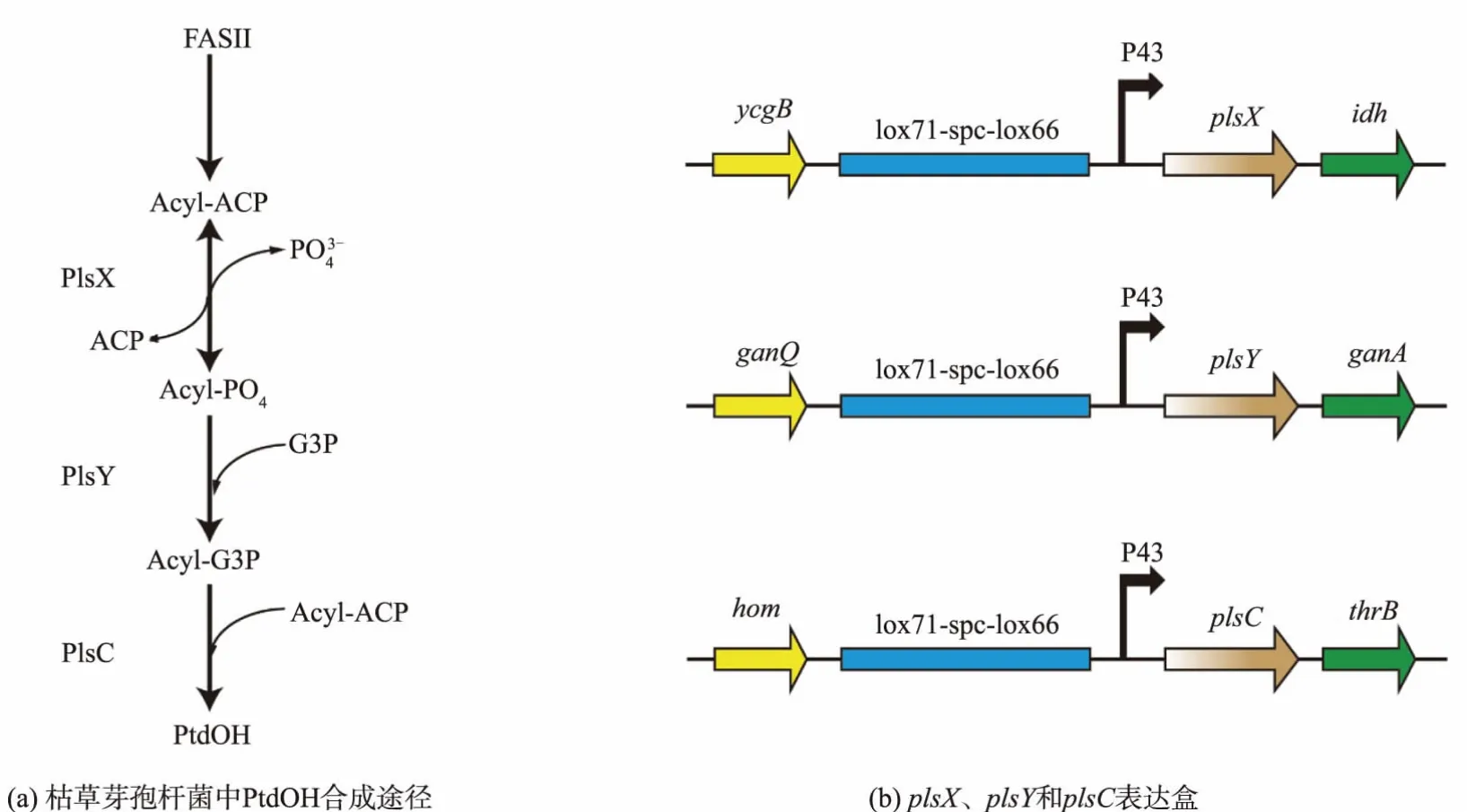
图1 过表达PtdOH合成基因Fig.1 Overexpression of PtdOH synthetic gene
2.2 质膜改造对菌株生长的影响
细胞质膜是将细胞质和细胞外环境分开的保护性屏障[22],它能够维持细胞内部环境的稳定,参与信号转导、蛋白质运输和能量代谢等[23-25]重要细胞过程,暗示了细胞质膜的不当修饰或改造可能不利于菌株生长,因此我们分析了质膜改造对菌株生长的影响。为了探究质膜改造对FMMs过度修饰菌株生长的影响,我们构建了pHT01-YISP质粒,并将其与pP43NMK-SPFH质粒分别共转化BSGN6-Y1和BSGN6-Y1M,得到BSGN6-Y1PS和BSGN6-Y1MPS,此外将pHT01和pP43NMK-SPFH质粒共转化BSGN6-YI,得到 BSGN6-Y1TS,见图 2(a)。 如图 2(b)所示,在菌株培养的前12 h,与对照菌株BSGN6-Y1TS相比,重组菌株BSGN6-Y1PS、BSGN6-Y1MPS的OD600没有明显变化,但是12 h后,BSGN6-Y1PS、BSGN6-Y1MPS 的 OD600明显低于BSGN6-Y1TS。进一步扫描电镜观察发现,BSGN6-Y1PS、BSGN6-Y1MPS的细胞形态发生了变化,首先细胞长度从BSGN6-Y1TS的(2.11±0.21)μm 增加 到 BSGN6-Y1PS 的 (3.29±0.33) μm 和BSGN6-Y1MPS 的 (2.58±0.28) μm,见图 2(c)。BSGN6-Y1PS菌株出现了明显的细胞弯曲现象,见图2(d),这一结果与我们前期发现的yisP高表达能够影响细胞生长或细胞形态相同[9]。然而BSGN6-Y1MPS菌株12 h后的OD600明显高于BSGN6-Y1PS,它的细胞长度低于BSGN6-Y1PS并且细胞没有发生明显的弯曲,这表明质膜改造能够有效降低yisP高表达对细胞生长或细胞形态产生的不利影响。
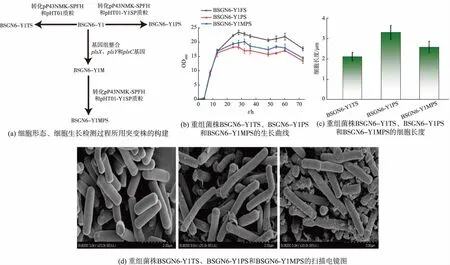
图2 质膜改造对菌株生长的影响Fig.2 Effects of plasma membrane modification on strain growth
2.3 质膜改造对中间代谢产物的影响
枯草芽孢杆菌以葡萄糖为碳源合成GlcNAc需要经由以下步骤:葡萄糖转化为葡萄糖-6-磷酸(G6P),再由磷酸葡萄糖异构酶(Pgi)和氨基葡萄糖-6-磷酸合成酶 (GlmS)催化合成6-磷酸果糖(F6P) 和氨基葡萄糖-6-磷酸 (GlcN6P)。 然后,GlcN6P被异源的氨基葡萄糖-6-磷酸乙酰转移酶(GNA1)转化为 N-乙酰氨基葡萄糖-6-磷酸(GlcNAc6P),其中 GNA1 是合成 GlcNAc的关键酶[26]。GlcNAc的最终合成需要去磷酸化,大肠杆菌YqaB可以催化GlcNAc6P的去磷酸化[27]。
途径酶的空间组装能够实现途径酶空间上的靠近,强化途径酶的协同催化作用,有利于中间代谢产物的加工进而提高产物的合成效率[5,7,9,28]。 为了探究质膜改造对G6P、F6P、GlcN6P和GlcNAc6P的影响,我们将前期构建的SPFH-yqaB融合基因整合到菌株BSGN6-Y1M中,获得BSGN6-Y1MY菌株;然后将pHT01质粒和pP43NMK-SPFH-GNA1质粒共转化前期构建的BSGN6-Y1SY,得到BSGN6-Y1SYTA;最后将pHT01-YISP和pP43NMK-SPFHGNA1质粒分别共转化 BSGN6-Y1SY、BSGN6-Y1MY,得到 BSGN6-Y1SYPA、BSGN6-Y1MYPA,见图3(a)。 图3(b)—(d)中,BSGN6-Y1MYPA 的中间代谢产物G6P、F6P、GlcN6P和GlcNAc6P的质量分数明显低于对照菌株BSGN6-Y1SYTA。上述结果表明,质膜改造能够促进多酶复合体对中间代谢产物的加工和利用,减少中间代谢产物向胞质内的扩散。
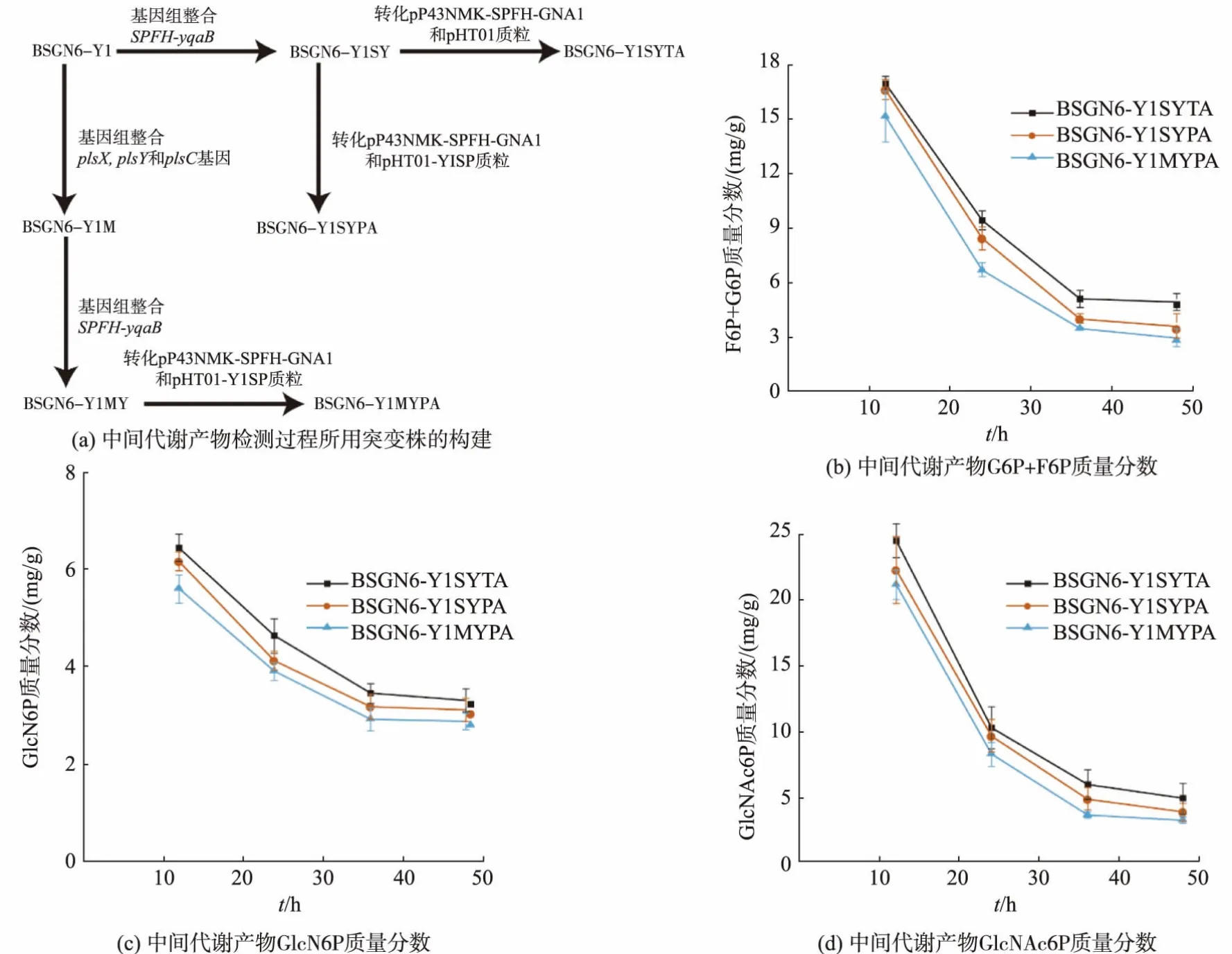
图3 质膜改造对中间代谢产物的影响Fig.3 Effects of plasma membrane modification on intermediate metabolites
2.4 质膜改造对GlcNAc产量的影响
上述研究显示,质膜改造有利于中间代谢产物的加工,但对菌株生长和GlcNAc合成能力的影响还不清楚。为了确定质膜改造对菌株产GlcNAc性能的影响,将BSGN6-Y1SYTA、BSGN6-Y1SYPA和BSGN6-Y1MYPA进行摇瓶发酵。如图4(a)所示,发酵48 h后,菌株BSGN6-Y1MYPA的GlcNAc产量为 (5.18±0.16)g/L,对照菌株BSGN6-Y1SYTA的GlcNAc 产量为(3.65±0.12) g/L,质膜改造后GlcNAc产量提升了41.9%;同时BSGN6-Y1MYPA的OD600低于对照菌株BSGN6-Y1SYTA,但是高于BSGN6-Y1SYPA,见图4(b)。上述结果表明,细胞质膜改造能降低yisP高表达对菌株生长产生的不利影响,并促进GlcNAc合成的代谢通量。
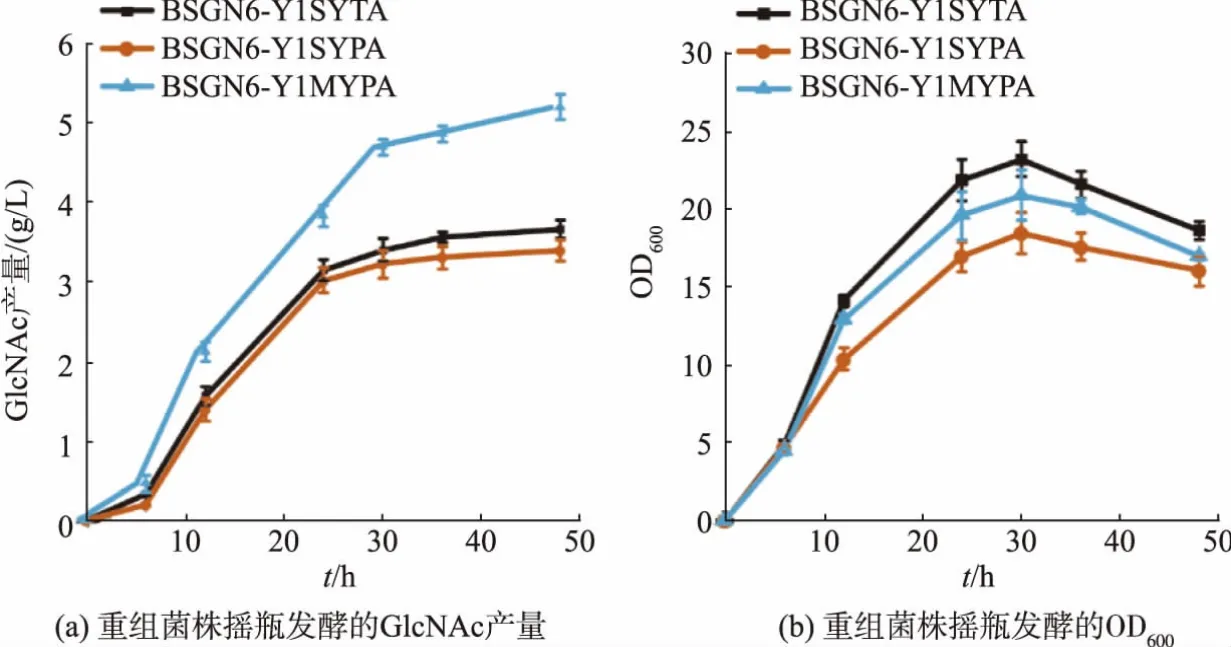
图4 质膜改造对菌株生长和菌株产GlcNAc能力的影响Fig.4 Effects of plasma membrane modification on strain growth and the ability to produce GlcNAc
3 结 语
研究了在枯草芽孢杆菌中过表达磷脂酸合成途径的关键基因,以维持质膜上FMMs和非FMMs的平衡。在此基础上,将GlcNAc合成所需的2个外源途径酶GNA1和YqaB通过SPFH结构域锚定于FMMs,发现细胞质膜改造不仅能够降低FMMs过度改造对菌株生长产生的不利影响,而且能够促进中间代谢产物的加工,导致G6P、F6P、GlcN6P和GlcNAc6P的质量分数明显低于对照菌株。基于上述结果,质膜改造后菌株的GlcNAc产量达到(5.18±0.16)g/L,与对照菌株相比提升了41.9%。作者在前期FMMs过度修饰菌株的基础上,首次通过质膜改造来维持FMMs和非FMMs平衡,为降低FMMs过度修饰对菌株生长和产物合成产生的不利影响提供了新思路。
