猪源产肠毒素大肠杆菌疫苗的研究进展
2021-11-11赵浩飞赵红徐永平李晓宇陈凯迪杨雪莹王丽丽
赵浩飞,赵红,徐永平,李晓宇,陈凯迪,杨雪莹,王丽丽
(大连理工大学生物工程学院,辽宁 大连 116024)
产肠毒素大肠杆菌(enterotoxigenicEscherichiacoli, ETEC)是一种能够感染人和动物的重要病原菌。ETEC可导致人类出现严重的腹泻问题,不仅能引起婴幼儿腹泻,还会造成旅行者腹泻[1]。仔猪、犊牛、羔羊等幼龄动物也是ETEC主要的致病对象[2], 给养殖业尤其是养猪业造成巨大的经济损失。一直以来,人们尝试了各种策略来控制和预防ETEC造成的腹泻,包括抗生素治疗[3],用特异性抗体进行治疗[4],对具有ETEC抗性的原种猪进行遗传育种得到抗ETEC的后代[5]和疫苗接种[6]。使用抗生素治疗可以缓解ETEC相关腹泻和其他临床症状。然而,抗生素滥用带来了更严重的问题,如细菌耐药性和药物残留;对妊娠母猪口服特定抗菌抗体可以在养殖过程中提供一定的保护,但代价昂贵且劳动量巨大。同时,遗传育种方法不仅很难确定具体的遗传靶点,也很难将其应用于筛选ETEC抗性或易感猪。疫苗接种是可以有效控制和预防ETEC引起的腹泻的理想方法。本文就ETEC的致病机理以及相关疫苗的研究进展进行综述。
1 ETEC主要致病因子
实际养殖过程中,ETEC 主要通过粪口途径传播,当仔猪吸食母乳时,母猪皮肤上的ETEC细菌可进入到仔猪肠道。同时,由于新生仔猪肠道黏膜免疫系统未发育健全,所以极易受到各类致病微生物的攻击。在造成仔猪腹泻的过程中,主要致病因子是黏附素和肠毒素。ETEC主要致病因子的理化性质如表1[7]。
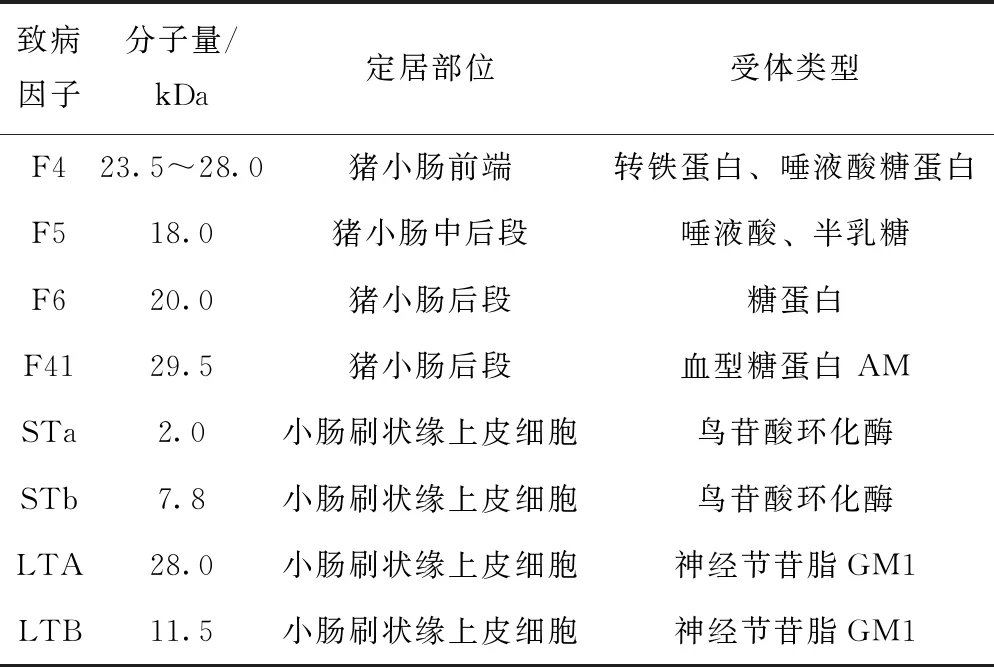
表1 猪源ETEC主要致病因子理化性质
菌毛是ETEC最主要的黏附素,近年来的研究显示猪源ETEC菌株常见的菌毛类型为F4、F5、F6、F18、F41,能介导ETEC定植于肠道并进行繁殖,然后产生肠毒素引起腹泻。肠毒素包括热稳定性肠毒素 (heat-stable enterotoxin, ST) 和热不稳定性肠毒素 (heat-labile enterotoxin, LT) 两类。热不稳定性肠毒素 LTA是由五聚体B亚单位和A亚单位组成[8]。LT在ETEC对宿主肠上皮细胞的黏附和定植方面有着促进作用,但机制尚未明确,新的研究发现,LTB亚基能与细菌外膜囊泡(OMVs)中的脂多糖(LPS)形成“OMVs-LT-GM1”桥梁,从而促进细菌黏附[9]。ST是分子量很小的单体毒素,根据其结构、功能和免疫原性不同分为STa和STb,对儿童和幼畜有较强的毒性。STa的毒性强,STb常出现在ETEC引起的仔猪腹泻的分离株中。另外,有研究发现STb在一定程度上会影响大肠杆菌的耐药性[10]。
ETEC主要依赖黏附素和肠毒素引起仔猪腹泻,ETEC首先在菌毛黏附素的介导下, 牢固地黏附于小肠表面,并大量繁殖,随后产生多种肠毒素,分别与肠上皮细胞的不同受体结合并作用于上皮细胞,导致肠道水和电解质失衡,无机盐离子大量流失,引起仔猪腹泻[11]。
2 猪ETEC疫苗的研究现状
2.1 全菌灭活疫苗
全菌灭活疫苗是指培养好的细菌未经过菌毛或肠毒素提取,直接进行全菌灭活制作的疫苗,这是目前实验中和商品化ETEC疫苗的主要制备方法, 如Elanco生产的商用疫苗由4种ETEC疫苗(F4、F5、F6和F41菌株)的混合物组成,Vencofarma开发的商用疫苗抗原包含灭活的F4、F5、F41和987P菌株[12],以及国内瑞普生物药业生产的猪痢安和上海海利生物技术生产的痢无忧等大肠杆菌灭活疫苗。这种疫苗制备方法成本低,简单易得,而且制备的全菌抗原针对性强,对动物的免疫效果明显。杨德鸿等[13]通过对苏北地区21个猪场采样调查,以其优势血清O8、O101为前提研制出二价灭活疫苗,并对感染小鼠进行免疫试验,以PBS为对照,结果显示,该二价灭活疫苗对小鼠的保护率在83%以上。刘泽文等[14]将ETEC培养后取其K88、K99和F6菌毛上清, 经灭活后与氢氧化铝佐剂、冻干保护剂混合制备成冻干疫苗,怀孕母猪经过2次免疫后, 使用同源ETEC对其后代仔猪口服攻毒, 结果表示, 该灭活疫苗对后代仔猪的保护率均在80%以上, 而对照组则全部发病。但全菌灭活疫苗也有一些局限性:ETEC血清型较多且毒力因子复杂,易发生突变[15],使得全菌灭活疫苗应用范围较窄,受地域和环境影响较大。另外,全菌灭活疫苗能发挥免疫效应的成分较少,不具有高效性。
2.2 基因工程疫苗
基因工程疫苗就是用分子生物学技术分析出病原体的主要抗原基因,将其转入原核或真核表达系统使其生产出相应的抗原,进而制备成疫苗;或者把毒力因子删除或突变,将其变为无毒性的基因缺失疫苗。菌毛和肠毒素是ETEC的主要毒力因子,应用基因重组技术,将菌毛或肠毒素基因定向插入到细菌细胞中,并使其充分表达,制成ETEC基因工程疫苗。基因工程疫苗很好的解决了ETEC多血清型且毒力因子复杂的问题;可制成多价疫苗,达到预防多种疾病的效果;免疫原性好,生产成本低,适合大规模生产,国内的中牧实业股份有限公司江西生物药厂生产的仔猪大肠杆菌腹泻K88-LTB双价基因工程疫苗和上海海利生物药品生产的(K88/K99)双价基因工程疫苗以及硕腾公司生产的利特佳®大肠杆菌病二联疫苗均已商品化生产使用,对保护动物免受ETEC感染有着较好的防护效果。
菌毛基因工程疫苗研究较为理想,Duan等[16]应用多表位融合抗原(mutiple-epitope fusion antigen,MEFA)技术构建了FaeG-FedF-FAc-FasA-FIM41a MEFA,使用主要菌毛K88和F18的黏附亚基作为骨架,还整合了菌毛K99、F6和F41的黏附亚基的表位,进行小鼠免疫和体外细菌黏附评估。经过MEFA蛋白皮下免疫的小鼠产生了针对五种菌毛的IgG抗体。此外,由MEFA蛋白诱导的抗菌毛抗体显著抑制K88+、F18+、K99+、F6+和F41+ETEC菌株对仔猪小肠IPEC-1和IPEC-J2细胞系的黏附。Matías等[17]从参与仔猪感染的主要ETEC菌株(F4和F18血清型)中获得的外膜囊泡(OMV)被包封在涂有Gantrez®AN-甘露糖胺缀合物的玉米醇溶蛋白纳米颗粒中,对小鼠和妊娠母猪进行口服免疫,结果表明相对于游离口服给药,纳米颗粒诱导IL-2、IL-4和 IFN-γ水平升高,而且后代哺乳仔猪在血清中呈现特异性IgG,证明这种新型口服亚单位疫苗具有良好的感染保护能力。
肠毒素基因工程疫苗也有较好的发展,Zhang等[18]将肠毒素STa、STb和LTB基因通过连接肽进行连接,构建重组SLS表达质粒,并导入E.coliBL21菌株中制备重组 SLS 抗原蛋白,同时提取纯化 K88、K99、F6、F41 菌毛抗原蛋白,制备成肠毒素-菌毛复合多价疫苗, 在母猪产仔前30和15 d分别免疫接种一次,发现免疫组后代仔猪无腹泻现象,对照组30%出现腹泻,说明候选疫苗对ETEC肠毒素或菌毛抗原起到了较好的免疫效果。Song等[19]构建了三价肠毒素蛋白STa-LTB-STb和F5菌毛的抗原融合蛋白(SLS-F5)以乳酸乳球菌为载体,制备了抗ETEC口服疫苗,对小鼠口服免疫后能诱导机体产生高水平黏膜SIgA和血清IgG抗体和多种细胞因子的产生。而且,口服免疫小鼠在ETEC攻击后产生了完全的保护。
2.3 弱毒疫苗
弱毒疫苗是指用人工致弱或自然筛选的弱毒株,经过培养后制备成病原致病力减弱但仍具有活力的完整病原疫苗。该疫苗可在免疫动物体内繁殖,用量小;免疫原性好,成本低。Coliprotec®F4[20]和二价F4/F18疫苗[21]是为免疫断奶仔猪腹泻而设计的弱毒疫苗。Harutyunyan等[22]基于一种减毒的志贺氏菌活菌株,通过异源表达两种ETEC抗原LTB和无毒的ST突变体STN12S构建了一种志贺氏菌和ETEC氏菌联合疫苗(ShigETEC),并在动物模型中诱导高滴度的抗细菌裂解物的免疫球蛋白和免疫球蛋白抗体,以及具有中和能力的抗ETEC毒素抗体。Nadeau等[21]将2株非致病性ETEC F4和F18制备为二价弱毒疫苗, 经一次口服免疫仔猪, 结果显示, 该二价弱毒疫苗能预防7~21 d由F4和F18 ETEC引起的仔猪腹泻, 另外免疫组仔猪F4和F18 ETEC菌株的定植明显减少, 同时能够在仔猪体内检测到F4或F18特异性IgM和IgA抗体。弱毒疫苗使用的弱毒株是活的生命体,易通过胃酸环境进入小肠并定植在肠上皮细胞,引发机体黏膜免疫,有着较好的免疫效果,但弱毒株的毒力在传代过程中有毒力返强的风险,存在一定的安全问题。
2.4 DNA疫苗
DNA疫苗又称核酸疫苗或基因疫苗,是指将含有编码蛋白抗原基因的重组真核表达载体直接注射到动物体内,使外源基因在活体内表达,产生的抗原激活机体的免疫系统,从而诱导机体产生免疫应答,产生特异性抗体。DNA疫苗使用一次能产生长期保护效果,疫苗的免疫原性好,一种DNA疫苗就能诱导多个抗原表位的免疫保护作用,具有较好的灵活性,便于生产且成本低。Melkebeek等[23]将编码ETEC F4ac菌毛faeG基因的重组质粒和编码不耐热性肠毒素LT基因的重组质粒分别以500 μg皮内注射和250 μg肌内注射到5周龄的仔猪, 21 d后加强免疫1次, 测定仔猪血清FaeG特异性抗体, 显示IgG能长时间持续较高水平,而IgA和IgM抗体水平非常低。Lu等[24]通过使用缺乏肠毒性但保留免疫原性的抗原决定簇替代LT类毒素作为呈现两个ETEC菌毛和四种毒素的中和抗原决定簇的骨架,我们生成了菌毛毒素MEFA并对小鼠进行皮下免疫,免疫的小鼠对K88、F18、LT和STb产生了强烈的IgG反应,对毒素Stx2e和STa产生了中和反应。另外,MEFA诱导的抗体抑制了K88或F18细菌对猪肠道细胞的黏附,并中和了LT、STa、STb和Stx2e毒素的毒性,证明了该疫苗的具有一定的应用潜力。但是DNA疫苗有一定的局限性,编码抗原的基因可能会整合到宿主基因上,安全性较低,在机体中长期存在还可能引起免疫耐受现象,这也是DNA疫苗研究待解决的问题。
3 展望
ETEC引起的仔猪腹泻给全球的养猪业造成了巨大的经济损失,抗生素的广泛使用带来了严重的安全问题,因此接种疫苗成为预防仔猪腹泻的重要手段。尽管对ETEC疫苗的研究取得了很大的进展,但这疫苗的局限性也很明显。ETEC的菌毛抗原种类较多,而且地域分布差异较大,使得研制安全有效的疫苗变得更加困难。目前许多ETEC疫苗大部分只包括了部分菌毛黏附素和肠毒素,对动物的免疫效果不够全面,缺乏广谱性,以期通过对免疫方式、抗原类型及疫苗形式的优化,更好地诱发机体全身和黏膜免疫反应。基因工程技术的应用不仅能增强疫苗免疫的效果及安全性,通过对多种抗原的融合还增加了疫苗防护的广谱性,具有较好的研究前景,这对于ETEC感染的预防具有十分重要的意义。
