氧化还原反应的考查视角和复习策略探讨
2021-11-10福建洪兹田新疆张新芹
福建 洪兹田 新疆 张新芹
氧化还原反应是高中化学的重难点和高考考查的热点。无论是全国卷高考还是各省新高考命题,涉及氧化还原反应的概念、规律及应用、方程式书写、定量分析总是备受青睐。考查形式以选择题和非选择题的形式出现。选择题主要以社会热点、新科技成果及传统文化为载体考查氧化还原反应概念、氧化还原反应规律及应用和相关计算等。非选择题主要结合生产流程、实验探究、电解原理应用等考查氧化还原方程式书写、配平。现对氧化还原反应的考查视角进行梳理,通过思维建模、解题技法、典例剖析、变式训练等策略助力师生提升氧化还原反应专题的复习效率。
一、氧化还原反应的概念、规律及应用
对氧化还原反应的概念、规律及应用的考查常涉及氧化还原反应的概念、规律及应用和定量分析。氧化还原反应概念的考查主要包括氧化剂和还原剂,氧化产物和还原产物,氧化剂与还原剂的物质的量的关系,被氧化、被还原,氧化反应、还原反应等的判定;氧化还原反应规律及应用主要包括强弱律,如判断氧化性、还原性强弱;价态律,如同种元素不同价态的反应规律;如反应的先后顺序,如得失电子数目的计算和氧化还原反应配平;氧化还原反应相关计算,如电子转移数目的判断、氧化剂与还原剂的物质的量的关系等;电极方程式配平及电化学计算等。
1.思维建模

图1 氧化还原反应概念关系梳理
2.解题技法
氧化还原反应概念、规律及应用在高考题中通常是以选择题或非选择题的形式进行考查。解答此类题的关键是掌握“三部曲”:
(1)依据题意分析概念。找出氧化剂、还原剂和氧化产物、还原产物。
(2)依据规律判断反应的合理性。氧化还原反应遵循四大定律,强弱律、价态律、先后律、守恒律等,见图2。
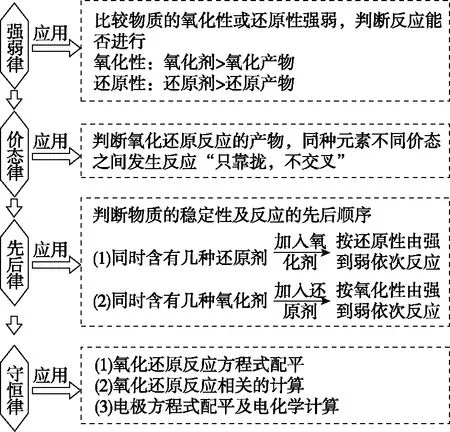
图2 氧化还原反应的规律及应用
(3)依据电子守恒进行定量计算。利用得失电子守恒即可列式计算。对于多步反应,可找出起始物与最终产物,删去中间产物,利用原子守恒和得失电子守恒,建立已知量与未知量之间的关系,快速解题。
3.典例剖析

( )
A.K2H3IO6发生氧化反应
B.KI是还原产物
C.生成12.7 g I2时,转移0.1 mol电子
D.还原剂与氧化剂的物质的量之比为7∶1
【答案】D
【解析】上述反应中I元素化合价降低,得电子,发生还原反应,故A错误;“HI→KI”的过程中I元素化合价未发生变化,故KI既非氧化产物也非还原产物,故B错误;由方程式可得,每生成4 mol I2转移7 mol电子。根据n(I2)=0.05 mol,可计算出生成0.05 mol I2时转移的电子n(e-)=0.087 5 mol,故C错误;反应中每消耗1 mol K2H3IO6(氧化剂)就有7 mol HI(还原剂)失电子,则n(还原剂)∶n(氧化剂)=7∶1,故D正确。
4.变式训练

( )
A.产生22.4 L(标准状况)Cl2时,反应中转移10 mol e-
B.反应中氧化剂和还原剂的物质的量之比为11∶6
C.可用石灰乳吸收反应产生的Cl2制备漂白粉
【答案】A
二、氧化还原反应方程式的书写
应用氧化还原反应规律书写化学方程式主要包括两类:一是教材中已学习过的氧化还原反应方程式的书写,二是新情境下陌生氧化还原反应方程式的书写。后者常出现在化工实际生产过程的工艺流程图、实验探究题中的检测除杂步骤、电化学原理应用等考查中。呈现形式以非选择题为主,要求书写化学方程式或离子反应方程式,多数伴以新情境下陌生氧化还原反应方程式书写。这类题信息量较大,信息内容呈现多样化,灵活度较高,对考生阅读能力,提取信息、分析问题、解决问题的能力有较高要求,能较好体现对学生核心素养的考查。篇幅所限,关于电极方程式配平及电化学计算将在电化学专题体现。
(一)教材中已学习过的氧化还原反应方程式的书写
1.思维建模

图3 教材中已知或相似的氧化还原反应方程式的书写
2.解题技法
重视教材中熟悉的氧化还原反应的方程式,以此为原型,结合参与反应的物质替换,对所熟悉的氧化还原反应“原型”进行类比迁移,进而完成方程式的书写。建议熟练记忆常见的氧化剂、还原剂及其对应的还原产物和氧化产物。

表1 常见的氧化剂、还原剂及其对应的还原产物和氧化产物
3.典例剖析
【例3】(2021·全国乙卷·27节选)(4)步骤Ⅲ中,H2O2的作用是_______________(以离子方程式表示)(注:滴加H2O2至悬浊液由紫色变为土黄色)。

【解析】本题在实验探究题中的除杂步骤中穿插考查教材中较为熟悉的氧化还原反应。由加H2O2后出现的宏观现象推测微观本质是H2O2与KMnO4发生反应,即H2O2的作用是除去过量的KMnO4。反应过程中,KMnO4为强氧化剂,H2O2作还原剂,反应的介质条件为酸性。据此可用离子方程式进行符号表征。
4.变式训练
【例4】(2015·全国卷Ⅰ·27,改编)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2。该反应的离子方程式为_______________。


(二)新情境下陌生氧化还原反应方程式的书写
1.思维建模
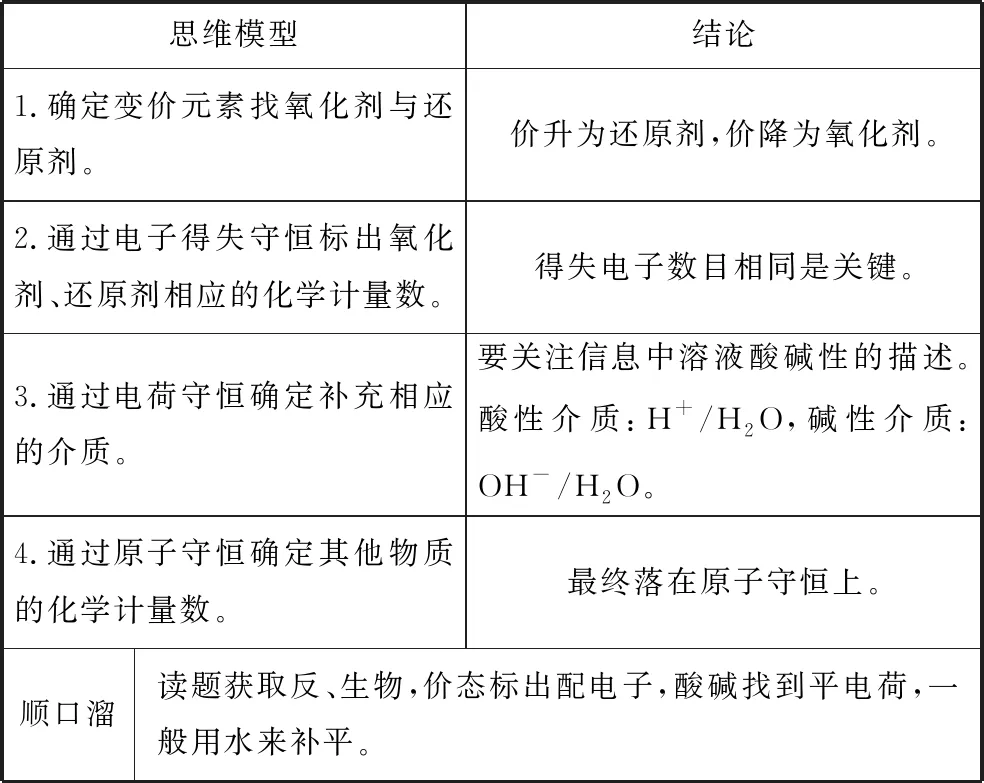
表2 陌生氧化还原反应方程式的书写
2.解题技法
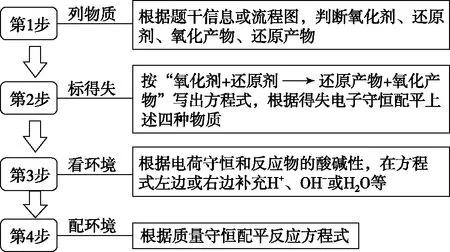
图4 “四步法”突破新情境下氧化还原方程式的书写
3.典例剖析
【例5】(2021·湖南省普通高中学业水平选择性考试·17 节选)(6)滤渣Ⅱ的主要成分为FePO4,在高温条件下,Li2CO3、葡萄糖(C6H12O6)和FePO4可制备电极材料LiFePO4,同时生成CO和H2O,该反应的化学方程式为______________________________。
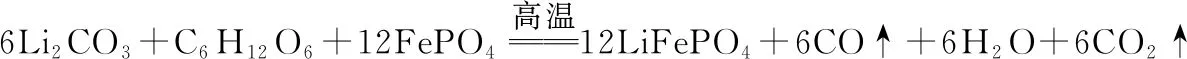
【解析】本题以工艺流程题为背景考查根据信息书写陌生氧化还原反应的方程式并配平。题干信息给出了反应条件、全部反应物和部分生成物,需结合得失电子守恒、原子守恒进行缺项配平部分产物,最终完成新情境下的陌生氧化还原反应方程式。

表3 “四步法”书写该氧化还原反应方程式
三、氧化还原反应的考查趋势预测与展望
氧化还原反应作为高中化学教学中的一个重要基本概念和基本理论,决定了其无论是全国卷高考还是新高考都将备受青睐。作为高频率考点,试题的考查形式仍将以选择题和非选择题为主。选择题预计将聚焦氧化还原反应的概念辨析、氧化还原反应的规律及应用和定量分析(如转移电子数目、相关物质的量之比等)等。非选择题预计将聚焦新情境下陌生氧化还原的方程式的书写(含配平)。同时,有关反应的先后顺序,以及部分反应物少量、过量引起所发生反应的不同(即“量变”引起“反应发生变化”)的题型(见2021·全国甲卷·26),虽整体难度稍高,但不失为考查了学生的“宏微结合”“变化观念”等素养的典范,也应引起重点关注。

