氧化还原反应知识关联结构化模型的构建与相关知识网络的梳理
2021-11-10福建王书红
福建 王书红
氧化还原反应与路易斯酸碱反应、自由基反应并称为化学中的三大基本反应,是高考中必考考点之一。《普通高中化学课程标准(2017年版2020年修订)》(以下简称《课程标准》)对氧化还原反应的要求是“认识有化合价变化的反应是氧化还原反应,了解氧化还原反应的本质是电子的转移,知道常见的氧化剂和还原剂。”近年来关于氧化还原反应的命题也紧扣《课程标准》,以真实的问题情境为载体,考查氧化还原反应的概念、氧化还原反应的强弱规律及计算、氧化还原反应方程式的书写及配平并同时注重将氧化还原反应的学科内容与国家经济、社会发展、科学进步、生产生活实际等紧密联系起来,考查学生综合应用学科内知识分析和解决真实问题的能力,引导学生关注社会进步和科学发展。
一、建构氧化还原反应知识关联结构化模型,促进知识向能力素养的转化
美国著名教育心理学家、认知心理学家布鲁纳曾说:“人类记忆的首要问题不是存储而是检索,而检索的关键在于组织结构。如果知识在头脑中无条理地堆积,不但检索提取存在困难,而且很快会被遗忘。”《课程标准》要求通过实验的事实来了解氧化还原的本质,这就要求在复习中必须设计合理的实验,利用实验现象,促使学生深入思考宏观实验现象背后隐藏的微观粒子变化的实质,建构氧化还原反应基本概念的知识结构模型。
1.借助实验,引领学生建立认识化学反应的新视角

铜丝在空气中加热

用氢气还原氧化铜

将铁丝插入CuSO4溶液中

向CuSO4溶液中滴加NaOH溶液
【深度思考1】
①在这些反应中,铜元素发生了哪些变化?
②前三个反应与最后一个反应的特征有什么不同,这三个反应的本质是怎样的?
③含铜元素的物质在这些反应中表现出什么性质?
学生通过做实验并解决深度思考1中的三个问题,分析上述实验中铜元素存在形态的变化,建立了可以从有无元素化合价变化的角度来认识化学反应的观念,也学会了判断氧化还原反应的方法,即有元素化合价变化的反应就是氧化还原反应,引领学生可以从元素化合价的角度认识化学反应,分析和解决氧化还原反应的实际问题。
2.借助实验,引导学生综合利用学科知识,拓宽解决问题的思路和方法
【深度思考2】
①写出铁与CuSO4溶液反应的化学方程式并判断该反应是否属于氧化还原反应。
②利用图2所示实验装置进行铁与CuSO4溶液反应的实验,实验现象之一是电流表指针发生偏转。这一实验现象对你认识铁与CuSO4溶液反应的实质有什么启发?

图2 探究氧化还原反应的实质
问题2中通过电流表指针发生偏转这一实验事实,判断电路中有电流产生,进而得出电路中有电子定向移动的结论。这种通过实验的方式揭示了氧化还原反应的本质是有电子转移的方法,相比教师课堂直接给出结论的方法,实验得出结论的方式学生更容易理解和接受。授人以鱼不如授人以渔,学生既得出了氧化还原反应的实质是有电子转移的结论又学会了综合利用学科知识解决化学问题的思路和方法。
3.建构氧化还原反应知识关联结构化模型,梳理知识网络
借助实验建立了认识化学反应的新视角并综合利用学科知识,拓宽了判断氧化还原反应实质的思路和方法,最后结合高考题梳理出氧化还原反应常考知识关联结构化模型如图3所示,在常考考点中需要应用的基本概念原理模型图如图4所示。借助氧化还原反应知识结构化模型,梳理知识网络,帮助学生把零散的知识结构化,形成系统化和类别化的学科知识经验,达到知识结构化和功能化的目的。
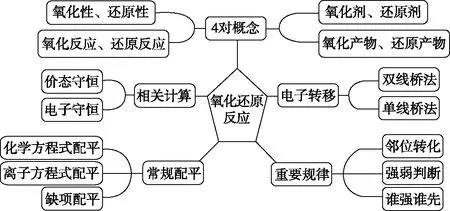
图3 氧化还原反应高考常考知识关联结构化模型

图4 氧化还原反应基本概念关系模型
二、应用结构化模型,分板块快速突破氧化还原反应在高考中的常见考点
1.氧化还原反应在客观题中的主要呈现方式及其突破策略
随着课程改革的推进,化学在高考中成为选考独立考查科目,和理综时相比题目数量增加,通过分析新课标试卷和新高考地区的试卷不难发现,氧化还原反应基本概念的理解及应用的试题又重新回归。以2021年新高考省份化学高考真题为例来分析,在选择题中氧化还原反应重在考查根据题目给定信息,理解信息并依据氧化还原反应的原理会做判断并进行必要的计算。具体考查内容主要体现在以下四个方面:
1.1 考查氧化还原反应的基本概念及转移电子的计算

( )
A.K2H3IO6发生氧化反应
B.KI是还原产物
C.生成12.7 g I2时,转移0.1 mol电子
D.还原剂与氧化剂的物质的量之比为7∶1
【答案】D
【解析】
A.反应中I元素的化合价降低,发生得电子的反应,发生还原反应,A错误;
B.KI中的I-由HI变化而来,化合价没有发生变化,KI既不是氧化产物也不是还原产物,B错误;
C.12.7 g I2的物质的量为0.05 mol,根据反应方程式,每生成4 mol I2转移7 mol电子,则生成0.05 mol I2时转移电子的物质的量为0.0875 mol,C错误;
D.反应中HI为还原剂,K2H3IO6为氧化剂,在反应中每消耗1 mol K2H3IO6就有7 mol HI失电子,则还原剂与氧化剂的物质的量的比为7∶1,D正确;故答案选D。
【突破策略】解决氧化还原反应知识关联结构化模型中四对基本概念涉及问题最好的方法是紧扣氧化还原反应的特征和实质,解决模型为:写方程式→标注有变价的元素的化合价→依据“升还降氧”(元素化合价升高做还原剂,元素化合价降低做氧化剂)在反应物中找出氧化剂、还原剂并标注,然后依据“氧化剂被还原,还原剂被氧化”的规则,在生成物中找出氧化产物和还原产物并标注。
1.2 与离子反应综合,考查氧化还原方程式的书写
【例2】(2021·全国乙卷·9)下列过程中的化学反应,相应的离子方程式正确的是
( )

【答案】A
【解析】



【突破策略】氧化还原反应离子方程式的解决基本模型为:
第一步:首先观察反应是否符合实际情况(能否反应、反应后生成物形式是否正确、反应顺序及量比正确)。
第二步:接着判断反应物、生成物拆分是否正确。
第三步:考虑是否满足三大守恒(电荷守恒、质量守恒和得失电子守恒)。若以上三步均满足则该离子方程式书写正确。
1.3 与电化学综合,考查氧化还原反应原理的应用
【例3】(2021·全国乙卷·12)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率,为解决这一问题,通常在管道口设置一对惰性电极(如图5所示),通入一定的电流。下列叙述错误的是
( )

图5
A.阳极发生将海水中的Cl-氧化生成Cl2的反应
B.管道中可以生成氧化灭杀附着生物的NaClO
C.阴极生成的H2应及时通风稀释安全地排入大气
D.阳极表面形成的Mg(OH)2等积垢需要定期清理
【答案】D
【解析】
A.根据分析可知,阳极区海水中的Cl-会优先失去电子生成Cl2,发生氧化反应,A正确;
B.设置的装置为电解池原理,根据分析知,阳极区生成的Cl2与阴极区生成的OH-在管道中会发生反应生成NaCl、NaClO和H2O,其中NaClO具有强氧化性,可氧化灭杀附着的生物,B正确;
C.因为H2是易燃性气体,所以阳极区生成的H2需及时通风稀释,安全地排入大气,以排除安全隐患,C正确;

【突破策略】氧化还原反应与电化学综合是高考必考考点之一,解决此类问题的模型为:
第一步:根据题目信息,首先判断电化学装置是原电池还是电解池。
第二步:接着判断发生氧化反应的电极和还原反应的电极。
第三步:若为原电池发生氧化的电极是负极,若为电解池发生氧化反应的电极是阳极。
第四步:根据电极名称判断电极反应的正误以及离子移动方向。
1.4 结合元素化合物综合考查氧化还原反应在生活、生产中的应用
【例4】(2020·北京市普通高中学业水平等级性考试·2)下列物质的应用中,利用了氧化还原反应的是
( )
A.用石灰乳脱除烟气中的SO2
B.用明矾[KAl(SO4)2·12H2O]处理污水
C.用盐酸去除铁锈(主要成分Fe2O3·xH2O)
D.用“84”消毒液(有效成分NaClO)杀灭细菌
【答案】D
【解析】
A.SO2是酸性氧化物,可与碱反应,用石灰乳脱除烟气中的SO2时,SO2与氢氧化钙反应生成亚硫酸钙或亚硫酸氢钙,反应过程中无元素的化合价变化,没有利用氧化还原反应,故A不符合题意;
B.用明矾[KAl(SO4)2·12H2O]溶于水中,电离出的铝离子发生水解生成氢氧化铝胶体,利用胶体的吸附性可吸附污水中的固体颗粒物,该过程利用胶体的吸附性,发生的反应没有发生化合价变化,没有利用氧化还原反应,故B不符合题意;

D.用“84”消毒液有效成分NaClO,具有强氧化性,能使蛋白质发生变性从而杀死细菌病毒,杀菌消毒的过程利用了氧化还原反应,故D符合题意。
【突破策略】解决氧化还原反应实际应用问题,首先能根据所给信息准确判断出发生的主要反应,不要求完整的书写方程式;其次根据主要反应物和生成物中的中心元素判断出是否发生化合价变化,最后给出结论即可。此类问题综合性较强,涉及元素化合物知识较多,需要有扎实的基本功。
2.氧化还原反应在主观题中的主要呈现方式及其突破策略
氧化还原反应在主观题中的考查主要渗透在流程题、实验题和化学反应原理综合试题中,它不仅要求学生能依据题目所给信息判断能否发生氧化还原反应而且要求学生能够快速、准确的写出氧化还原反应的离子、化学方程式或者电极反应方程式,计算转移电子数、氧化剂和还原剂(或者氧化产物和还原产物)对应的量比关系,最难的当属在氧化还原滴定中要先判断反应的顺序,再结合滴定操作计算产品产率或者样品纯度。
【例5】(2021·全国甲卷·26节选)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)I2的一种制备方法如图6所示:

图6
①加入Fe粉进行转化反应的离子方程式为________________________________。
②通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为__________________________;若反应物用量比n(Cl2)/n(FeI2)=1.5时,氧化产物为______________;当n(Cl2)/n(FeI2)>1.5后,单质碘的收率会降低,原因是_________________。
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总反应的离子方程式为_________________。




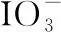
【突破策略】在流程中考查氧化还原反应的关键点是抓准两条线即物质转化线和操作线,关注非氢非氧元素在转化过程中的物质变化和化合价变化。第一步先找出氧化剂、还原剂、氧化产物、还原产物;第二步,标化合价利用化合价升降法配平有元素化合价变化的物质的系数;第三步根据溶液的酸碱性补充H+或者OH-完成电荷守恒;最后根据质量守恒判断是否需要补充水分子,该方法同样适合电极方程式的书写。电子就转移的计算方法和处理客观题相同。根据配平好的方程式可以快速找出氧化剂、还原剂之间的关系。
【例6】(2020·江苏卷·18节选)次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂。NaClO 可用于制备二氯异氰尿酸钠。
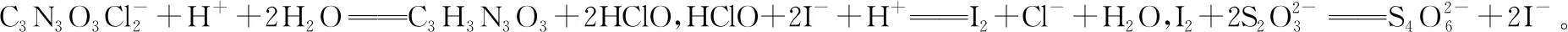

②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值________(填“偏高”或“偏低”)。

根据物质转换和电子得失守恒关系:
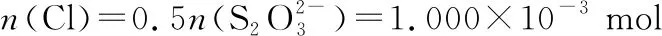
氯元素的质量:
m(Cl)=1.000×10-3mol×35.5 g·mol-1=0.035 50 g
该样品的有效氯为:
该样品的有效氯大于60%,故该样品为优质品 偏低
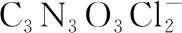
【突破策略】氧化还原反应渗透在实验题中,以氧化还原反应滴定的方式呈现,此类问题比较综合且涉及计算,对绝大多数学生而言是化学中最难的。突破此类问题首先需要理解滴定实验的基本操作;其次写出滴定过程中的物质转化线;最后也是最关键的是找标液和待测液之间的关系并计算。若是直接关系,利用化合价升降法直接找关系式即可;若因为存在连续反应是间接关系的依然是先找准关系式等量代换即可。

