外源NO对铝胁迫下紫花苜蓿幼苗生长的影响
2021-11-08张燕彭凯悦马向丽王辉另如贵任健
张燕 彭凯悦 马向丽 王辉 另如贵 任健

摘 要:利用水培法研究外源NO对铝胁迫(0.1 mmol/L)下生长的紫花苜蓿(WL525HQ)幼苗形态、生理特征的影响,揭示NO缓解紫花苜蓿铝毒的生理机制。结果表明:铝胁迫抑制了幼苗的生长,表现为株高、根长、叶面积、地上和地下部生物量显著降低。另一方面,降低了叶片中脯氨酸含量和超氧化物歧化酶活性,提高了根系脯氨酸含量(P<0.05)。施用外源NO后,紫花苜蓿在形态和生理方面对铝胁迫的响应发生了一些改变,且改变与NO的浓度有关。其中,低浓度NO缓解了铝胁迫对苜蓿幼苗主根伸长的抑制作用;中浓度NO则解除了铝胁迫对株高、根系表面积和体积的抑制作用,提高了地上和地下部生物量;高浓度NO显著地提高了苜蓿地上部和地下部脯氨酸含量和SOD活性。综上所述,外源NO能通过积累脯氨酸、增加SOD活性等方式,缓解铝胁迫对紫花苜蓿幼苗生长的抑制作用,促进地上部和地下部的物质积累。
关键词:紫花苜蓿;脯氨酸;硝普钠;超氧歧化酶
中图分类号:S541 文献标识码:A
Impacts of Exogenous Nitric Oxide on Growth of Alfalfa Seedlings Exposed to Aluminum Stress
ZHANG Yan1, PENG Kaiyue1,2*, MA Xiangli1, WANG Hui1, LING Rugui1, REN Jian*
1. College of Animal Science and Technology, Yunnan Agricultural University, Kunming, Yunnan 650201, China; 2. Gucheng Animal Husbandry and Veterinary Center Station, Wuxiang, Shanxi 046302, China
Abstract: The effects of exogenous nitric oxide (NO) application on the morphological and physiological characteristics of alfalfa (WL525HQ) seedlings under aluminum stress (0.1 mmol/L) were studied through hydroponics to reveal the physiological mechanism of NO alleviating aluminum toxicity of alfalfa. The results indicated that aluminum stress inhibited the growth of alfalfa seedlings shown by the significant decrease in plant height, root length, leaf area, aboveground and belowground biomass. Free proline content and superoxide dismutase (SOD) activity in the leaves were significantly reduced, whereas proline in the roots was significantly increased (P<0.05). Exogenous NO application affected its morphological and physiological responses to aluminum stress, and it was related to the concentration applied. Low concentration of exogenous NO alleviated the inhibiting effect of aluminum stress on the main root length. Medium concentration increased plant height, surface area and volume of root system under aluminum stress, which led to increases of above and below ground biomass. High concentration significantly increased free proline and SOD activity. In summary, exogenous NO alleviates the inhibitory effect of aluminum stress on the growth of alfalfa seedlings through processes like free proline accumulation and SOD, hence, contribute to enhancement of above and below ground biomass.
Keywords: Medicago sativa; free proline; sodium nitroprusside (SNP); superoxide dismutase (SOD)
DOI: 10.3969/j.issn.1000-2561.2021.09.024
鋁元素广泛分布在土壤之中,当土壤呈碱性时,铝元素主要以Al(OH)4?形式存在;当土壤呈中性时,以难溶的Al(OH)3形态存在;当土壤酸化后,以Al(H2O)63+形式存在,这时易溶于土壤中[1]。适量的铝对植物的生长具有一定的促进作用,如低浓度的铝处理(1 mmol/L和10 mmol/L)可以提高大豆的发芽率、鲜重、发芽指数和活力指数,降低电导率,增强抵抗逆境的能力[2]。但毫摩尔水平的Al3+对某些植物产生毒害作用,酸性土壤溶液中A13+浓度约为0.01~0.10 mmol/L,会导致某些植物根系和地上部分的茎和叶片生长受阻甚至停止,降低植物吸收水分和营养的能力,最终抑制植物生长,导致产量降低[3]。我国南方酸性红壤分布广泛,铝毒害已经是南方酸性土壤地区农作物生长发育的主要限制因素之一,引起了人们的广泛关注。目前,有关铝对植物的毒害研究,主要集中在小麦、大豆、白苦瓜等农作物[4-6],而牧草方面研究较少。
紫花苜蓿(Medicago sativa)是优质的多年生豆科(Leguminosae)牧草,在我国广泛种植,因其适口性好、抗逆性强、产量高,营养成分丰富等特点,被誉为“牧草之王”。当土壤中Al3+浓度高于0.10 mmol/L时,作为超敏感植物的紫花苜蓿种子发芽率降低,幼苗生长缓慢,水分和营养的吸收降低,使其生长受到一定程度的抑制,最终导致生物产量与种子产量的减少[7]。在铝毒胁迫下天蓝苜蓿(Medicago lupulina )根瘤菌的SOD酶活性一定程度减小后缓慢上升,而CAT、POD和GR酶活性随铝浓度增大显著下降[8]。当土壤pH为6.1~6.5时,紫花苜蓿生长开始受限制,根瘤菌的繁殖率和存活率下降;当土壤pH低于6.0时,紫花苜蓿生长受严重抑制[9]。
在我国南方草地农业生产中,多采用撒施石灰对酸性土壤进行改良,虽效果好,但成本大,改良面积有限,仅对土壤表层进行改良,土壤深处仍呈酸性,且长期使用石灰会导致土壤板结,有必要进一步开展减轻铝毒的机理研究。NO作为生物体内调节植物生长发育的重要信号分子,具有抗氧化、阻断脂质过氧化反应、保护植株免受超氧化损伤、增强细胞中抗氧化酶活性,缓解镉、铜等金属对植物的毒害、对植物种子萌发和幼苗生长起调控作用[10-11]。硝普钠(sodium nitroprusside, SNP)作为外源NO,可诱导植物根尖积累ABA,且活性氧可以加强其作用效果。研究发现,SNP可以减轻盐胁迫对植物叶片的氧化损伤[12],增强植物耐盐性[13],延缓镉毒害下水稻叶片叶绿素和蛋白的下降,降低镉含量[14]。因此,探索不同浓度SNP对酸铝条件下紫花苜蓿幼苗生长状况和内在因素及其作用机理的影响,对缓解紫花苜蓿的铝毒具有重要的意义。
1 材料与方法
1.1 材料
试验材料选用云南引进的紫花苜蓿品种‘WL525HQ,该品种抗逆性强,在产量、营养成分含量和生长特性等方面都有上好的表现。
1.2 方法
1.2.1 试验设计 选取大小、形状、色泽一致且饱满的种子,用0.1% HgCl溶液消毒15 min后冲洗干净,移栽到含有蛭石的育苗盆中,放入人工气候箱中培育,每3 d浇1次蒸馏水。人工气候箱白天温度为(25±1)℃,夜晚温度为(20±1)℃,每天光照12 h,黑暗12 h,光强为4000 lx,湿度为70%。待种子发芽后,每3 d补充1次Hoagland营养液,待紫花苜蓿幼苗高度生长到10 cm左右开始胁迫处理。
试验共有5个处理,即(1)对照(CK):0 mmol/L Al+0 mmol/L SNP;(2)Al胁迫处理(Al):0.1 mmol/L Al(pH=4.5)+0 mmol/L SNP;(3)高浓度SNP处理(H):0.1 mmol/L Al+ 0.5 mmol/L SNP;(4)中浓度SNP处理(M):0.1 mmol/L Al+0.2 mmol/L SNP;(5)低浓度SNP处理(L):0.1 mmol/L Al+0.05 mmol/L SNP,每个处理重复3次。每3 d浇灌1次,每次浇灌以根系全部浸没为原则。处理1个月后,分别测定地上部分和地下部分的形态指标及生理生化指标。
1.2.2 测定指标与方法 形态指标:将植株整株洗净后,用直尺测定株高和根长,然后将根、茎、叶分离,置于105 ℃烘箱杀青15 min后65 ℃烘干置恒重,测定干重。用纸样称重法测定叶面积。叶含水量=(叶片鲜重–叶片干重)/叶片鲜重×100%。
根系分析:采用WinRHIZO根系分析系统扫描仪测定根系总根长、根系的总表面积、根系的平均直径、根系的总体积等。
常规生理指标:叶绿素含量测定参考Inskeep等[15]的方法;超氧化物歧化酶(SOD)活性的测定参照孙群等[16]的方法;丙二醛(MDA)含量采用硫代巴比妥酸法测定[17]。游离脯氨酸含量的测定采用茚三酮法[17]。
1.3 數据处理
采用SPSS 19.0软件对数据进行单因素方差分析(One-way ANOVA)。使用Microsoft Office Excel 2003软件和OriginPro 2017软件制作相关图表。
2 结果与分析
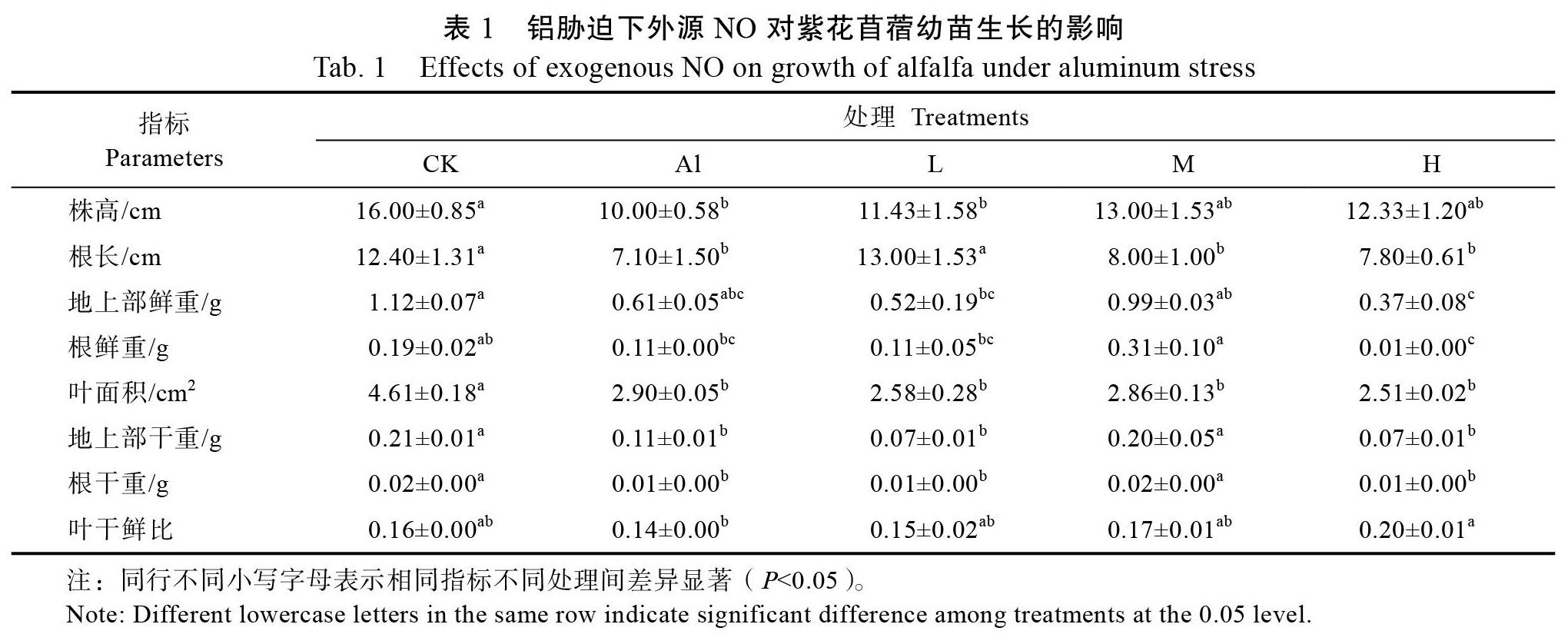
2.1 对紫花苜蓿幼苗生长的影响
与CK相比,Al胁迫显著抑制了紫花苜蓿地上部分和地下部分的生长,表现为株高、根长、叶面积、地上部干重和根干重均明显下降(P< 0.05)(表1)。在外源NO的作用下,铝胁迫对紫花苜蓿幼苗地上部和地下部的抑制作用发生了一些改变。施加中、高浓度NO后,株高较Al胁迫分别增加了30.0%、23.3%,尤其是中浓度的NO对缓解铝胁迫对紫花苜蓿幼苗株高的抑制作用最明显。就根长而言,低浓度的NO处理显著减轻了铝胁迫的抑制作用(P<0.05),使根长增加了83.1%。对地上部鲜重而言,与Al胁迫相比,施加外源NO影响不显著(P>0.05)。对地上部干重和根干重而言,中浓度NO处理后,与Al胁迫相比,分别提高了80.0%和100.0%(P<0.05),表明中浓度NO能够缓解Al对紫花苜蓿幼苗地上部和地下部生长的抑制作用。另外,与Al胁迫相比,不同浓度NO处理下紫花苜蓿幼苗叶面积并无明显变化(P>0.05)。
2.2 对紫花苜蓿幼苗根系形态指标的影响
与CK相比,Al胁迫对紫花苜蓿幼苗的总根长、根系总表面积、平均直径和总体积的影响均不显著(P>0.05)(表2),表明0.1 mmol/L Al胁迫处理对紫花苜蓿根系形态无明显的影响。施加不同浓度的外源NO对紫花苜蓿幼苗根系的生长影响不同。其中,低浓度NO对紫花苜蓿幼苗总长度、总表面积、平均直径均与Al处理无显著性差异(P>0.05)。与Al处理相比,中浓度NO促进了根系发育。
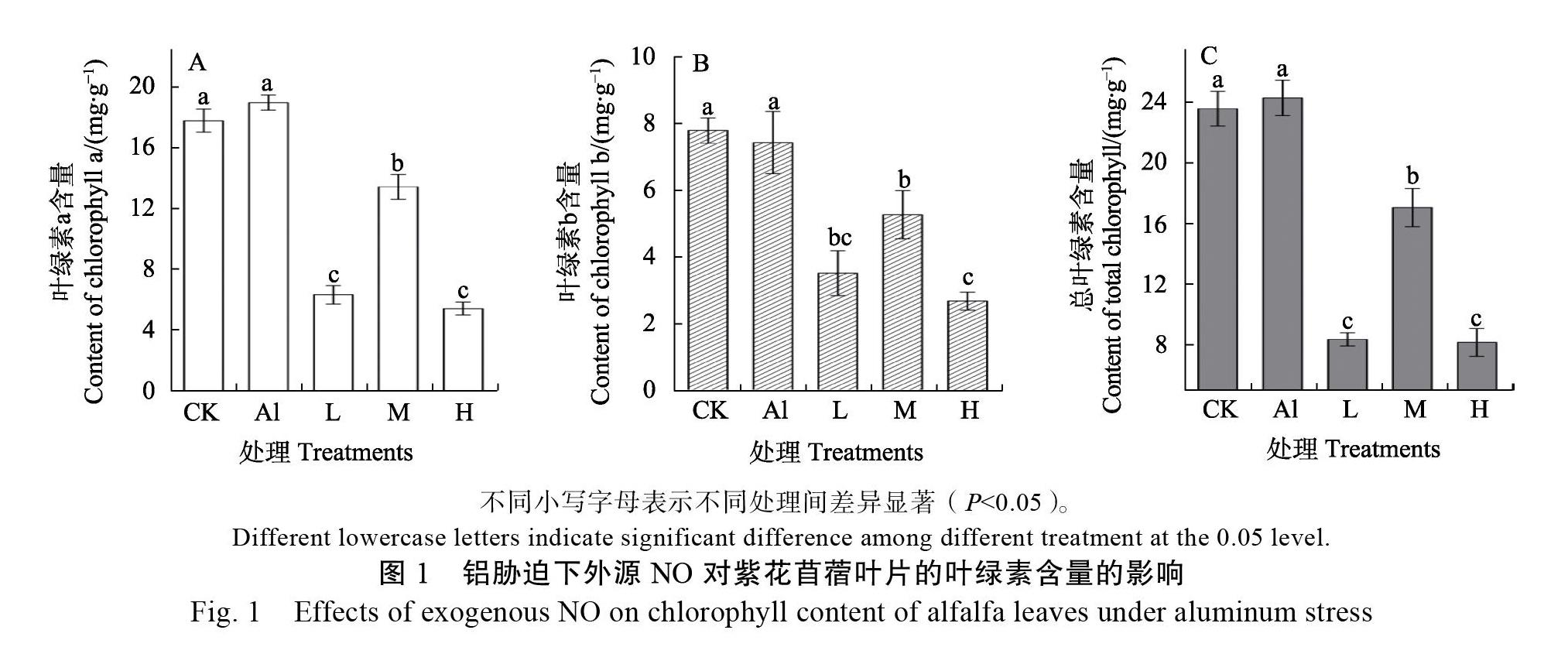
2.3 对叶片叶绿素含量的影响
从图1可见,与CK相比,Al胁迫对紫花苜蓿的叶绿素a、叶绿素b和总叶绿素的含量的影响不显著(P>0.05)。相反,外源施加不同濃度的NO后,显著降低了紫花苜蓿的叶绿素a、叶绿素b和总叶绿素的含量(P<0.05);就叶绿素a、b和总叶绿素而言,施加中浓度的NO的叶绿素含量均显著高于其他两个处理(P<0.05)(图1)。
2.4 对紫花苜蓿叶片和根系脯氨酸含量的影响
从图2可见,Al和外源性NO对紫花苜蓿叶片和根系的脯氨酸含量都产生了显著的影响(P<0.05),只是叶片和根系中脯氨酸的变化趋势不同。在叶片中,与CK相比,Al显著降低了叶片中的Pro含量(P<0.05),相反,施加中、高浓度NO后Pro含量较CK显著增加(P<0.05)。就根系而言,Al胁迫处理中的Pro含量显著高于CK(P<0.05)。施加低、中浓度NO后显著降低了根系中的Pro含量,施加高浓度NO,根系中的Pro含量又显著增加。
2.5 对紫花苜蓿叶片和根系中丙二醛含量的影响
从图3可见,与CK相比,低浓度Al胁迫均显著提高了紫花苜蓿叶片和根系中MDA含量(P<0.05),尤其是施加NO后叶片的MDA含量增加明显(P<0.05);在根系中,与CK相比仅低浓度NO显著提高了MDA含量。
2.6 对紫花苜蓿叶片和根系中超氧化物歧化酶的影响
从图4可见,Al胁迫下,紫花苜蓿叶片和根系中SOD活性变化趋势不一致。在叶片中,与CK相比,Al胁迫显著降低了SOD活性(P<0.05),而根系中SOD活性变化不显著(P>0.05)。在高浓度NO处理下,紫花苜蓿叶片和根系中的SOD活性均得到了提高,显著高于Al胁迫处理,说明施加高浓度NO增强了紫花苜蓿植株的抗氧化能力,有利于缓解铝毒的不利影响。
3 讨论
3.1 铝胁迫与外源NO对紫花苜蓿幼苗生长的影响
本试验中,铝胁迫明显抑制了紫花苜蓿幼苗地上部分和地下部分的生长,进一步证实Pan等[18]的研究。不过,由于植物耐铝胁迫的能力不同,香樟等植物中并没有观察到铝的抑制作用[19]。在植物的地下部,根系是铝胁迫作用的最初靶位,其变化对于了解植物受到的酸铝胁迫及其相应缓解机制极其重要。研究发现,酸铝胁迫显著降低了紫花苜蓿幼苗的根系长度和干重,类似的抑制作用在荞麦中也有发现[20],原因可以归结于ATP合成酶活性的降低[21]、细胞膜的破坏[22]、根系活力的下降[23]。不过,施加外源NO之后,铝的抑制作用发生了改变,据张启明等[24]报道这种变化是植物抵御逆境的表现。
对根系总表面积和总体积来说,高浓度NO与中浓度NO处理之间差异显著,表明NO浓度过高抑制了植物根系的吸收和在土壤中的活动。这可能是因为外源NO本身是一种抗氧化剂,它具有清除超氧阴离子ROS的作用,可通过调节超氧化物的形成同时抑制脂质过氧化物来保护植物免受外界环境胁迫的影响,但外源NO浓度过高反而会促进脂质过氧化物的形成从而抑制根系形态的生长[25]。
3.2 铝胁迫与外源NO对紫花苜蓿生理指标的影响
就叶绿素a、叶绿素b、总叶绿素而言,铝胁迫对它们的影响不显著,这与张慧敏等[26]在对铝胁迫下蚕豆叶绿素含量影响的研究结果一致,据钱莲文等[27]的研究,植物中吸收的大部分Al3+积累在根系,转移到地上部分较少,使得叶绿素合成受到的影响较小。不过与袁世力等[28]的结果不一致,可能是试验材料对酸铝的抗性不同、处理时间不同所导致。施加高、中、低浓度的NO均降低了叶绿素a、叶绿素b和总叶绿素的含量,其变化机制需要进一步探索。
脯氨酸不仅能保持细胞内与细胞外的渗透势[29],而且能减轻胁迫下细胞液中酸中毒现象[30]。试验中发现Al胁迫下地上部分和地下部脯氨酸的积累规律不一致,叶片中的脯氨酸含量降低,相反地下部显著增加,这与根系直接吸收铝离子有关,据Khan等[31]报道脯氨酸的积累有利于增加植物对铝的抗性;另外,叶片为新物质的合成提供氮素和碳架,使得脯氨酸含量降低[32]。
NO的施用进一步改变了Al胁迫下脯氨酸在地上部、地下部的分布特点,特别是在高浓度NO作用下,地上部分和地下部分中脯氨酸含量进一步提高,表明NO能促进植株中脯氨酸的积累,进而解除铝的毒害作用。认为Al胁迫下,苜蓿内脯氨酸大量积累,积累的脯氨酸作为细胞质内渗透调节物质、稳定分子结构、调节细胞酸碱性、解除氨毒以及能量库调节细胞氧化还原势等的作用。
植物逆境下产生的活性氧,会破坏植物功能分子,引起膜脂过氧化,增加丙二醛(MDA)含量等。本试验中,铝胁迫下叶片和根系中MDA含量均升高,只是根中的变化不明显。NO的作用下,叶片、根中丙二醛含量有进一步升高的趋势,该结果与严绍裕[33]的研究结果一致。
铝胁迫对苜蓿地上部分和地下部分中超氧化物歧化酶(SOD)的活性影响有所不同,其中叶片中SOD活性显著降低,而根系中SOD受到的影响不明显。不过,NO的施用改变了Al胁迫对SOD活性的影响,尤其是高浓度下SOD活性显著增加。当植物受到外界因素胁迫产生过量的活性氧时,超氧化物歧化酶(SOD)会清除这些活性氧,保护细胞免受氧化损伤[34]。表明紫花苜蓿在铝胁迫下,NO可以促进植物释放出SOD,进而促进解除铝胁迫产生的一系列毒害作用。
本试验是在水培液中进行的,与紫花苜蓿在大田的响应还是有一定的差异,因为大田生产受多种因素的影响,植物对铝胁迫的响应可能不如水培实验敏感。
综上所述,铝胁迫降低了株高、根长、叶面积、地上和地下部生物量,以及叶片中脯氨酸含量和超氧化物歧化酶活性,相反,提高了根系脯氨酸含量。施用外源NO后,紫花苜蓿在形态和生理方面对铝胁迫的响应发生了一些改变。其中,低浓度NO缓解了铝胁迫对苜蓿幼苗主根伸长的抑制作用;中浓度NO则解除了铝胁迫对株高、根系表面积和体积的抑制作用,提高了地上和地下部生物量。高浓度NO显著地提高了苜蓿地上部和地下部中脯氨酸含量和SOD活性。总之,外源NO能通过积累脯氨酸、增加SOD活性等方式,缓解铝胁迫对紫花苜蓿幼苗生长的抑制作用,促进地上部和地下部的物质积累。
参考文献
[1] Delhaize E, Ryan P R. Uptake on environmental stress: Aluminum toxicity and tolerance in plants[J]. Plant Physiol, 1995, 107(2): 315-321.
[2] 刘 鹏. 类水滑石的合成及其催化醇类的需氧选择性氧化的应用研究[D]. 武汉: 中国地质大学, 2003.
[3] Cartes P, Jara A A, Pinilla L. Selenium improves the antioxidant ability against aluminium induced oxidative stress in ryegrass roots[J]. Annals of Applied Biology, 2010, 156(2): 297-307.
[4] 何龙飞, 沈振国, 刘友良. 铝胁迫下钙对小麦根液泡膜功能和膜脂组成的影响[J]. 南京农业大学学报, 2000(1): 10-13.
[5] 田 聪, 张 烁, 粟 暢, 等. 铝胁迫下大豆根系有机酸积累的特性[J]. 大豆科学, 2017, 36(2): 256-261.
[6] 孟长军. 铝胁迫对白苦瓜幼苗生长状况和生理特性的影响[J]. 中国农业科技导报, 2018, 20(8): 23-28.
[7] 陈进碧, 李小冬, 王小利, 等. 关于紫花苜蓿耐酸铝的研究[J]. 现代畜牧科技, 2017(11): 51.
[8] 李智燕, 邢学峰, 唐 华, 等. 铝和酸胁迫对苜蓿根瘤菌生长和抗氧化酶系的影响[J]. 草业学报, 2013, 22(3): 146-153.
[9] 李春龙, 李凤山, 杨恒山, 等. 科尔沁沙地紫花苜蓿的引种研究初报[J]. 草业科学, 2005(2): 44-47.
[10] Laspina N V, Groppa M D, Tomaro M L, et al. Nitric oxide protects sunflower leaves against Cd-induced oxidative stress[J]. Plant Science, 2005, 169(2): 323-330.
[11] Neill S J, Desikan R, Hancock J T. Nitirc oxide signaling in plants[J]. New Phytol, 2003, 159: 11-35.
[12] 阮海华, 沈文飚, 叶茂炳, 等. 一氧化氮对盐胁迫下小麦叶片氧化损伤的保护效应[J]. 科学通报, 2001(23): 1993-1997.
[13] Zhao L Q, Zhang F, Guo J K, et al. Nitric oxide functions as a signal in salt resistance in the calluses from two ecotypes of reed[J]. Plant physiology, 2004, 134(2): 849-857.
[14] Hsu Y T, Kao C H. Cadmium toxcity is reduced by nitric oxide in rice leaves[J]. Plant Growth Regulation, 2004, 42(3): 227-238.
[15] Inskeep W P, Bloom P R. Extinction coefficients of chlorophyll a and b in N, N-dimethy lform amide and 80% acetone[J]. Plant Physiology, 1985, 77(2): 483-485.
[16] 孙 群, 胡景江. 植物生理学研究技术[M]. 西安: 西北农林科技大学出版社, 2006.
[17] 叶尚红, 张志明, 陈疏影. 植物生理生化实验教程[M]. 昆明: 云南科技出版社, 2009.
[18] Pan X B, Zhu C, Cheng C. Assessment of techniques for screening alfalfa cultivars for aluminum tolerance[J]. Euphytica, 2008, 164(2): 541-549.
[19] 李 茹, 韦 洁, 李桃祯, 等. NO对酸铝胁迫下香樟根系形态及叶绿素荧光特性研究[J]. 西北林学院学报, 2017, 32(1): 30-36.
[20] 王 芳, 刘 鹏, 徐根娣, 等. 铝对荞麦根系的影响[J]. 广西植物, 2006, 26(3): 321-324.
[21] Aha S J, Sivaguru M, Chung G C, et al. Aluminum- induced growth inhibition is associated with impaired efflux and influx of H+ across the plasma membrane in root apices of squash (Cucurbita pepo)[J]. Journal of Experimental Botany, 2002, 53(376): 1959.
[22] Ján Pavlovkin, Peter Palove-Balang, Luká Kolarovi, et al. Growth and functional responses of different cultivars of Lotus corniculatus to aluminum and low pH stress[J]. Journal of Plant Physiology, 2009, 166(14): 1479-1487.
[23] Xiang Lima, Jian Ren, Wei Randai, et al. Effects of aluminium on the root activity, organic acids and free proline accumulation of alfalfa grown in nutrient solution[J]. New Zealand Journal of Agricultural Research, 2020, 63(3): 341-352.
[24] 张启明, 陈荣府, 赵学强, 等. 铝胁迫下磷对水稻苗期生长的影响及水稻耐铝性与磷效率的关系[J]. 土壤学报, 2011, 48(1): 103-111.
[25] 徐 严, 魏小红, 李兵兵, 等. 外源NO对NaCl胁迫下紫花苜蓿种子萌发及幼苗氧化损伤的影响[J]. 草业学报, 2013, 22(5): 145-153.
[26] 张慧敏, 刘东华. 铝对蚕豆叶绿素荧光和叶绿素含量影响探讨[J]. 绿色科技, 2019(12): 15-19.
[27] 钱莲文, 吴文杰, 孙境蔚, 等. 铝胁迫对常绿杨幼苗生长及叶肉细胞超微结构的影响[J]. 林业科学, 2016, 52(11): 39-46.
[28] 袁世力, 刘星辰, 樊娜娜, 等. 镁对铝胁迫紫花苜蓿幼苗生长和光合系统的影响[J]. 中国草地学报, 2018, 40(5): 29-35.
[29] Ashraf M, Foolad M R. Role of glycine betaine and proline in improving plant abiotic stress resistance[J]. Environmental and Experimental Botany, 2005, 59(2): 206-216.
[30] Kurkdjian A, Guern J. Intracellular pH: Measurement and Importance in cell activity[J]. Annu Rev Plant Physiol Plant Mol Biol, 1989, 40: 271-303.
[31] Khan A A, Mcneilly T, Collins J C. Accumulation of amino acids, proline, and carbohydrates in response to aluminum and manganese stress in maize[J]. Journal of Plant Nutrition, 2000, 23(9): 1303-1314.
[32] 全先慶, 张渝洁, 单 雷, 等. 高等植物脯氨酸代谢研究进展[J]. 生物技术通报, 2007(1):14-18.
[33] 严绍裕. 铝镁钙复合作用对杉木幼苗叶片丙二醛(MDA)含量及抗氧化酶活性的影响[J]. 安徽农业科学, 2018, 46(25): 92-95, 100.
[34] Noctor G, Foyer C H. Ascorbate and glutathione: Keeping active oxygen under control[J]. Annu Rev Plant Physiol Plant Mol Biol, 1998, 49: 249-279.
责任编辑:沈德发
