多吡啶类双核镍配合物的合成、晶体结构及抗癌活性
2021-11-04乔佩佩田玥玮张永坡高春艳赵晋忠杜维俊
乔佩佩 田玥玮 贺 卿 张永坡 高春艳*, 赵晋忠 杜维俊
(1山西农业大学基础部,晋中 030801)
(2山西农业大学农学院,晋中 030801)
自从顺铂被发现具有抗肿瘤活性以来,其衍生物如卡铂、奥沙利铂、乐铂等被迅速研发并被广泛用于治疗癌症,这使得金属配合物在众多靶向抗肿瘤药物中脱颖而出,得到了人们的广泛关注[1-2]。但随着临床应用的不断深入,人们发现铂类药物在带来抗癌作用的同时伴随着对身体各种器官的毒副作用,且极易产生耐药性,这在很大程度上限制了铂类配合物的生物利用度和临床应用[3-4]。铂类抗癌药的这些缺点促使人们尝试用其他过渡金属配合物替代它们[5-7],因此,研发低毒、高效且不易产生耐药性的新型金属配合物对于癌症治疗具有重要的理论意义。
过渡金属镍作为人、动物、微生物和植物生命过程中一种必需的微量元素,能促进红细胞再生及造血功能,参与体内多种酶的组成,对人体内的各种生理反应具有重要的调节作用[8-10]。近些年来,有关镍配合物在生物无机化学研究中的报道逐渐增加,其显示出多种生物活性,例如抗惊厥、抗真菌、抗微生物、抗氧化以及抗肿瘤活性[11-16]。而多吡啶类配体作为现代配位化学中应用最为广泛的螯合配体,由于其具有σ给电子能力以及π受电子能力,能够与多种过渡金属形成稳定的配合物,因此具有良好的应用前景[17-20]。
据此,我们以含氮多齿吡啶N,N-bis(pyridin-2-ylmethyl)-4-(4-((pyridin-2-ylmethyl)amino)benzyl)aniline(L)作为配体,合成了2个未见文献报道的多吡啶双核镍配合物[Ni2(L)2Cl2](ClO4)2·3H2O(1)和[Ni2(L)2Cl2](PF6)2(2)。利用X射线单晶衍射、红外光谱以及元素分析确定了该配合物的晶体结构并进行表征。对其作为潜在抗癌药物的特性进行了研究:2个配合物的体外抗增殖活性通过对4种癌细胞系(HeLa、BGC-823、NCI-H460和HepG-2)的细胞毒性进行研究;此外通过Hoechst 33342染色、细胞内活性氧(ROS)水平检测、线粒体膜电位测定等技术和方法探究了配合物抗肿瘤活性的作用机制。

Scheme 1 Structure of L
1 实验部分
1.1 实验试剂与仪器
RPMI1640培养基、DMEM培养基、胰蛋白酶、胎牛血清、溴化噻唑蓝四氮唑(噻唑蓝,MTT)、Hoechst 33342染色试剂、DCFH-DA探针、JC-1线粒体膜电位检测试剂盒均购自索莱宝公司,二甲基亚砜(DMSO)购自阿拉丁公司。其余试剂均为市售分析纯试剂。
所用仪器有Perkin-Elmer 240型元素分析仪(C、H、N)、Bruker Smart1000单晶衍射分析仪、酶标分析仪DNM-9602(北京普朗新技术有限公司)、倒置光学显微镜DMIL LED(徕卡显微系统(上海)贸易有限公司)、超净工作台SW-CJ-1D(苏州净化设备有限公司)、二氧化碳细胞培养箱(Galaxy 170 S New Brunswick)。
1.2 配合物的合成
配体L的合成参见文献[21]。
配合物1的合成:称取0.2mmol的配体L溶于15mL无水乙醇中,完全溶解后滴加0.2mmol的三乙胺。然后缓缓滴加Ni(ClO4)2·6H2O(0.2mmol)的水溶液(5m L)至上述溶液中,混合液在室温搅拌10 h后过滤,滤液在干净烧杯中静置。缓慢挥发一段时间后,适合X射线单晶衍射分析的蓝绿色块状晶体从溶液中析出,过滤,将晶体用少量冷乙醚淋洗,干燥后称重,产率:35%。元素分析按C62H62Cl4N10Ni2O11计算的理论值(% ):C,53.87;H,4.52;N,10.13。实验值(% ):C,53.90;H,4.55;N,10.06。FT-IR(KBr,cm-1):3 442,3 269,1 610,1 574,1 513,1 488,1 447,1 219,1 098,1 021,811,625。
配合物2的合成:称取0.2mmol的配体L溶于15mL无水甲醇中,搅拌并逐滴加入0.2mmol的三乙胺,缓慢加入NiCl2·6H2O(0.2 mmol)的甲醇溶液(10mL),混合液加热搅拌回流0.5 h后,继续加入0.2 mmol KPF6,继续回流3 h,有大量绿色沉淀析出,过滤。将绿色沉淀用5mL乙腈、5mL甲醇、5mLN,N-二甲基甲酰胺和5mL水复溶,过滤,滤液在室温下静置10 d后,适合X射线单晶衍射的蓝绿色块状晶体析出。将晶体过滤并用少量冷乙醚淋洗,干燥后称重。产率:31%。元素分析按C62H58Cl2F12N10Ni2P2计算的理论值(% ):C,52.39;H,4.11;N,9.85。实验值(% ):C,52.42;H,4.17;N,9.80。FT-IR(KBr,cm-1):3 270,1 611,1 575,1 514,1 488,1 448,1 218,1 098,932,844,625。
1.3 配合物的晶体结构测定
选取配合物1和2的单晶样品(尺寸均为0.40 mm×0.25mm×0.20mm)置于Bruker Smart 1000 CCD单晶衍射仪上,在低温(配合物1)或室温(配合物2)下,采用经石墨单色化的MoKα辐射作为衍射光源(λ=0.071 073 nm),以φ-ω扫描方式收集衍射点,通过SAINT程序进行数据还原,强度数据经SADABS程序校正[22]。用SHELXS-97程序的直接法解析结构[23-24]。对全部非氢原子坐标及其各向异性热参数用SHELXL-97程序进行全矩阵最小二乘法修正;氢原子均为理论加氢并进行跨式模型(riding model)精修。配合物1和2的晶体学数据见表1,部分键长键角数据见表2。
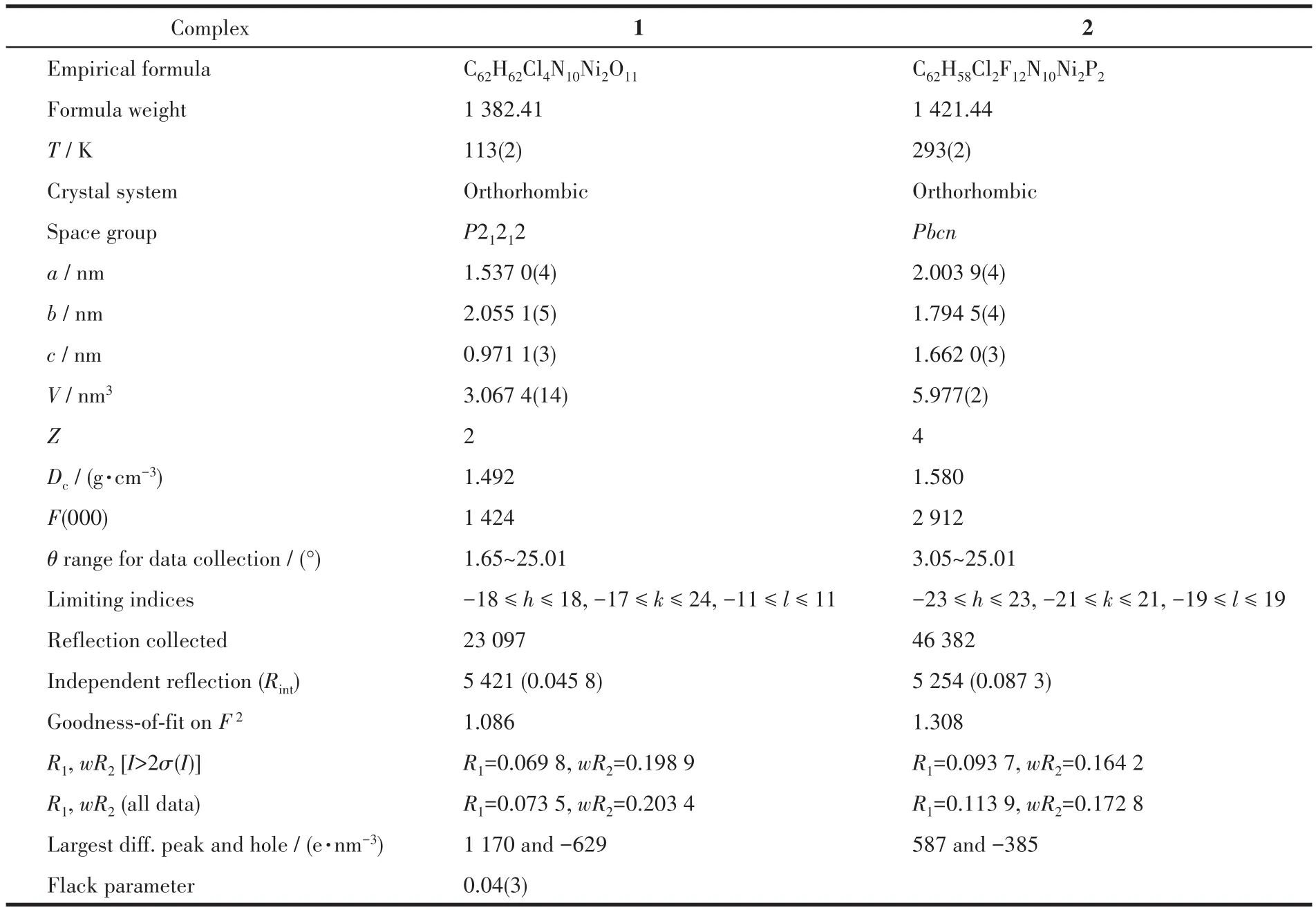
表1 配合物1和2的晶体学数据Table 1 Crystallographic data of Complexes1 and 2

表2 配合物1和2的部分键长和键角Table 2 Selected bond lengths(nm)and angles(°)of complexes1 and 2

续表2
CCDC:2058250,1;2058251,2。
1.4 配合物的抗癌活性检测
1.4.1 细胞系及培养条件
人宫颈癌细胞系(HeLa)、人胃癌细胞系(BGC-823)、人肺癌细胞系(NCI-H460)、人肝癌细胞系(HepG-2)由天津医科大学科研平台提供。HeLa细胞用含10% 胎牛血清的DMEM(H)高糖培养基培养,其它细胞用含10% 胎牛血清的RPMI 1640培养基培养。
1.4.2 细胞毒性检测
采用MTT法来评估2个配合物的体外抗肿瘤活性。将细胞接种于 96孔(每孔3×103~5×103个)细胞培养板中,置于培养箱(37℃,体积分数5% 的CO2)中孵育24h。除去旧的培养基,换入新鲜培养基,设定空白组、对照组(未加配合物组)、加药组(配合物终浓度分别为 3.125、6.25、12.5、25、50、100、200 μmol·L-1),分别加入相对应的药物后继续孵育48 h,然后每孔中加入20μLMTT(5mg·mL-1)继续孵育4 h。取出培养板并吸出上清液,每孔加入150μLDMSO,振荡10min后使用酶标仪对其吸光度进行检测,并计算IC50值。
1.4.3 Hoechst 33342染色
Hoechst 33342是一种可对DNA染色的细胞核染色试剂,常用于细胞凋亡形态学检测,从而证明化合物是否通过诱导凋亡的方式来杀死肿瘤细胞[25]。取对数期且生长状态良好的NCI-H460细胞接种于 12 孔板(每孔 3×104~5×104个),置于培养箱(37℃,体积分数5% 的CO2)中孵育24h。分别加入一定浓度的配合物1于12孔板中,并设置相应对照组,置于培养箱中继续孵育24 h,吸去培养基并用冰冷的磷酸盐缓冲盐溶液(PBS)清洗2~3次,每次3 min,加入Hoechst 33342(10 μg·L-1)染液,置于培养箱中避光孵育15min,弃去染液并用PBS清洗2~3次,每次3min,置于荧光倒置显微镜选取合适的视野进行观察并拍照。
1.4.4 ROS水平检测
ROS的产生和堆积是细胞凋亡中的重要事件,因此细胞生长过程中ROS的产生可以作为检测细胞早期凋亡的重要特征之一。我们利用凋亡细胞内产生的活性氧可以将没有荧光的DCFH氧化生成具有绿色荧光的DCF这一特征来检测细胞内活性氧水平[26]。取处于对数期且生长状态良好的NCIH460 细胞接种于 12孔板(每孔 3×104~5×104个)中,置于培养箱(37℃,体积分数5% 的CO2)中孵育24 h。在细胞中加入不同浓度的配合物1继续孵育24 h,吸出上清液,将用无血清培养基稀释的DCFH-DA探针(10μmol·L-1)加入孔板中,置于培养箱中避光染色30min,取出后用PBS洗涤3次,每次3min,然后置于荧光倒置显微镜下进行观察,选取合适的视野并拍照。
1.4.5 线粒体膜电位检测
诱导细胞凋亡过程通常分为内源性(线粒体)、外源性(死亡受体)和内质网应激启动3条通路,其中线粒体通路最为常见。大量研究表明在凋亡过程中一旦线粒体膜电位下降,则细胞将会发生不可逆转的凋亡[27-28]。采用JC-1线粒体膜电位检测试剂盒对线粒体膜电位进行检测,通过红绿荧光的变化来判断细胞是否发生凋亡。其基本步骤为取对数期且生长状态良好的NCI-H460细胞接种于12孔板(每孔3×104~5×104个)中,置于培养箱(37 ℃,体积分数5% 的CO2)中孵育24 h,在细胞中加入不同浓度的配合物1继续孵育24 h,按照试剂盒步骤进行操作。
2 结果与讨论
2.1 配合物的结构及其表征
对2个配合物进行表征发现,配合物1属于正交晶系,P21212手性空间群,Flack因子为0.04(3)。晶体解析结果表明,1的每个Ni中心均为六配位模式,该双核配合物由2个不对称的L形成双链螺旋分子盒状,其基本单元是由1个[Ni2(L)2Cl2]2+与外界的2个ClO4-和3个水分子构成。而配合物2与1的配位模式相同,结构相似,两者主要区别在于外界阴离子、配位原子与中心原子之间的空间排列不同以及空间群不同,2为非手性的Pbcn,晶体2也属于正交晶系,其基本单元是由1个[Ni2(L)2Cl2]2+和外界的2个PF6-构成。2个配合物的结构如图1所示。
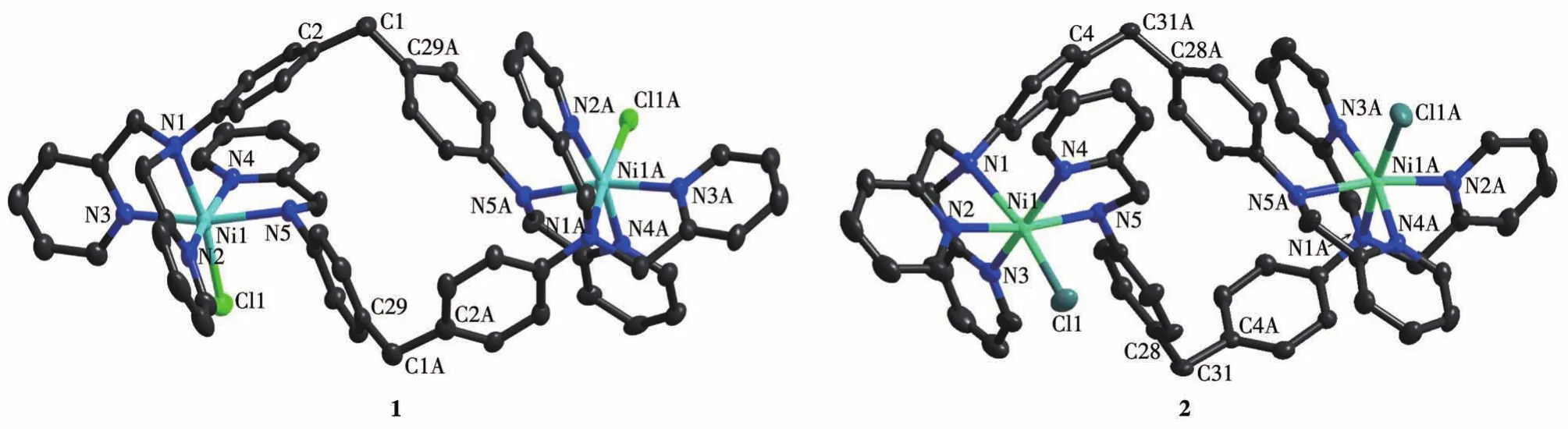
图1 配合物1和2的晶体结构Fig.1 Crystal structures of complexes1 and 2
由图1可见,1和2的Ni中心的配位原子由一个L的叔胺N原子、2个吡啶N原子及另一个L中的1个仲胺N原子、1个吡啶N原子和1个Cl原子组成,因此其构型可描述为畸变的八面体。L的二苯基甲烷基团中的—CH2—是柔性的,在配合物1中C2—C1—C29A的键角为110.6(5)°,Ni1和Ni1A之间的距离为 1.052 5 nm;而配合物2中C28—C31—C4A的键角为109.8(4)°,Ni1和Ni1A之间的距离为0.997 1 nm。
2.2 细胞毒性实验
以顺铂作为阳性对照,对2个化合物进行体外抗肿瘤活性检测(表3)。实验结果表明,2个镍配合物对几种肿瘤细胞的毒性均高于配体,这说明配体与Ni2+的配位明显增强了配体原有的抗癌活性。在2个配合物中,配合物1对肿瘤细胞表现出更高的毒性作用,其中对NCI-H460毒性作用最强,IC50=(26.0±2.2)μmol·L-1,因此我们选择配合物1对NCIH460细胞的抗肿瘤作用进行进一步研究。

表3 配合物1和2及配体L对测试细胞系的IC50值Table 3 IC50values of complexes1,2 and ligand L toward the tested cell lines
2.3 凋亡形态检测
利用Hoechst 33342染色法检测了配合物1对NCI-H460细胞形态学改变,结果如图2所示。可以看到,对照组细胞呈浅蓝色或者没有颜色;阳性对照组(顺铂)细胞染色加深、变亮,而且出现皱缩;而加药组的细胞随着浓度增大,细胞呈现明亮的深蓝色,并伴随着一定的皱缩,在高浓度组中细胞皱缩明显增多。由此可以判定,配合物是以诱导细胞凋亡的方式[23]对NCI-H460细胞产生毒性作用,且具有一定的浓度依赖性。

图2 Hoechst 33342染色法检测配合物1对NCI-H460细胞形态的影响Fig.2 Effect of complex 1 on morphology of NCI-H460 cells determined by Hoechst 33342 staining method
2.4 ROS检测
如图3所示,在对照组中,由于低的ROS水平,DCHF-DA难以转变成具有绿色荧光的DCF,因此观察到微弱的绿色荧光斑点;当把NCI-H460细胞暴露于不同浓度的配合物1中孵育24 h后,DCHF-DA在高水平的ROS下被转变成具有绿色荧光的DCF,因此在荧光显微镜下发现许多明亮的绿色斑点,且具有一定的浓度依赖性。该结果表明,配合物1通过提高细胞内的活性氧水平来诱导细胞凋亡[26]。

图3 DCFH-DA探针染色法测定配合物1对NCI-H460细胞内ROS产生的影响Fig.3 Effect of complex 1 on ROS production in NCI-H460 cells determined by DCFH-DA probe staining method
2.5 线粒体膜电位检测
以上2个实验结果表明,配合物1可能通过诱导细胞凋亡的途径来对肿瘤细胞产生致死作用,因此我们采用一种新型阳离子羰花青染料(JC-1)作为荧光探针测定了线粒体膜电位的变化。结果如图4所示,对照组NCI-H460细胞由于高的膜电位所以呈现红色荧光,但随着配合物1的加入,其红色荧光逐渐减弱,绿色荧光逐渐增强。从红色到绿色荧光的变化表明配合物1的加入导致NCI-H460细胞线粒体膜电位降低,且具有明显的浓度依赖性,据此推测该配合物很可能是通过线粒体途径诱导细胞凋亡[27-28]。

图4 JC-1探针染色法检测配合物1对NCI-H460细胞内线粒体膜电位的影响Fig.4 Effect of complex 1 on mitochondrial membrane potential of NCI-H460 cells determined by JC-1 probe staining method
3 结 论
合成了2个未见文献报道的双核镍(Ⅱ)配合物[Ni2(L)2Cl2](ClO4)2·3H2O(1)和[Ni2(L)2Cl2](PF6)2(2)并对其进行表征。MTT实验表明配合物1和2对体外肿瘤细胞HeLa、BGC-823、NCI-H460及HepG-2均具有一定的细胞毒性,其中对于NCI-H460细胞毒性作用最强。进一步探究了配合物1对NCI-H460细胞的毒性作用机制,结果表明,随着配合物1浓度的递增,细胞内活性氧平衡遭到破坏,线粒体膜电位逐渐耗竭,说明该配合物很可能通过线粒体途径来诱导细胞凋亡从而对癌细胞产生致死作用。
猜你喜欢
杂志排行
无机化学学报的其它文章
- Synthesis,Structures and Catalytic Activity in Knoevenagel Condensation Reaction of Cu(Ⅱ)/Co(Ⅱ)/Ni(Ⅱ) Coordination Polymers Based on Ether-Bridged Tetracarboxylic Acid
- 结晶氮化碳的制备与改性策略
- 双二芳基乙烯配体构建的Ag(Ⅰ)配合物及多色光致变色性质
- 掺镁铝酸三钙制备及其共去除水体中氮磷的性能
- 高活性晶面锐钛矿型TiO2纳米材料的溶剂热法制备及其光催化性能
- 一维纳米材料Cs0.2WO3和W18O49长度与红外吸收关联性的Mie散射理论推导及实验验证
