植物发酵液对小鼠慢性酒精性肝损伤的保护作用
2021-11-04刘春花张逸凡王蒲李翔梁岩1
刘春花,张逸凡,王蒲,李翔,梁岩1,*
1(电子科技大学 资源与环境学院,四川 成都,611731)2(中国科学院深圳先进技术研究院,广东 深圳,518055) 3(中国农业大学 食品科学与营养工程学院,北京,100083)
酒精性肝病(alcoholic liver disease,ALD)是因长期大量饮酒导致的慢性肝脏疾病,临床表现包括早期单纯性脂肪肝、中期酒精性肝炎以及后期几乎不可逆转的肝纤维化和肝硬化等[1-2]。近年来,随着人们生活水平的提高和社交活动的增多,饮酒人数和酒类消费量都明显增加,ALD的发病率不断升高。据调查,酒精已经成为我国除病毒性肝炎导致肝损害的第二大病因[3-4],全球每年有200万人因该病死亡。许多研究表明,酒精性肝病的发病机制十分复杂,氧化应激反应、炎症反应、肝细胞代谢异常、肠道菌群失衡等在酒精性肝病的发生发展中扮演重要角色[1-3]。摄入的乙醇主要经肝脏乙醇脱氢酶(alcohol dehydrogenase,ADH)、乙醛脱氢酶(aldehyde dehydrogenase,ALDH)氧化代谢,生成有害代谢产物乙醛,产生活性氧(reactive oxygen species,ROS)。长期大量饮酒的情况下,ROS生成剧增,超过体内氧化还原反应系统承载能力,ROS体内水平上升,引起氧化应激反应和炎症反应,导致肝损伤发生。目前医院治疗ALD方案较为单一,以戒酒治疗、对症治疗、营养支持和后期肝移植等为主要治疗原则。现有临床治疗ALD药物疗效不理想且存在明显副作用,暂无特异性治疗药物[5]。因此,开发具有护肝保肝作用的药品或保健食品具有重要意义。植物发酵液(plant fermentation extracts,PFE)是一类由新鲜果蔬、杂粮、菌菇和(或)药食同源植物原料经过益生菌发酵得到的混合液体,富含氨基酸、有机酸、多糖、寡糖、维生素、矿物质等多种有益成分[6]。前期研究发现植物发酵液具有抗氧化、提高免疫力、调节肠道菌群等功能活性[7-10]。有研究报道了某些植物发酵液具有肝脏保护作用[11-15],但对有关作用机制研究较少[14]。有研究发现果蔬发酵液具有较好的抗氧化作用,可通过阻止ROS介导的线粒体信号通路,抑制肝细胞凋亡,从而保护小鼠酒精性肝损伤[14]。因此,本研究通过建立慢性酒精性肝损伤小鼠模型,观察植物发酵液对慢性酒精性肝损伤的保护作用,并探讨其可能作用机制,对深入开发植物发酵液护肝的食用价值有着重要的意义。
1 材料与方法
1.1 材料与仪器
植物发酵液,深圳市中科台富科技有限公司,其总可溶性固形物含量为65.4%,总酸含量为23.4 g/L,总糖含量为708 g/L,总酚(以没食子酸计)含量为620 mg/L,总黄酮(以芦丁计)含量为182 mg/L,人体口服推荐剂量为30 mL(0.5 mL/kg)。
56°红星二锅头白酒,北京红星股份有限公司;丙氨酸氨基转移酶(alanine transaminase,ALT)试剂盒、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、总超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、ADH、ALDH试剂盒,南京建成生物工程研究所;肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)ELISA试剂盒,欣博盛生物科技有限公司;Takara 反转录试剂盒、荧光定量PCR试剂盒,宝生物工程有限公司;其他试剂均为国产分析纯。
Scientific Multiskan GO全波长读数仪,美国Thermo公司;CFX96荧光定量PCR仪,美国BIO-RAD公司;CKX41倒置显微镜、BX53生物显微镜,日本奥林巴斯公司;UV6100紫外可见分光光度计,上海精密仪器厂;5180R台式高速冷冻离心机,美国Eppendorf公司。
1.2 实验方法
1.2.1 实验动物
SPF级雄性C57BL/6小鼠,体重(20±2) g,由北京维通利华有限公司[SCXK(京)2016—0006]提供,在中国科学院深圳先进技术研究院实验动物屏障环境[SYXK(粤)2012—0119]中饲养。动物实验经中国科学院深圳先进技术研究院伦理委员会审核批准。实验动物按照中国科学院深圳先进技术研究院实验动物保护和使用规则饲养,实验期间室内通风条件良好,小鼠自由摄食饲料和饮水,在室温(23±2) ℃、相对湿度40%~60%、明暗交替各12 h等条件下饲养。
1.2.2 动物分组及处理
动物先适应性喂养7 d后,按体重随机均分为以下4组:正常对照组(N组)、模型组(ALD组)、低剂量组[PFE-L组,1.25 mL/kg体重(body weight,BW),为人体推荐摄入剂量0.5 mL/kg BW的2.5倍]、高剂量组(PFE-H组,5.0 mL/kg BW,为人体推荐摄入剂量的10倍),每组7只。植物发酵原液用蒸馏水稀释,灌胃体积为10 mL/kg BW,给药时对照组和模型组小鼠灌胃等体积的无菌蒸馏水。造模同时给药,小鼠先灌胃受试物,1 h后药物组和模型对照组小鼠根据体重10 mL/kg灌胃56°红星二锅头白酒,连续喂养12周。实验结束前1晚禁食不禁水12 h,摘眼球取血,常规分离制备血清,备用。同时快速剥离肝脏,称重记录,-80 ℃保存备用。
1.2.3 血清指标检测
分别于样品干预4、6、8、10周后,眼眶静脉丛取血测定小鼠血清肝功能指标。血液采集后室温静置 30 min,7 500 r/min 离心15 min获得血清,参照试剂盒说明书测定血清肝功能(ALT、AST)、细胞因子(IL-6、TNF-α、IL-1β)等指标。
1.2.4 肝脏匀浆指标检测
称取约0.2 g肝脏组织,加入9倍体积的生理盐水充分研磨制成匀浆液,于4 ℃、3 000 r/min离心10 min,取上清液-80 ℃保存备用。采用BCA法对10%肝脏匀浆液中蛋白浓度进行检测。按试剂盒说明书方法检测10%肝脏匀浆液中乙醇代谢关键酶活性(ADH、ALDH)、抗氧化酶活性(SOD、T-AOC、GSH-Px)及脂质过氧化物(MDA)含量等抗氧化指标。
1.2.5 肝脏组织观察
小鼠处死后,取肝左叶同一部位组织块,立即置入4%的中性甲醛中固定24 h,乙醇梯度脱水后进行石蜡包埋与苏木精-伊红(hematoxylin-eosin,HE)染色法,于光学显微镜下观察肝脏组织学特点。
1.2.6 基因mRNA表达检测
采用Trizol法提取肝脏总RNA,按照试剂盒说明书方法逆转录为cDNA,实时荧光PCR反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共40个循环。各基因的mRNA表达量均以ActbmRNA量比值表示,并将对照组定为100%。实验中所用到的引物序列如表1所示。

表1 实验中所需引物序列Table 1 Primer used in this study
1.3 数据处理与分析
实验数据以“平均值±标准差(Mean±SE)”表示,采用统计软件SPSS 19.0进行统计分析。不同实验组组间差异采用单因素方差分析(One-Way ANOVA),组间两两比较采用最小显著差异(least significance difference,LSD)法。*表示与空白对照组比较差异显著(P<0.05),**表示与空白对照组比较差异极显著(P<0.01);#表示与慢性酒精性损伤模型组比较有显著差异(P<0.05),##表示与慢性酒精性损伤模型组比较差异极显著(P<0.01)。
2 结果与分析
2.1 植物发酵液对慢性酒精性肝损伤小鼠血清肝功能指标的影响
血清ALT、AST活性高低可以间接反映肝损伤程度[16]。正常情况下,血清中ALT、AST活性较低。但是当肝细胞破坏、细胞膜通透性增强时,血清ALT活性升高;当肝细胞线粒体损伤时,AST活性增强[14, 17]。如图1所示,与正常对照组小鼠相比,连续灌胃酒精8周后模型组小鼠血清ALT、AST活性显著升高(P<0.05),表明慢性酒精性肝损伤小鼠模型构建成功。与模型组小鼠相比,灌胃植物发酵液低、高剂量组小鼠在8、10、12周的血清ALT、AST活性显著降低(P<0.05),表明植物发酵液能够减轻慢性酒精诱导的肝细胞损伤。
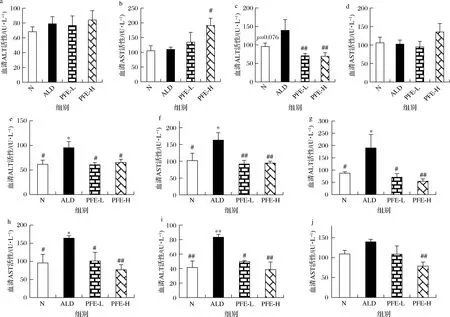
a、b-4周;c、d-6周;e、f-8周;g、h-10周;i、j-12周图1 植物发酵液对慢性酒精性肝损伤小鼠血清ALT和AST水平的影响Fig.1 Effect of plant fermentation extracts on ALT and AST induced by alcohol in mice注:*表示与空白对照组比较差异显著(P<0.05),**表示与空白对照组比较差异极显著(P<0.01); #表示与没模型组比较差异显著(P<0.05),##表示与模型组比较差异极显著(P<0.01)(下同)
2.2 植物发酵液对慢性酒精性肝损伤小鼠肝脏组织病理学的影响
长期过度饮酒可使肝脏发生肝细胞脂肪变性、脂肪肝,甚至演变为酒精性肝炎乃至不可逆转的肝硬化[1-3]。如图2所示,光镜下可见,慢性酒精性肝损伤模型小鼠肝脏小叶界限不清晰,肝细胞出现空泡变性,表明慢性酒精性肝损伤小鼠模型构建成功;植物发酵液低剂量组小鼠肝小叶结构界限不清晰且呈现明显疏松状态;植物发酵液高剂量组小鼠肝小叶结构清晰,肝组织极少量空泡,组织结构较模型组小鼠有明显改善,进一步说明植物发酵液对酒精诱导的小鼠肝细胞损伤有一定改善作用。
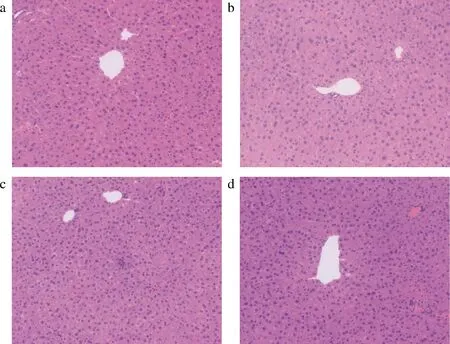
a-N;b-ALD;c-PEE-L;d-PEE-H图2 植物发酵液对慢性酒精性肝损伤小鼠肝脏 组织病理学的影响(20×)Fig.2 Effect of PFE on liver HE staining induced by alcohol in mice (20×)
2.3 植物发酵液对慢性酒精性肝损伤小鼠肝脏抗氧化能力的影响
机体对乙醛的分解代谢过程会产ROS及自由基。在正常生理状态下,自由基及ROS可通过体内的由GSH-Px、SOD等组成的抗氧化系统消除[16-18],维持体内氧化还原平衡。长期大量饮酒,乙醇代谢产生的氧自由基急剧增加,迅速降低或耗竭机体内的还原酶,使得机体内氧化还原反应系统失衡,从而导致肝细胞出现氧化应激损伤,引起脂质过氧化[3, 17]。由图3可知,与正常对照组小鼠相比,模型组小鼠肝脏SOD、GSH-Px、T-AOC抗氧化活性显著降低(P<0.01),而脂质过氧化物MDA含量显著升高(P<0.05),说明长期饮酒会导致小鼠肝脏脂质过氧化损伤,抗氧化能力下降。与模型组小鼠相比,植物发酵液高剂量组小鼠肝脏SOD、GSH-Px、T-AOC活性均有所上升,其中SOD活性显著升高(P<0.05),MDA含量有所降低,表明植物发酵液能提高慢性酒精性肝损伤小鼠肝脏的抗氧化能力,降低肝脏脂质过氧化损伤程度。
2.4 植物发酵液对慢性酒精性肝损伤小鼠肝脏乙醇关键代谢酶的影响
肝脏是乙醇代谢的主要场所,乙醇氧化系统途径、微粒体乙醇氧化酶系统(microsomal ethanol oxidizing system,MEOS)途径等乙醇主要代谢路径中均可产生高毒性代谢产物乙醛。乙醇进入肝脏后,主要经ADH代谢成乙醛,随后被ALDH进一步氧化代谢成乙酸[16, 19]。当血乙醇浓度过高,肝MEOS启动,把乙醇氧化分解为乙醛,加速乙醇代谢,细胞色素P450 2E1(recombinant cytochrome P450 2E1,CYP2e1)是其代谢限速酶[20-22]。与健康人相比,肝癌患者血浆中总 ADH 活性有所上升[23]。齐冰[24]发现,与对照组大鼠相比,二乙基亚硝胺诱导的肝癌模型大鼠肝匀浆 ADH 活性、ALDH活性显著升高,ADH、ALDH 活性升高可能和肝纤维化甚至肝癌存在关系。由图4可知,模型组小鼠肝脏ALDH活性较正常对照组显著升高(P<0.05),ADH活性也有升高,表明模型组小鼠肝脏乙醇代谢关键酶活性可能一直处于应激升高状态。与模型组相比,植物发酵液高剂量组小鼠肝脏ALDH活性显著降低(P<0.05),且ALDH活性、ADH活性几乎降低到正常对照组水平。此外,与正常对照组相比,慢性酒精性肝损伤模型组小鼠肝脏Cyp2e1mRNA表达量明显下降(P<0.05);而与模型组相比,植物发酵液高剂量组小鼠肝脏Cyp2e1mRNA表达量显著上升(P<0.05),恢复到正常对照组水平。以上结果表明摄入植物发酵液对肝损伤小鼠肝脏功能具有一定保护作用。
2.5 植物发酵液对慢性酒精性肝损伤小鼠炎症反应的影响
不断增加的研究证明,炎症反应是引起酒精肝病的重要原因[25-26]。大量饮酒情况下,过量的自由基和ROS能通过促进TNF-α、IL-1β、IL-6等炎症因子的释放,激活炎症反应,过度的炎症反应反过来进一步加剧ROS的积累及脂质过氧化,诱导细胞凋亡,导致肝细胞损伤。临床研究发现,酒精性肝病患者普遍存在血清TNF-α水平升高现象,TNF-α被认为是酒精性肝病的危险因素之一[27]。一些研究则认为免疫相关炎症因子(如IL-6、IL-1β)可以发挥保护肝脏作用[28]。由图5可知,与正常对照组相比,慢性酒精性肝损伤模型组小鼠肝脏炎症因子TnfmRNA的表达显著上升(P<0.05),Il1bmRNA的表达显著下降(P<0.01),Il6mRNA的表达降低了42.4%。与模型组相比,植物发酵液高剂量组小鼠肝脏Tnf、Il1bmRNA的表达没有明显变化,但Il6mRNA的表达显著上升(P<0.01),升高了35.12倍。此外,与正常对照组相比,模型组小鼠血清IL-6、IL-1β水平明显降低(P<0.05),TNF-α水平有上升趋势。与模型组相比,植物发酵液高剂量组小鼠血清TNF-α水平有所下降,血清IL-6水平有所上升,血清IL-1β水平显著升高到正常水平(P<0.05),以上结果表明植物发酵液对摄入酒精诱导的炎症反应具有一定的调节作用,从而起到保护肝脏的作用。
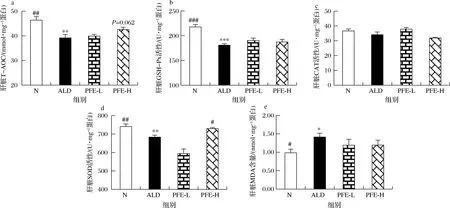
a-肝脏T-AOC;b-GHS-Px活性;c-CAT活性;d-SOD活性;e-MDA含量图3 植物发酵液对慢性酒精性肝损伤小鼠肝脏抗氧化指标的影响Fig.3 Effect of PFE on antioxidant indexes induced by alcohol in mice注:###表示与模型组比较差异极显著(P<0.001)(下同)
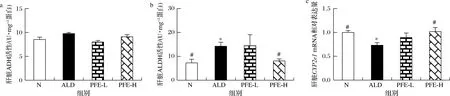
a-ADH活性;b-ALDH活性;c-Cyp2e1 mRNA相对表达量图4 植物发酵液对慢性酒精性肝损伤小鼠乙醇代谢关键酶的影响Fig.4 Effect of PFE on key enzymes of ethanol metabolism induced by alcohol in mice
2.6 植物发酵液对慢性酒精性肝损伤小鼠肝脏有关基因mRNA表达的影响
核因子(nuclear transcription factor kappa B,NF-κB)是细胞内重要的转录因子之一,NF-κB信号途径调节多种生理与病理过程,与机体免疫反应、炎症反应、细胞凋亡等密切相关[29-30]。B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白家族在细胞凋亡的线粒体信号中起重要作用,与肝细胞凋亡关系密切[30]。核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)信号通路被报道能够抵御外源性刺激和毒物的抗氧化应答反应,减少肝损伤[31-32]。由图6可知,与正常对照组相比,慢性酒精性肝损伤模型组小鼠肝脏细胞凋亡相关基因Bcl2mRNA的表达显著升高(P<0.01),抗氧化反应元件基因Nfe212mRNA的表达显著降低(P<0.05),核因子NFkb1mRNA的表达则没有明显变化,说明长期过量酒精摄入可导致小鼠肝脏凋亡的发生及抗氧化能力的降低。与模型组相比,植物发酵液高剂量组小鼠肝脏Bcl2、Nfe212、NFkb1mRNA的表达则没有明显变化。信号转导与转录激活因子3(signal transducer and activator of transcription 3,Stat3)是介导细胞间信号转导的经典转录因子[33],主要调控凋亡、代谢、免疫反应、炎症反应等过程。有研究发现Stat3的异常表达及活化可能促进肝脏炎症微环境的形成及脂质积累[34]。与正常对照组相比,慢性酒精性肝损伤模型组小鼠肝脏Stat3 mRNA的表达显著升高(P<0.05);与模型组相比,植物发酵液高剂量组小鼠肝脏Stat3 mRNA的表达显著降低(P<0.05),基本恢复到正常水平。以上结果表明,植物发酵液可能是通过抑制肝脏炎症微环境的形成,发挥肝脏保护作用。
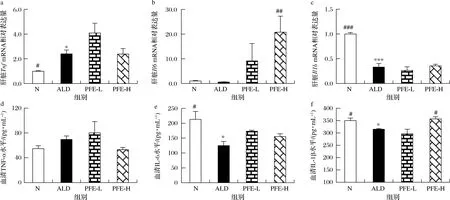
a~c-肝脏Tnf、Il6、Il1b mRNA相对表达量;d~f-血清TNF-α、IL-6、IL-1β水平图5 植物发酵液对慢性酒精性肝损伤小鼠炎症因子的影响Fig.5 Effect of PFE on inflammation cytokines induced by alcohol in mice
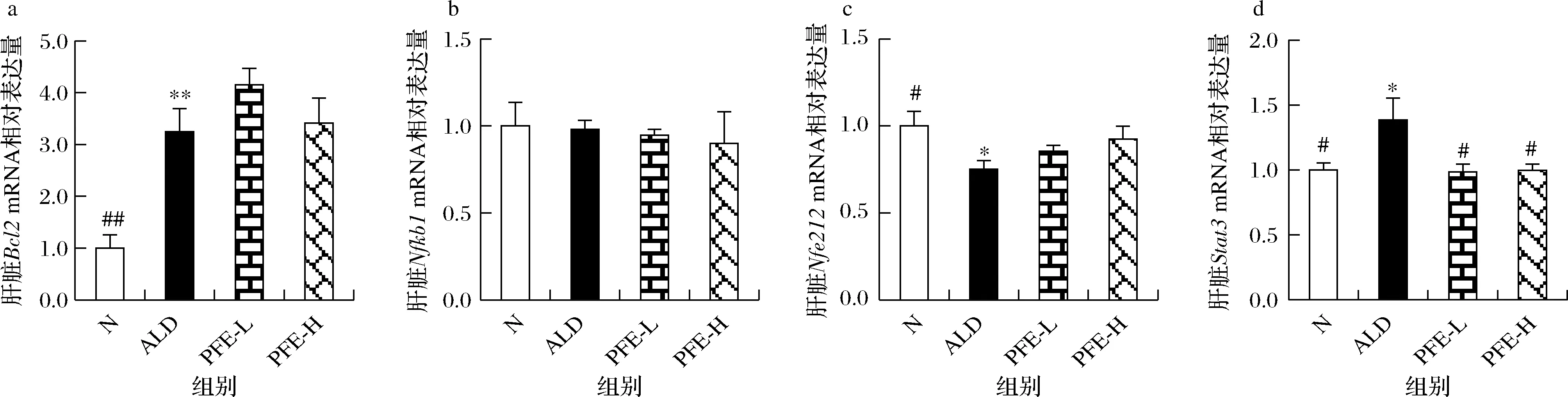
a~d-肝脏Bcl2、Nfkb1、Nfe212、Stat3 mRNA相对表达量图6 植物发酵液对慢性酒精性肝损伤小鼠肝脏有关基因mRNA表达的影响Fig.6 Effect of PFE on related gene of liver induced by alcohol in mice
3 结论
本研究通过建立慢性酒精性肝损伤小鼠模型,对植物发酵液对小鼠慢性酒精性肝损伤的保护作用及其机制进行了研究。实验结果显示,植物发酵液可显著降低慢性酒精性肝损伤小鼠血清AST、ALT活性,减轻肝脏组织损伤程度,维持肝细胞的正常生理功能;能够调控肝脏ADH、ALDH活性及Cyp2e1mRNA表达,恢复机体乙醇代谢系统功能。植物发酵液能提高肝组织中SOD、GSH-Px、T-AOC抗氧化酶活性,抑制肝组织中脂质过氧化物MDA含量增加,提高肝脏抗氧化能力,保护肝脏功能。此外,植物发酵液还可通过调控血清细胞因子IL-1β、IL-6的表达、肝脏Stat3mRNA的表达,减轻炎症反应,起到保护肝脏作用。可见,植物发酵液对慢性酒精诱导的小鼠肝损伤具有保护作用,可能与其恢复机体乙醇代谢功能、减轻酒精对机体造成的氧化损伤和炎症反应有关,其功效成分及其分子机制有待通过后续研究进一步阐明。