罗非鱼肠道真菌Alternaria tenuissima SCSIO41701中的抗菌化合物
2021-11-03张晓勇漆淑华
刘 瑶,张晓勇,程 霞,梁 潇,漆淑华*
1中国科学院南海海洋研究所,中国科学院热带海洋生物资源与生态重点实验室,广州 510301;2中国科学院大学,北京 100049;3南方海洋科学与工程广东省实验室(广州),广州 511458;4华南农业大学海洋学院,广州 510642
由无乳链球菌(Streptococcusagalactiae)和海豚链球菌(S.iniae)引起的罗非鱼链球菌病给罗非鱼养殖业带来了严重经济损失[1,2]。目前罗非鱼养殖主要利用抗生素等化学药物对链球菌病进行防治,但长时间地使用广谱抗生素会诱导出耐药菌株[1,2]。
链格孢菌属(Alternaria)真菌广泛存在于自然界,已鉴定的有300余种腐生菌、内生菌和病原菌[3]。从链格孢菌属真菌中已发现许多结构新颖的活性化合物,化合物类型主要有吡喃酮类、萜类、甾醇类、芳香聚酮类、蒽醌类、生物碱类、肽类等[4-9],部分化合物具有抑制酶、细胞毒、抗真菌、抗氧化、促进单双子叶植物根系生长等生物活性[4-9],其中链格孢菌毒素比如alternariol、alternariol methyl ether、tentoxin等具有显著毒性[4]。细极链格孢菌(Alternariatenuissima)是一种常见的环境真菌,有关A.tenuissima次级代谢产物研究较少[10,11],本研究组Pan等[12,13]曾从深海沉积物来源的A.tenuissimaDFFSCS013中分离到结构新颖的螺环稠合氢化蒽醌和含氮蒽醌类化合物等。
为寻找新型抗生素,我们以罗非鱼无乳链球菌和海豚链球菌为指示菌,对一批从罗非鱼肠道分离鉴定的真菌进行了抗菌筛选,从中筛选到一株链格孢菌属真菌A.tenuissimaSCSIO41701有显著抑制无乳链球菌和海豚链球菌生长活性。本研究采用活性追踪法对A.tenuissimaSCSIO41701大米培养基发酵产物中抑制罗非鱼无乳链球菌和海豚链球菌生长的活性化合物进行了研究。
1 材料与方法
1.1 主要仪器及试剂
超导核磁共振仪(Bruker AVANCE500型,内标为TMS);分析天平(SH 200E型电子天平);中压制备液相色谱(CHEETAH MP200 system(Agela Technologies));高效液相色谱仪(Shimadzu LC-20AT pump with a Shimadzu SPD-M20A Photodiode Array Detector);高效液相色谱分析柱(YMC ODS-SP,5 μm,150 mm×4.6 mm);高效液相色谱半制备柱(YMC-Pack ODS,S-5 μm,250 mm×10 mm);超声波清洗器(KQ-5000D型,昆山市超声仪器有限公司);旋转蒸发仪器(SB-2000,上海艾朗仪器有限公司)。
试剂:甲醇、石油醚、乙酸乙酯、二氯甲烷、丙酮、三氟乙酸、浓硫酸、二甲基亚砜(DMSO)等均为分析纯,购买自广州试剂厂;色谱级甲醇、乙腈均为购自默克公司;怡宝纯净水购自于胜佳超市。
1.2 菌种
本实验所使用的真菌菌株A.tenuissimaSCSIO41701是从罗非鱼肠道内溶物中分离获得,并结合形态学观察,通过真菌DNA提取、ITS序列扩增以及序列比后鉴定为A.tenuissima。该菌株的ITS序列在GeneBank中注册编号为MK281554,其与菌株A.tenuissimaZB11263537的ITS序列(KX783377)相似度为99%。该菌株保存在中国科学院南海海洋研究所海洋微生物中心。
1.3 培养基及发酵条件
大米培养基:大米80 g,酵母浸膏0.4 g,葡萄糖0.4 g,水120 mL。
配3 kg的大米培养基,用一升锥形瓶分装,每瓶大米约80 g,共40瓶。将培养基灭菌,在无菌操作台中将菌株SCSIO41701的孢子用已灭菌的竹签刮下,转移到无菌水中,再用已灭菌的移液枪吸取5 mL菌液转移到培养基中,26 ℃下静置培养30天后收瓶。
1.4 提取与分离
将3 kg大米的发酵产物用细胞破碎仪进行破碎,用丙酮浸泡约12 h,重复三次,合并提取液,减压浓缩,再用乙酸乙酯萃取,浓缩得到浸膏约44.30 g。总浸膏经正相硅胶柱层析,用CH2Cl2/MeOH(1∶0→1∶1)溶剂系统洗脱,最后洗脱液通过TLC检测合并得到12个组分(Fr.1~Fr.12)。用甲醇溶解时发现组分Fr.6~Fr.10中均有一部分甲醇不溶物,分别将Fr.6~Fr.10中甲醇不溶物过滤出来,TLC点板确定它们化学成分基本相同,均主要含2个化合物,只是不同组分中两者比例不同,合并共得到10.26 g甲醇不溶物,其中来自Fr.6~Fr.10的重量分别为1.86、1.43、0.41、1.74、4.78 g。
取Fr.6中54 mg甲醇不溶物用甲醇和二氯甲烷(1∶1)的混合溶剂溶解,经薄层制备板刮板得到化合物1(32 mg)。滤液经中压ODS柱分离,以甲醇/水/TFA(三氟乙酸)(V/V 5∶95∶0.03→100∶0∶0.03)梯度洗脱,分离得到11个亚组分(Fr.6.1~Fr.6.11)。Fr.6.2经中压ODS柱(冲洗系统MeOH/H2O/TFA,V/V 5∶95∶0.03→100∶0∶0.03)分离得到7个亚组分(Fr.6.2.1~Fr.6.2.3)。Fr.6.2.1经HPLC(MeOH/H2O/TFA,V/V 55∶45∶0.03)分离纯化得到化合物8(2 mg,tR=22.4 min)。Fr.6.3经中压ODS色谱柱(MeOH/H2O/TFA,V/V 5∶95∶0.03→100∶0∶0.03)分离得到7个亚组分(Fr.6.3.1~Fr.6.3.7)。Fr.6.3.2经Sephdex LH-20凝胶柱(CH2Cl2/MeOH=1∶1)除去色素后,经HPLC(MeOH/H2O/TFA,V/V 60∶40∶0.03)分离纯化得到化合物7(11.8 mg,tR=25.0 min)。Fr.6.3.5经Sephdex LH-20凝胶柱(CH2Cl2/MeOH=1∶1)除去色素后,经HPLC(MeOH/H2O/TFA,V/V 80∶20∶0.03)分离,得到化合物4(10.1 mg,tR=37.2 min)。Fr.6.4经中压ODS色谱柱(MeOH/H2O/TFA,V/V 5∶95∶0.03→100∶0∶0.03)分离得到10个亚组分(Fr.6.4.1~Fr.6.4.10),Fr.6.4.4经HPLC(MeOH/H2O/TFA,V/V 52∶48∶0.03)分离纯化得到化合物5(28.6 mg,tR=17.1 min)。Fr.6.8经Sephdex LH-20凝胶柱分离(MeOH洗脱)得到3个亚组分(Fr.6.8.1~Fr.6.8.3),Fr.6.8.3经HPLC(MeOH/H2O/TFA,V/V 75∶20∶0.03)分离,得到化合物3(8 mg,tR=40.0 min)。将Fr.7中甲醇不溶物过滤后的滤液经中压ODS柱分离,以甲醇/水/TFA(V/V 5∶95∶0.03→100∶0∶0.03)梯度洗脱,得到13个亚组分(Fr.7.1~Fr.7.13)。Fr.7.7经Sephdex LH-20凝胶柱分离(CH2Cl2/MeOH,V/V 1∶1)得到5个亚组分(Fr.7.7.1~Fr.7.7.5)。Fr.7.7.2经HPLC(MeOH/H2O/TFA,V/V 54∶46∶0.03)分离,得到化合物9(41 mg,tR=12.5 min)。Fr.7.9经Sephdex LH-20凝胶柱分离(CH2Cl2/MeOH=1∶1)除去杂质,得到化合物2(15 mg)。Fr.7.13经Sephdex LH-20凝胶柱分离(CH2Cl2/MeOH=1∶1)得到3个亚组分(Fr.7.13.1~Fr.7.13.3),Fr.7.13.2经HPLC(MeOH/H2O/TFA,V/V 65∶35∶0.03)分离,得到化合物6(14.8 mg,tR=12.8 min)。
1.5 抗菌活性测定
1.5.1 纸片法抗菌初筛
采用纸片法,以DMSO为溶剂,将待测组分配制成20 mg/mL,待测单体化合物配制成10 mg/mL,阳性对照环丙沙星和青霉素分别配成5 mg/mL。以无乳链球菌和海豚链球菌为指示菌。细菌先摇床培养24 h(30 ℃),用无菌水稀释至酶标仪OD值0.01~0.02,取稀释后的细菌150 μL,涂布于细菌培养皿中。将灭菌的纸片(直径6 mm)用灭菌的镊子取每6个均匀放入培养皿,以环丙沙星和青霉素(12.5 μg/disc)为阳性对照,阴性对照为DMSO。取2.5 μL待测样品滴入纸片,每个样品两个平行试验,37℃培养箱内培养1天,观察现象。
1.5.2 96孔板法测MIC值
采用倍半稀释法,对初筛有显著抗菌活性的化合物1进行MIC值测定。采用96孔板,每孔加入192 μL的稀释好菌液(OD值0.01~0.02)和8 μL样品(10 mg/mL),样品最终浓度分别为200、100、50、25、12.5、6.25、3.125、1.5 μg/mL。最后,放入37 ℃培养箱培养,12 h后用酶标仪测量,查看结果。阳性对照每孔加入192 μL稀释的菌液和8 μL环丙沙星,阴性对照每孔加入192 μL稀释的菌液和8 μL DMSO。
2 结果与分析
2.1 化合物的结构鉴定
采用硅胶柱层析、Sephadex LH-20凝胶柱层析、HPLC等色谱技术从A.tenuissimaSCSIO41701大米发酵产物中共分离纯化得到9个化合物(见图1),通过1H NMR、13C NMR、MS等波谱技术鉴定了这些化合物的结构。
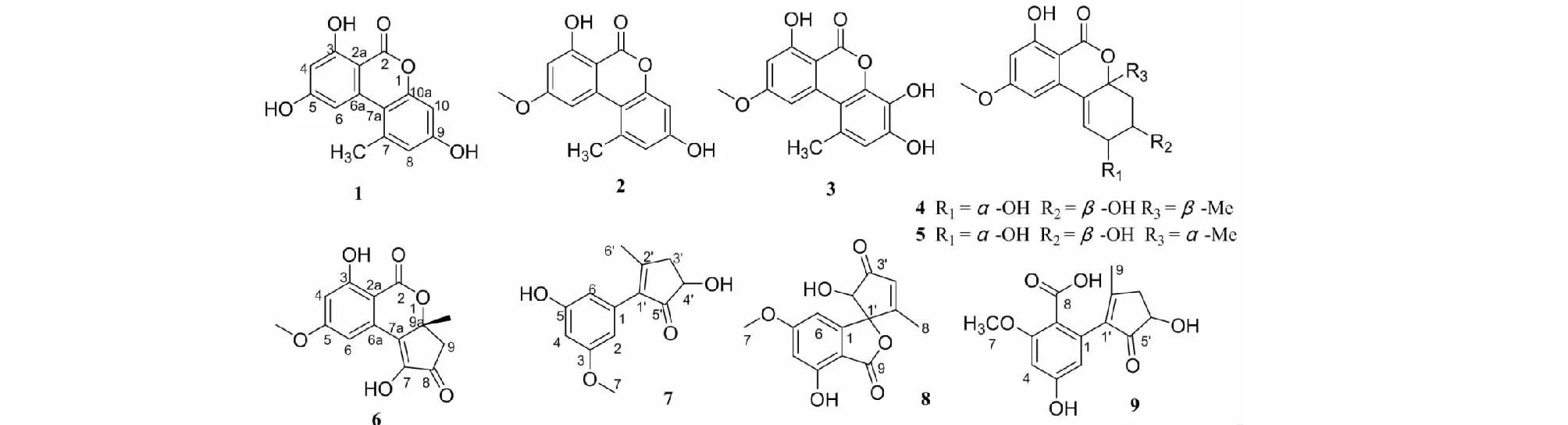
图1 化合物1~9的化学结构 Fig.1 Structures of compounds 1-9
化合物1无色尖晶;1H NMR(700 MHz,DMSO-d6)δ:11.76(1H,s,OH-3),10.96(1H,s,OH-5),10.37(1H,s,OH-9),7.26(1H,d,J=2.0 Hz,H-6),6.72(1H,d,J=2.5 Hz,H-8),6.64(1H,d,J=2.5 Hz,H-10),6.37(1H,d,J=2.0 Hz,H-4),2.70(3H,s,H-11);13C NMR(175 MHz,DMSO-d6)δ:138.3(s,C-7),117.6(d,C-8),158.5(s,C-9),101.6(d,C-10),152.6(s,C-10a),164.1(s,C-2),97.4(s,C-2a),164.7(s,C-3),100.9(d,C-4),165.5(s,C-5),104.3(d,C-6),138.1(s,C-6a),108.8(s,C-7a),25.3(q,C-11)。上述数据与文献报道[14]对比一致,故鉴定该化合物为aternariol。
化合物2淡黄色固体;1H NMR(700 MHz,DMSO-d6)δ:11.83(1H,s,OH-3),10.38(1H,s,OH-9),7.23(1H,d,J=2.2 Hz,H-6),6.73(1H,d,J=2.6 Hz,H-8),6.65(1H,d,J=2.6 Hz,H-10),6.62(1H,d,J=2.2 Hz,H-4),2.73(3H,s,H-11),3.91(3H,s,H-12);13C NMR(175 MHz,DMSO-d6)δ:137.3(s,C-7),117.4(d,C-8),158.6(s,C-9),101.3(d,C-10),152.5(s,C-10a),164.7(s,C-2),98.5(s,C-2a),164.1(s,C-3),99.2(d,C-4),166.2(s,C-5),103.4(d,C-6),137.5(s,C-6a),108.8(s,C-7a),25.0(q,C-11),55.9(q,C-12)。上述数据与文献报道[15]对比一致,故鉴定该化合物为aternariol methyl ether。
化合物3棕红色无定形粉末;1H NMR(700 MHz,DMSO-d6)δ:11.91(1H,s,OH-3),10.01(1H,s,OH-10),9.15(1H,s,OH-9),7.22(1H,d,J=2.2 Hz,H-6),6.73(1H,s,H-8),6.61(1H,d,J=2.2 Hz,H-4),3.91(3H,s,H-12),2.65(3H,s,H-11);13C NMR(175 MHz,DMSO-d6)δ:138.5(s,C-6a),98.4(s,C-2a),164.2(s,C-3),99.3(d,C-4),166.2(s,C-5),103.5(d,C-6),164.7(s,C-2),109.2(s,C-7a),141.6(s,C-10a),131.2(s,C-10),147.1(s,C-9),116.9(d,C-8),126.5(s,C-7),55.9(q,C-12),24.6(q,C-11)。上述数据与文献报道[16]对比一致,故鉴定该化合物为3-hydroxyalternariol 5-O-methylether。
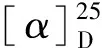
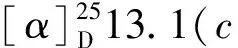
化合物6黄色固体;1H NMR(700 MHz,DMSO-d6)δ:11.35(1H,s,OH-3),11.32(1H,s,OH-7),6.92(1H,d,J=2.1 Hz,H-6),6.59(1H,m,H-4),3.86(3H,s,H-5),3.05(1H,d,J=17.7 Hz,H-9),2.80(1H,d,J=17.7 Hz,H-9),1.61(3H,s,H-10);13C NMR(175 MHz,DMSO-d6)δ:196.6(s,C-8),167.9(s,C-2),165.7(s,C-5),163.9(s,C-3),149.6(s,C-7),132.8(s,C-6a),129.8(s,C-7a),105.8(d,C-6),101.7(d,C-4),99.3(s,C-2a),81.6(s,C-9a),56.0(q,C-5),46.8(t,C-9),27.4 (q,C-10)。上述数据与文献[18]报道的化合物4数据对比一致,由于文献[18]没给具体命名,在此系统命名此化合物为1,6-dihydroxy-8-methoxy-3a-methyl-3,3a- dihydrocyclopenta[c]isochromene- 2,5-dione。
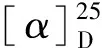
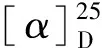
2.2 抗菌活性结果
采用纸片扩散法测试发酵产物的乙酸乙酯粗提物、各组分,以及各化合物的抗菌活性结果见表1。在100 μg/disc浓度下,乙酸乙酯粗提物抑制无乳链球菌和海豚链球菌生长的抑菌圈大小均为15 mm;在50 μg/disc浓度下,各组分对无乳链球菌和海豚链球菌的生长均有一定的抑制作用,其中组分Fr.6~Fr.10抗菌活性较强,抑菌圈大小为14~21 mm;在25 μg/disc浓度下,化合物1~11中只有1对无乳链球菌和海豚链球菌均显示较强抗菌活性,抑菌圈大小为10 mm,而其他化合物则没有或只有弱抗菌活性。对于活性化合物1进一步采用96孔板稀释法测试了其MIC值,抑制无乳链球菌和海豚链球菌的MIC值均为12.5 μg/mL,阳性对照药环丙沙星抑制这两株病原菌的MIC值均为3.125 μg/mL。
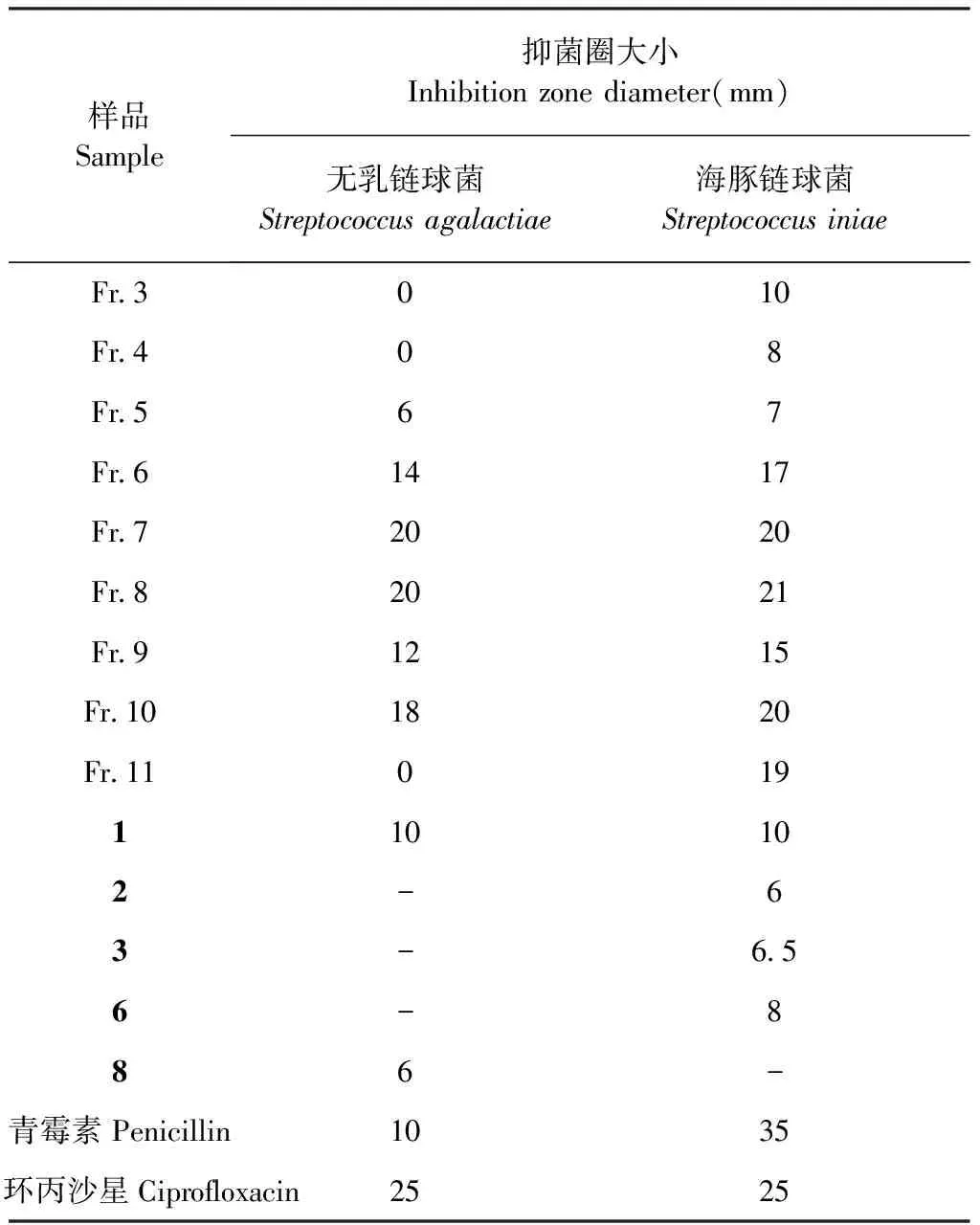
表1 组分和化合物的抗菌活性Table 1 Antibacterial activities of fractions and compounds
3 讨论
在本研究中,我们通过抗菌活性追踪分离鉴定了真菌A.tenuissimaSCSIO41701中抑制罗非鱼无乳链球菌和海豚链球菌生长的主要活性化合物是高含量的aternariol(1),并通过HPLC分析和薄层点板分析,发现组分Fr.6~Fr.10中都含有大量的化合物1和2,其中化合物1是主峰,推测抗菌活性较好的组分Fr.6~Fr.10都主要通过化合物1起抗菌作用。导致化合物1和2交叉分布在这些组分中的原因,是由于经正相硅胶柱分离粗提物时高含量的化合物1和2微溶于冲洗用的二氯甲烷-甲醇溶剂系统。化合物1~6都属于苯并吡喃内酯类化合物,比较它们的结构和抗罗非鱼链球菌活性,推测苯环C-5上羟基和C7-C10a间共轭体系的存在对其抗菌活性起重要作用。
化合物1和2是常见的链格孢菌毒素,常可于谷物、水果、油菜、葵花籽、橄榄等食品中检测到。化合物1和2均有细胞毒活性,可通过诱导基因突变,促使DNA链在体外产生遗传毒性断裂,并抑制拓扑异构酶I和IIα[14],且2能诱导人结肠癌细胞的线粒体突变[15,22,23]。此外,化合物1有较好的抑制金色葡萄球菌、乳链球菌、大肠杆菌、铜绿假单胞菌的活性,MIC值均为7.82 μg/mL,并有强抑制植物病原真菌苹果腐烂菌、西瓜枯萎病菌、番茄灰霉菌和辣椒疫霉菌的活性,MIC值为15.63、7.82、1.96、3.91 μg/mL[24];化合物2对枯草芽孢杆菌、假单胞菌、拉尔斯顿氏菌、青枯菌、单胞菌也有抗菌作用,MIC50值分别为28.83、34.29、27.08、29.21、30.06 μg/mL[15]。在本研究中,我们首次发现化合物1有较强的杀死罗非鱼病原菌无乳链球菌和海豚链球菌的活性,且在菌株A.tenuissimaSCSIO41701中产量高,但鉴于该化合物作为真菌毒素有较强的毒性,后续能否开发用于罗非鱼链球菌病的防治还有待深入研究。
