葫蔓藤根茎总生物碱的化学成分和抗肿瘤活性研究
2021-11-03沈锦煌杨娜娜张艺凡郑卫敏马新华钟添华张永红
沈锦煌,杨娜娜,张艺凡,郑卫敏,马新华,钟添华,张永红*
1福建医科大学药学院,福州350122;2福建医科大学附属第一医院医学影像科,福州 350004;3自然资源部第三海洋研究所,厦门361006
葫蔓藤为马钱科(Loganiaceae)葫蔓藤属(Gelsemium)植物的全草。该属植物在全世界一共有三种,分别为葫蔓藤(GelsemiumelegansBenth.),主要分布在我国福建、浙江、云南、广西、广东、湖南、贵州、江西等南部地区及东南亚地区[1];常绿钩吻(GelsemiumsempervireusAit.)以及沼泽茉莉(GelsemiumromkimiiSmall.),主要分布于美洲国家[2]。葫蔓藤又名钩吻、断肠草、大茶药、猪人参等,为常绿木质藤本。全株有大毒,根、茎、枝、叶供药用,有消肿止痛、拔毒杀虫之效;民间有用于肝、胃、宫颈、乳腺、甲状腺等癌症的晚期治疗,有一定的疗效。生物碱是葫蔓藤中的主要化学成分。此外,还含有甾烷、三萜类、香豆素类等化合物。
近年来研究表明葫蔓藤总生物碱具有抗肿瘤、镇静镇痛、调节免疫功能等作用。有学者报道了吗啡、汉防己、延胡索等六种生物碱镇痛作用强弱的对比研究,发现葫蔓藤总生物碱提高痛阈的作用强度仅次于吗啡[3]。葫蔓藤乙醇提取物具有对抗环磷酰胺对小鼠的免疫抑制作用[4]。葫蔓藤总生物碱可显著促进正常小鼠巨噬细胞吞噬功能,对正常小鼠其他免疫功能无明显影响[4]。研究发现葫蔓藤的毒性主要来自吲哚类生物碱[5]。葫蔓藤总碱中许多单体化合物疗效高但毒性大,对该植物进行深入研究,为进一步开发利用葫蔓藤植物,寻找具有抗肿瘤,镇静镇痛等活性成分和以其为原料药合成活性更高的化合物具有重要意义。
1 材料与方法
1.1 仪器和试剂
实验所用仪器为AvanceⅡ 400 MHz核磁共振仪(Bruker Biospin);LCMS-2020质谱仪(日本岛津);Waters半制备高效液相色谱仪(美国Waters);170SX FT-IR红外光谱仪(Thermo Nicolet);FD-2系列冷冻干燥机(北京博医康实验仪器有限公司);BUCHI Ropavapor R-200旋转蒸发仪(瑞士BUCHI公司);MCI填料(日本三菱化学株式会社);Sephadex LH-20 (瑞典GE Healthcare);柱色谱和薄层色谱硅胶均为青岛海洋化工厂产品;96孔细胞培养板(美国Lab serv);倒置显微镜(日本Olympus公司);超净工作台(上海整新SZX-7P);5%CO2及饱和湿度孵育箱(美国Thermo Forma公司);台式高速离心机(美国Beckman公司);酶标仪(美国Thermo公司Multiskan FC型)。
实验所用氘代试剂为CDCl3、CD3OD(美国Sigma公司);其他试剂均为分析纯;RPMI 1640培养基(美国Gibco公司);噻唑蓝(MTT)(美国Gibco公司);胎牛血清(美国Gibco公司);DMSO、链霉素、青霉素(武汉塞维尔生物科技有限公司);胰蛋白酶(武汉塞维尔生物科技有限公司);小鼠胚胎成纤维细胞(NIH3T3)、人肝癌细胞(HepG2)、人慢性髓系白血病细胞(K562)、人肺癌细胞(A549)(中国科学院上海生物化学与细胞生物学研究所)。
1.2 材料
实验使用的葫蔓藤根茎于2014年10月采摘于福州市台江区,由福建医科大学天然药物学系张永红教授鉴定为葫蔓藤(GelsemiumelegansBenth.),标本(No.zyh20141002)存放于福建医科大学药学院天然药物化学教研室。
1.3 提取与分离
取干燥的葫蔓藤根茎5 kg,粉碎,置于容量为20 L的下口瓶中。甲醇室温浸泡一周后,回收溶剂得醇提浸膏,用同样方法再提取2次,合并醇提浸膏。用2%HCl溶解浸膏,抽滤,得滤液。滤液先用300 mL氯仿萃取,除去脂溶性杂质,加5 mol/L NaOH碱化调pH>11得到红棕色沉淀[6]。然后分别用氯仿、乙酸乙酯和正丁醇各萃取3次,合并萃取液,回收溶剂,分别得到氯仿萃取物(45.1 g)、乙酸乙酯萃取物(323.5 g)、和正丁醇萃取物(77.6 g)。将氯仿萃取物和乙酸乙酯萃取物合并,用等量的硅胶(100~200目)拌样,湿法装柱,干法上样,洗脱剂为二氯甲烷-甲醇(1∶0~0∶1)梯度洗脱,每500 mL为一馏分,回收溶剂合并得到6个馏分,Fr.1~Fr.6。Fr.1(67.2 g)经Sephadex LH-20凝胶柱(CH2Cl2∶CH3OH=1∶1)洗脱,再经半制备高效液相色谱(C18柱,甲醇∶水=65∶35)分离纯化得到化合物1(25.0 mg)、2(23.0 mg)、3(10.0 mg)、6(12.0 mg)。Fr.3(56.1 g)经Sephadex LH-20柱(CH2Cl2∶CH3OH=1∶1)洗脱,再经半制备高效液相色谱(C18柱,甲醇∶水=55∶45)分离纯化得到化合物9(9.0 mg)。Fr.4(87.6 g)经Sephadex LH-20柱(CH2Cl2∶CH3OH=1∶1)洗脱,再经半制备高效液相色谱(C18柱,甲醇∶水=45∶55)分离纯化得到化合物4(5.0 mg)、5(50mg)、7(10.0 mg)、8(15.0 mg)。
1.4 抗肿瘤活性筛选
采用MTT法[7]测定部分单体化合物对人肝癌细胞(HepG2)、人肺癌细胞(A549)、人慢性髓系白血病细胞(K562)、小鼠胚胎成纤维细胞(NIH3T3)的体外抗肿瘤活性。用含10%胎牛血清的RPMI 1640培养液配成单个细胞悬液,以约3×104~6×104个/mL,接种于96孔培养板上,每孔体积100 μL,每个浓度设定3个复孔,重复进行两次平行实验,过夜培养使其贴壁。取适量预先用二甲基亚砜配制的50 mg/mL药物,用培养基配置成浓度160、80、40、20、10、5、2.5、1.25 μM的溶液,吸取96孔板中原培养液,加入上述不同浓度的药物溶液,每孔100 μL,在37 ℃条件下培养48 h后,加入20 μL MTT溶液(用PBS配制,pH=7.4),继续培养4 h,通过离心,弃去上清,随后每孔加入二甲基亚砜150 μL,震荡10 min,用酶标仪(BIO-RAD)于490 nm处测量各孔的OD(吸光度)值,各组取平均值,根据平均值计算抑制率,用SPSS12.0进行统计学分析,并计算IC50(半数抑制浓度)值。
抑制率=(OD空白-OD给药)/OD空白×100%
2 实验结果
2.1 结构鉴定
化合物1无色针状结晶(甲醇);化学式为C20H22N2O2,ESI-MS:m/z323.3[M+H]+。1H NMR(400 MHz,CD3OD)δ:7.34(1H,d,J= 7.8 Hz,H-9),7.18(1H,t,J= 7.8 Hz,H-11),6.96(1H,t,J= 7.8 Hz,H-10),6.23(1H,d,J= 7.8 Hz,H-12),6.21(1H,dd,J= 10.7,15.5 Hz,H-19),5.02(1H,d,J= 10.7 Hz,H-18b),4.93(1H,d,J= 12.0 Hz,H-18a),3.95(1H,dd,J= 2.0,10.7 Hz,H-17b),3.93(1H,dd,J= 2.0,10.7 Hz,H-17a),3.69(1H,s,H-3),3.58(1H,s,H-5),2.80(1H,d,J= 10.2 Hz,H-21b),2.74(1H,dd,J= 2.5,14.1 Hz,H-14b),2.46(1H,d,J= 10.2 Hz,H-21a),2.36(1H,br d,J= 8.5 Hz,H-16),2.31(1H,m,H-15),2.25(3H,s,N-Me),1.98(1H,m,H-14a),1.97(1H,d,J= 2.3 Hz,H-6);13C NMR(100 MHz,CD3OD)δ:180.6(C-2),70.9(C-3),73.2(C-5),52.0(C-6),55.5(C-7),133.1(C-8),129.2(C-9),122.6(C-10),129.5(C-11),110.4(C-12),142.6(C-13),23.7(C-14),37.0(C-15),38.9(C-16),62.2(C-17),113.0(C-18),139.7(C-19),55.0(C-20),66.5(C-21),40.4(N-Me)。以上数据与文献[8]报道基本一致,故鉴定该化合物为钩吻碱甲(结构见图1)。
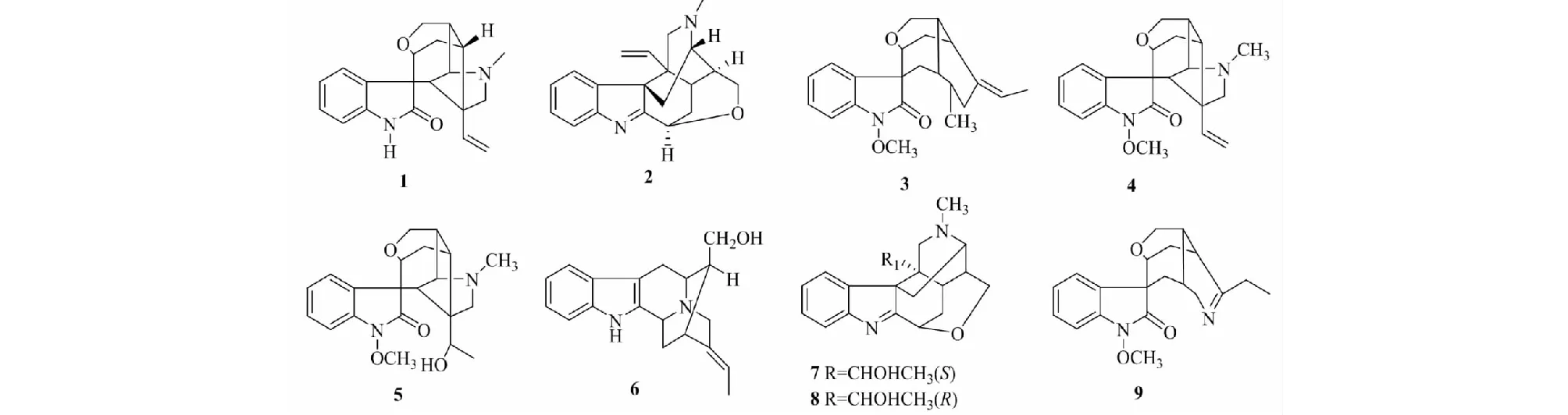
图1 化合物1~9的化学结构Fig.1 The chemical structures of compounds 1-9
化合物2无色柱状结晶(氯仿);化学式为C20H22N2O,ESI-MS:m/z307.6[M+H]+。1H NMR(400 MHz,CDCl3)δ:7.61(1H,d,J= 5.2 Hz,H-12),7.54(1H,d,J= 5.2 Hz,H-9),7.36(1H,t,J= 5.2 Hz,H-11),7.25(1H,t,J= 5.2 Hz,H-10),5.01(1H,s,H-3),4.84(1H,dd,J= 1.2,10.7 Hz,H-18β),4.79(1H,dd,J= 1.2,12.0 Hz,H-18α),4.68(1H,dd,J= 6.1,8.1 Hz,H-19),4.26(1H,dd,J= 1.4,11.0 Hz,H-17β),3.60(1H,d,J= 11.0 Hz,H-17α),3.16(1H,s,H-21β),3.07(1H,s,H-21α),2.80(1H,m,H-16),2.78(1H,m,H-5),2.62(3H,s,N-Me),2.61(1H,m,H-14β),2.41(1H,m,H-6α),2.36(1H,m,H-6β),2.32(1H,m,H-15),1.89(1H,dt,2.1,12.1 Hz,H-14α);13C NMR(100 MHz,CDCl3)δ:185.4(C-2),70.9(C-3),56.8(C-5),28.5(C-6),57.9(C-7),143.6(C-8),122.9(C-9),125.9(C-10),128.1(C-11),120.9(C-12),154.8(C-13),25.2(C-14),33.0(C-15),38.7(C-16),61.3(C-17),115.7(C-18),137.2(C-19),45.2(C-20),57.7(C-21),42.6(N-Me)。以上数据与文献[9]报道基本一致,故鉴定该化合物为钩吻素子。
化合物3淡黄色块状结晶(甲醇);化学式为C21H26N2O3,ESI-MS:m/z355.4[M+H]+。1H NMR(400 MHz,CD3OD)δ:7.48(1H,d,J= 4.4 Hz,H-9),7.34(1H,t,J= 5.6 Hz,H-11),7.15(1H,t,J= 5.2 Hz,H-10),7.06(1H,d,J= 5.2 Hz,H-12),5.47(1H,q,J= 4.4 Hz,H-19),4.24(1H,d,J= 7.6 Hz,H-17a),4.04(1H,d,J= 3.6 Hz,H-17b),3.98(3H,s,N-OMe),3.56(1H,d,J= 4.8 Hz,H-3),3.47(2H,m,H-21),3.38(1H,m,H-5),2.62(1H,m,H-15),2.47(1H,dd,J= 5.2,16.0 Hz,H-6b),2.36(3H,s,N-Me),2.30(1H,m,H-16),2.29(2H,m,H-14),1.74(1H,dd,J= 5.6,15.3 Hz,H-6a),1.68(3H,d,J= 4.4 Hz,H-18);13C NMR(100 MHz,CD3OD)δ:176.1(C-2),73.6(C-3),62.7(C-5),29.2(C-6),56.7(C-7),130.4(C-8),127.4(C-9),124.4(C-10),129.4(C-11),108.5(C-12),139.9(C-13),26.9(C-14),35.7(C-15),38.6(C-16),67.5(C-17),12.9(C-18),121.2(C-19),138.2(C-20),46.4(C-21),42.6(N-Me),64.0(N-OMe)。以上数据与文献[10]报道基本一致,故鉴定该化合物为葫蔓藤碱乙。
化合物4淡黄色固体(甲醇);化学式为C21H24N2O3,ESI-MS:m/z353.7[M+H]+。1H NMR(400 MHz,CD3OD)δ:7.55(1H,d,J= 7.5 Hz,H-9),7.34(1H,m,H-11),7.09(1H,m,H-10),7.04(1H,d,J= 7.5 Hz,H-12),6.20(1H,dd,J= 5.1,10.7 Hz,H-19),5.08(1H,dd,J= 5.1,12.0 Hz,H-18α),5.00(1H,dd,J= 5.1,12.0 Hz,H-18β),4.08(1H,m,H-17α),3.96(3H,s,N-OMe),3.91(1H,m,H-17β),3.71(1H,m,H-3),3.52(1H,s,H-5),2.82(1H,dd,J= 2.5,14.2 Hz,H-14α),2.77(1H,d,J= 10.4 Hz,H-21α),2.46(1H,d,J= 7.8 Hz,H-16),2.36(1H,d,J= 10.4 Hz,H-21β),2.33(1H,m,H-15),2.25(3H,s,N-Me),2.04(1H,m,H-14β),1.95(1H,s,H-6);13C NMR(100 MHz,CD3OD)δ:173.2(C-2),69.3(C-3),71.9(C-5),50.8(C-6),52.2(C-7),128.0(C-8),128.2(C-9),122.6(C-10),127.8(C-11),107.0(C-12),139.3(C-13),35.6(C-14),22.5(C-15),37.5(C-16),62.5(C-17),112.4(C-18),137.9(C-19),53.7(C-20),65.2(C-21),38.9(N-Me),60.7(N-OMe)。以上数据与文献[11]报道基本一致,故鉴定该化合物为钩吻绿碱。
化合物5白色粉末(氯仿);化学式为C21H26N2O4,ESI-MS:m/z371.4[M+H]+。1H NMR(400 MHz,CDCl3)δ:7.31(1H,d,J= 2.5 Hz,H-9),7.04(1H,dt,J= 3.9,0.8 Hz,H-11),6.97(1H,d,J= 8.0 Hz,H-12),6.95(1H,dt,J= 0.8,7.8 Hz,H-10),5.50(1H,q,J= 7.5 Hz,H-19),4.15(1H,dd,J= 1.8,10.6 Hz,H-17α),3.97(3H,s,N-OMe),3.80(1H,s,H-3),3.46(1H,s,H-5),3.12(1H,d,J= 11.2 Hz,H-21α),2.61(1H,dd,J= 2.6,9.0 Hz,H-14α),2.45(1H,d,J= 11.2 Hz,H-21β),2.36(1H,m,H-16),2.24(3H,s,N-Me),2.05(1H,dd,J= 2.6,9.0 Hz,H-14β),2.01(1H,m,H-15),2.02(1H,dd,J= 2.0,11 Hz,H-17β)1.86(1H,s,H-6)1.17(3H,d,J= 7.5 Hz,H-18);13C NMR(100 MHz,CDCl3)δ:174.0(C-2),69.2(C-3),71.8(C-5),50.1(C-6),52.3(C-7),127.9(C-8),128.2(C-9),123.1(C-10),128.4(C-11),107.4(C-12),139.2(C-13),22.3(C-14),35.6(C-15),39.2(C-16),61.6(C-17),19.4(C-18),64.8(C-19),56.5(C-20),58.9(C-21),39.2(N-Me),63.4(N-OMe)。以上数据与文献[12]报道基本一致,故鉴定该化合物为19-(S)-羟基二氢钩吻绿碱。
化合物6无色片晶(甲醇);化学式为C19H22N2O,ESI-MS:m/z295.4[M+H]+。1H NMR(400 MHz,CD3OD)δ:7.41(1H,d,J= 8.0 Hz,H-9),7.28(1H,d,J= 8.0 Hz,H-12),7.04(1H,m,H-11),6.98(1H,m,H-10),5.40(1H,q,J= 6.1 Hz,H-19),4.23(1H,dd,J= 2.1,9.7 Hz,H-3),3.73(2H,m,H-21),3.63(1H,m,H-5),3.50(1H,dd,J= 4.1,12.7 Hz,H-17β),3.49(1H,m,H-6β),3.30(1H,m,H-6α),3.24(1H,dd,J= 5.2,15.2 Hz,H-17α),2.71(1H,m,H-15),2.27(1H,m,H-16),2.17(1H,dd,J= 5.8,12.0 Hz,H-14β),1.88(1H,dd,J= 6.8,12.1 Hz,H-14α),1.64(3H,d,J= 10.8 Hz,H-18);13C NMR(100 MHz,CD3OD)δ:138.7(C-2),49.3(C-3),54.0(C-5),23.1(C-6),105.8(C-7),127.4(C-8),118.6(C-9),118.8(C-10),119.9(C-11),112.0(C-12),137.5(C-13),29.1(C-14),34.9(C-15),43.9(C-16),61.1(C-17),12.6(C-18),115.9(C-19),140.9(C-20),54.5(C-21)。以上数据与文献[13]报道基本一致,故鉴定该化合物为钩吻碱戊。
化合物7淡黄色粉末(甲醇);化学式为C20H24N2O2,ESI-MS:m/z325.6[M+H]+。1H NMR(400 MHz,CD3OD)δ:7.71(1H,d,J= 7.2 Hz,H-9),7.54(1H,m,H-12),7.39(1H,m,H-11),7.31(1H,m,H-10),4.90(1H,q,J= 5.1 Hz,H-19),4.30(1H,d,J= 1.6 Hz,H-21α),3.64(1H,d,J= 1.6 Hz,H-21β),3.62(1H,m,H-17β),3.62(1H,d,J= 9.5 Hz,H-3),3.59(1H,m,H-17α),2.98(1H,m,H-6β),2.96(1H,m,H-6α),2.95(1H,m,H-14β),2.83(1H,m,H-14α),2.71(1H,m,H-16),2.71(3H,s,N-Me),2.25(1H,m,H-15),0.67(3H,d,J= 6.3 Hz,H-18);13C NMR(100 MHz,CD3OD)δ:187.7(C-2),70.5(C-3),56.5(C-5),30.5(C-6),57.0(C-7),143.9(C-8),123.8(C-9),125.9(C-10),127.8(C-11),120.2(C-12),153.6(C-13),23.6(C-14),37.8(C-15),27.4(C-16),60.6(C-17),18.5(C-18),66.1(C-19),47.3(C-20),53.2(C-21),41.4(N-Me)。以上数据与文献[14]报道基本一致,故鉴定该化合物为19-(S)-钩吻醇碱。
化合物8淡黄色粉末(甲醇);化学式为C20H24N2O2,ESI-MS:m/z325.2[M+H]+。1H NMR(400 MHz,CD3OD)δ:7.68(1H,d,J= 7.2 Hz,H-9),7.43(1H,d,J= 7.6 Hz,H-12),7.20(1H,m,H-11),7.02(1H,m,H-10),5.13(1H,q,J= 5.5 Hz,H-19),4.22(1H,m,H-17β),4.15(1H,m,H-17α),3.93(1H,d,J= 9.5 Hz,H-3),3.64(1H,m,H-21β),3.52(1H,m,H-21α),3.17(1H,m,H-6β),3.00(1H,m,H-6α),2.50(3H,s,N-Me),2.46(1H,m,H-16),2.42(1H,m,H-15),2.31(1H,m,H-14β),2.29(1H,m,H-14α),0.95(3H,d,J= 6.5 Hz,H-18);13C NMR(100 MHz,CD3OD)δ:185.7(C-2),70.8(C-3),56.7(C-5),28.0(C-6),58.7(C-7),143.5(C-8),123.6(C-9),126.3(C-10),129.0(C-11),122.1(C-12),154.7(C-13),24.5(C-14),39.7(C-15),29.0(C-16),61.2(C-17),16.2(C-18),67.2(C-19),47.9(C-20),56.7(C-21),42.6(N-Me)。以上数据与文献[14]报道基本一致,故鉴定该化合物为19-(R)-钩吻醇碱。
化合物9淡黄色粉末(甲醇);化学式为C19H22N2O3,ESI-MS:m/z327.8[M+H]+。1H NMR(400 MHz,CD3OD)δ:7.54(1H,d,J= 6.8 Hz,H-9),7.28(1H,m,H-11),7.06(1H,m,H-10),6.94(1H,d,J= 7.5 Hz,H-12),4.31(1H,m,H-3),4.24(2H,m,H-17),3.65(1H,m,H-5),3.30(3H,s,N-OMe),2.97(1H,m,H-19α),2.59(1H,m,H-19β),2.58(1H,m,H-16),2.45(1H,m,H-15),2.31(1H,m,H-6α),2.30(1H,m,H-14β),2.29(1H,m,H-14α),2.26(1H,d,m,H-6β),1.23(3H,t,J= 6.6 Hz,H-18);13C NMR(100 MHz,CD3OD)δ:173.0(C-2),73.3(C-3),76.2(C-5),38.6(C-6),57.4(C-7),133.5(C-8),125.9(C-9),124.6(C-10),129.3(C-11),107.8(C-12),139.1(C-13),27.9(C-14),40.9(C-15),43.6(C-16),62.6(C-17),10.2(C-18),25.6(C-19),187.5(C-20),63.9(N-OMe)。以上数据与文献[15]报道基本一致,故鉴定该化合物为钩吻素己。
2.2 体外肿瘤细胞毒活性筛选
以五氟尿嘧啶(5-fluorouracil)为阳性药,对葫蔓藤根茎总生物碱分离得到的化合物1~9,共9个化合物进行了对人肝癌细胞(HepG2)、人肺癌细胞(A549)、人慢性髓系白血病细胞(K562)、小鼠胚胎成纤维细胞(NIH3T3)的体外抗肿瘤活性。实验结果见表1,化合物1~4和6,对人肝癌细胞株HepG2显示了很好的肿瘤细胞毒抑制活性,而化合物1~9对人肺癌细胞(A549)、人慢性髓系白血病细胞(K562)、小鼠胚胎成纤维细胞(NIH3T3)的肿瘤抑制活性较差。其中化合物2(钩吻素子)对HepG2的活性最好,IC50值达到了3.98±0.11 μM,化合物1和3对HepG2的IC50值分别为10.02±0.16和9.87±0.18 μM。
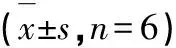
表1 化合物对HepG2、A549、K562和NIH3T3细胞株的细胞毒活性Table 1 Cytotoxicity of compounds on HepG2,A549,K562 and
3 结论
本研究采用硅胶柱色谱、MCI-gel、Sephadex LH-20、HPLC等方法对葫蔓藤根茎的总生物碱进行分离纯化,共分离得到9个吲哚类生物碱,分别为钩吻碱甲、钩吻素子、葫蔓藤碱乙、钩吻氯碱、19-(S)-羟基二氢钩吻氯碱、钩吻碱戊、19-(S)-钩吻醇碱、19-(R)-钩吻醇碱和钩吻素己。并对这9个吲哚类生物碱进行体外抗肿瘤活性测试,结果显示葫蔓藤生物碱对人肝癌细胞HepG2的抗肿瘤活性最好,而对A549、K562和NIH3T3的抑制作用较弱,钩吻碱甲、钩吻素子和葫蔓藤碱己对HepG2的IC50值分别为10.02±0.16、3.98±0.11和9.87±0.18 μM。其中钩吻素子对人肝癌细胞HepG2具有良好的细胞毒活性,具有一定的抗肿瘤药物开发潜力。本研究通过对葫蔓藤根茎总生物碱的化学成分和抗肿瘤活性的研究,进一步明确葫蔓藤的抗肿瘤活性的药效学基础,为葫蔓藤生物碱开发成为高效低毒的抗肿瘤药物提供一定的理论依据。
