激活前扣带皮层腺苷酸活化蛋白激酶对大鼠痛情绪和哺乳动物雷帕霉素靶蛋白活性的影响
2021-10-30卢波王瑞春王秋生孟波陈骏萍
卢波,王瑞春,王秋生,孟波,陈骏萍
疼痛的感觉部分和情绪部分由不同的神经传导通路传导,而且最终对其进行整合、调控和处理的大脑脑区也并不完全相同。研究表明,边缘系统中的前扣带皮层(ACC)与痛情绪的形成与维持密切相关[1-2],目前对其具体机制尚不清楚。哺乳动物雷帕霉素靶蛋白(mTOR)参与脊髓水平的痛觉中枢敏化和ACC脑区的痛情绪调控[3-5]。腺苷酸活化蛋白激酶(AMPK)是mTOR通路的上游信号分子,通过负性调控mTOR 通路参与蛋白质的合成,进而作用于脊髓背角神经元的中枢敏化[6]。但是,关于mTOR 通路调控痛情绪的形成过程是否依赖于AMPK 的活性变化,目前尚不清楚。基于此,本研究拟观察激活ACC 脑区AMPK 对大鼠痛情绪反应以及mTOR活性的影响。报道如下。
1 资料与方法
1.1 实验动物 雄性清洁级SD大鼠30只,体质量230 ~300 g,购自浙江省医学科学院实验动物中心,饲养于宁波大学SPF 级实验动物中心。本研究在实施前已获得宁波大学实验动物伦理委员会批准。
1.2 实验分组 将大鼠随机分为甲醛模型组(F组)、AMPK激动剂组(A组)和溶剂对照组(C 组),各10 只。所有大鼠均在七氟烷麻醉下建立甲醛炎性痛模型,在左侧足底皮下注射5%甲醛溶液50 l,建立模型。
1.3 方法 ACC脑区置管和药物输注大鼠麻醉后头部固定于脑立体定位仪上,门齿杆- 3.3 mm。检测是否固定成功的标准:鼻对正中,头部不动,提尾不掉。按照大鼠脑图谱选取ACC坐标(AP:+2.6mm,L:±0.6 mm,H:- 2.5 mm)。用牙科钻于进针点处钻一小孔,深度至硬脑膜。将外套管缓慢植入,并以牙托粉固定于颅骨表面。待牙托粉凝固后,外套管塞入长度较套管长0.2 mm 的不锈钢内芯并盖上导管盖。术后隔天插拔内芯一次,防止套管堵塞。
A 组和C 组于建模前20 min 经套管注射相应药物或溶剂。以七氟烷麻醉,将套管内芯拔出,插入注射内管,注射内管尖端长于套管0.2 mm,末端通过PE-10 软管连接微量进样器。双侧ACC给药,每侧注射0.5 l 药物或溶剂。其中,AICAR(Sigma公司,美国)用DMSO溶解,PBS稀释(DMSO终浓度为0.5%)为20 mol/L,溶剂对照为0.5% DMSO。在3 min 内注射完毕,随后留针5 min,防止液体溢出,使药液充分扩散。
1.4 甲醛条件位置回避训练(F-CPA)CPA 训练箱由3 个小室组成,其中A、B室等大并排放置,C室位于A、B室前方。A室壁为黑白相间的垂直条带,以1%醋酸溶液作为气味剂;B 室壁为黑白相间的水平条带,以1%桂皮水作为气味剂;C 室内壁灰色,无标记,无气味。
第1 天,将大鼠放入C室,待其进入A 或B 室后,关闭C 室与A、B 室间的小门,记录15 min 内动物在A、B 室的停留时间。第2 ~3 天,大鼠不经任何处理直接放入甲醛非条件匹配室,任其在内自由活动45 min。间隔4 h 后,大鼠左侧足底注射甲醛或0.9%氯化钠注射液后放入甲醛条件匹配室(A 或B 室,信封法随机选择),同样使其在内45 min 后取出。第4 天,操作过程同第1 天,记录大鼠15 min 内在A 和B 室所停留的时间。计算回避分数(训练前后在甲醛条件室停留的时间差值)以评价大鼠是否形成条件性位置回避,回避分数越高提示痛情绪越显著。
1.5 免疫印迹 CPA行为学结束后,大鼠被过量的七氟烷麻醉处死,取ACC(AP 3.7 ~0.7 mm)。加入裂解液并破碎组织,4 ℃离心30 min,取适量上清液用BCA 试剂盒测蛋白浓度。剩余上清液取适量,按上清液:5×Loading buffer为4:1 的量加入5×Loading buffer。放入99.9 ℃水浴煮沸5 ~10 min,之后将样品分装―80℃条件保存。
根据蛋白浓度确定上样量。电压设定60 V 待条带压成一条线后调整为80 V 跑胶,结束后用100 V,90 min 转膜。转膜前需先用甲醇活化PVDF 膜。转膜后加入5 ml 封闭液室温封闭1 h。封闭后加兔来源的抗磷酸化mtor(Ser2448,cat no.2971,1∶500,CST 公司)和小鼠来源抗-actin抗体(1∶2 000,Santa cruz公司)4 ℃摇床孵育过夜。用1×TBST 清洗之后加二抗室温避光孵育1 h 后,红外荧光扫描仪曝光。使用ImageJ 软件(NIH,Bethesda,MD USA)对Western blot 结果的灰度图像进行半定量分析。
1.6 统计方法 数据采用GraphpadPrism7.0 统计软件分析,计量资料采用均数±标准差表示,两组间比较采用t检验,多组间比较采用F检验,多重比较采用Bonferroni检验。P<0.05 为差异有统计学意义。
2 结果
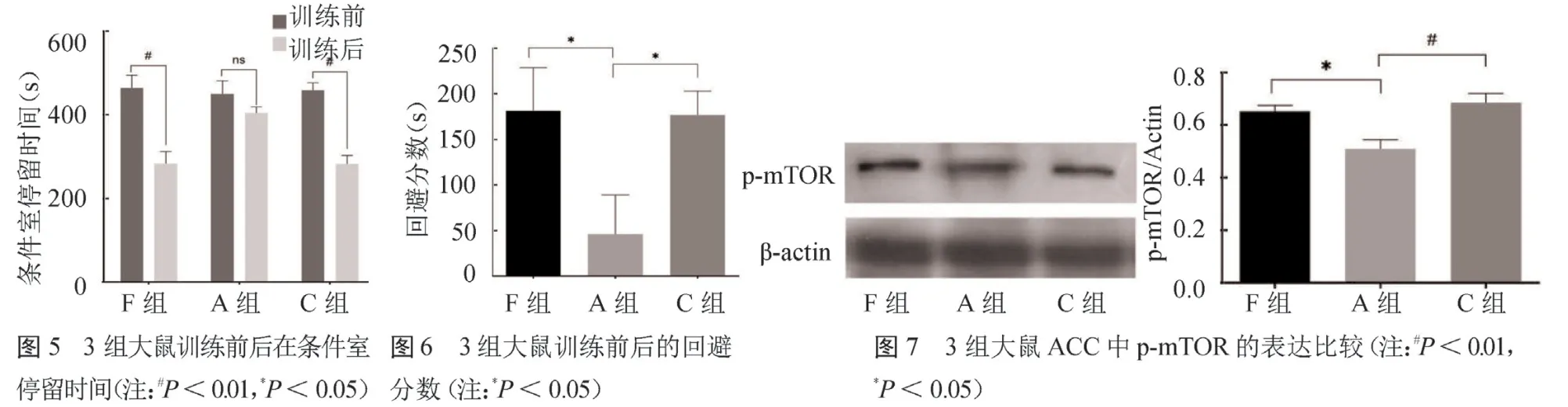
2.1 痛情绪比较 与CPA 训练之前相比,F 组和C 组大鼠训练后在条件室内停留时间明显减少(t=4.34、6.63,均P<0.01)。A 组大鼠训练前后在条件室内停留时间差异无统计学意义(t=1.34,P>0.05)。3 组大鼠回避分数差异有统计学意义(F=3.68,P <0.05),其中A 组回避分数显著低于C 组和F 组(t=2.39、2.30,均P <0.05)。见封四彩图5 ~6。
2.2 ACC中mTOR磷酸化形式(p-mTOR)的表达 3 组大鼠ACC 中p-mTOR 表达差异有统计学意义(F=8.67,P <0.01),其中A组显著低于F组和C组(t=2.39、2.30,均P <0.05)。见封四彩图7。
3 讨论
外周疼痛刺激信息经脊髓背角投射至高位中枢后,大脑的不同脑区以相互分工、相互联系的方式整合、处理和调控疼痛感觉和疼痛情绪信息,其中ACC主要负责处理疼痛相关的负性情绪信息,并促进疼痛相关情感、认知和反应的抉择[1-2,7]。然而,目前对其具体的细胞和分子机制了解较少。笔者前期研究表明,慢性疼痛(甲醛疼痛刺激)可诱导ACC内p-mTOR、p-p70S6K表达的显著上调,预先给予雷帕霉素可阻断痛情绪行为的产生[5]。在此基础上,本研究进一步发现,激活AMPK 同样能够削弱甲醛诱导的痛情绪,并且其机制可能与AMPK 负性调控mTOR 磷酸化表达降低有关。
研究显示,AMPK 通过对mTOR 信号通路的负性调控,参与了痛觉中枢敏化的形成[8-10]。脊神经结扎的动物模型上,脊髓背角p-AMPK 的表达显著减少[10];AMPK 激动剂可抑制mTOR 的活性和下游翻译元件的表达,抑制蛋白翻译,进而减轻外周神经损伤或手术切口引起的触诱发痛;并且,AMPK激动剂可显著降低离体背根神经节神经元的兴奋性[8-9]。这些研究证据提示了AMPK/mTOR 通路在慢性疼痛中发挥着重要作用。本研究结果初步提示了ACC 脑区中AMPK通过调控其下游mTOR通路参与痛情绪的形成和发展,但是仍有诸多问题尚需进一步研究,如:(1)慢性疼痛的经典分子ERK 同样受AMPK 的调控[9],那么ERK通路与mTOR通路是否存在关联?(2)AMPK 目前有多种激动剂,如AICAR、二甲双胍等[11],不同的激动剂是否产生同样的镇痛效果?(3)F-CPA 将疼痛与情绪分开,目的是为了在研究痛情绪时不受痛感觉的干扰,然而近年来痛与负性情绪(如抑郁)共患也是疼痛研究热点,AMPK-mTOR 通路在不同痛情绪模型中的作用也值得研究者进行探讨。
综上所述,激活ACC脑区AMPK能够削弱甲醛炎性痛诱导的痛情绪,其机制与AMPK 调控mTOR 活性的变化有关。
