高血压左心室肥厚患者血清miR-21、TGF-β1表达及临床意义*
2021-10-30吴立国高景芳张书春
吴立国,高景芳,张书春,夏 娟
1.唐山南湖医院心血管内科,河北唐山 063000;2.唐山工人医院心内二科,河北唐山 063000
高血压是心血管疾病常见的危险因素,可导致器官损害和功能障碍,特别是对心脏射血功能造成巨大负荷。长期的高血压会增加左心室负荷,使左心室形态、结构及功能发生改变,导致左心室肥厚[1]。高血压左心室肥厚发病机制目前还没有明确,有学者认为心肌纤维化、心肌细胞凋亡可能与高血压左心室肥厚的发病机制有关[2]。目前研究结果发现,微小RNA(miRNA)可调控高血压及其相关疾病的基因表达[3-4]。miR-21作为一类新型内源性调节因子,可促进心肌纤维化进展[5]。多种生长因子对左心室肥厚的形成具有不可替代的作用,其中转化生长因子-β1(TGF-β1)是最有效、最普遍的调节心肌肥厚、促纤维生成的细胞因子[6]。已有研究证实,miR-21可通过靶向抑制信号转导蛋白7(Smad7),从而促进TGF-β1诱导心肌纤维化[7]。但关于miR-21和TGF-β1在高血压左心室肥厚的形成中作用的报道较少见。因此本研究将探讨miR-21和TGF-β1在高血压左心室肥厚患者血清中的表达水平及临床意义。
1 资料与方法
1.1一般资料 选取2019年10月至2020年10月唐山南湖医院心血管内科收治的原发性高血压患者122例作为研究对象,其中男64例,女58例,年龄48~70岁,平均(60.04±6.08)岁,病程5~16年,平均(11.57±3.01)年。收集患者入院静坐时收缩压、静坐时舒张压数据。纳入标准:(1)符合《中国高血压防治指南(2018年修订版)》中的诊断标准[8];(2)愿意配合此次试验者;(3)入选患者了解本次研究,并签署知情同意书。排除标准:(1)合并有恶性肿瘤患者;(2)除高血压外,患者有明确的心血管疾病史;(3)患者有自身免疫性疾病、造血系统疾病等。本研究通过唐山南湖医院伦理委员会批准。
1.2左心室肥厚判定方法 所有患者均由一名有经验的医师采用GE LOGIQ F Series型彩色多普勒超声诊断仪(美国GE公司)(探头频率10~12 MHz)测量室间隔厚度(IVST)、左心室舒张末期内径(LVEDD)和左心室后壁厚度(LVPWT)。根据Devereux校正公式:计算左心室质量(LVM),LVM=0.8×1.04×[(IVST+LVEDD+LVPWT)3-LVEDD3]+0.6。收集患者身高、体质量数据,根据身高和体质量计算体表面积(BSA),计算公式:BSA(女)=0.007 3×身高+0.012 7×体质量-0.210 6;BSA(男)=0.005 7×身高+0.012 1×体质量+0.088 2;BSA单位是m2,身高单位是cm,体质量单位是kg。根据BSA计算左心室质量指数(LVMI),LVMI=LVM/BSA。以男性LVMI≥115 g/m2,女性LVMI≥95 g/m2为判定左心室肥厚的判定标准[9]。本研究中高血压患者根据是否发生左心室肥厚分为左心室肥厚组35例和非左心室肥厚组87例。
1.3试剂及仪器 RNA提取试剂盒(批号R1200-100)购自北京索莱宝科技有限公司;逆转录试剂盒(批号QR0100)、荧光定量PCR试剂盒(2×SYBR Green qPCR Mix)(批号RR047A)、荧光定量PCR参比染料(ROX Reference Dye)(批号RS109)均购自日本Takara公司;人TGF-β1酶联免疫吸附(ELISA)试剂盒(批号DB100B)购自美国R&D公司;实时荧光定量PCR(qRT-PCR)仪(型号CFX96)、酶联免疫检测仪(型号680)均购自美国Bio-Rad公司。
1.4研究方法
1.4.1样品采集 采集所有患者清晨空腹静脉血5 mL装于普通采血管中,4 ℃,3 000 r/min,离心8 min,留上清液,冻存于-80 ℃冰箱中,待测。
1.4.2荧光定量PCR检测血清中miR-21的表达 使用RNA提取试剂盒提取样品中总RNA,检测所得RNA纯度,总RNA依照逆转录试剂盒,反转录为cDNA。采用qRT-PCR仪对miR-21及内参U6进行扩增反应,miR-21正向引物5′-AAA GTT GTA GTC AGA CTA TTC GAT-3′,反向引物5′-GCT GTC AAC GAT ACG CTA CGT-3′。内参U6正向引物5′-ATT GGA ACG ATA CAG AGA AGA TT-3′,反向引物5′-GGA ACG CTT CAC GAA TTT G-3′。引物由北京索莱宝科技有限公司合成。qRT-PCR反应体系20 μL:2×SYBR Green qPCR Mix 10 μL,正向和反向引物各2 μL,cDNA模板(50 ng/μL)1 μL,ROX Reference Dye 0.4 μL,ddH2O 4.6 μL。反应条件:95 ℃,5 min;95 ℃,30 s;60 ℃,30 s;72 ℃,30 s;38个循环。对miR-21相对表达量用2-ΔΔCt法计算。
1.4.3检测血清中TGF-β1水平 采用ELISA法检测血清中TGF-β1水平,操作步骤严格依据ELISA试剂盒说明书进行操作。
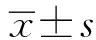
2 结 果
2.1左心室肥厚组和非左心室肥厚组患者基线资料比较 左心室肥厚组和非左心室肥厚组在性别、年龄上比较差异无统计学意义(P>0.05);与非左心室肥厚组相比,左心室肥厚组患者高血压病程、静坐时收缩压、静坐时舒张压较高,差异有统计学意义(P<0.05)。见表1。
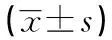
表1 左心室肥厚组和非左心室肥厚组患者基线资料比较
2.2左心室肥厚组和非左心室肥厚组患者IVST、LVEDD、LVPWT、LVMI水平比较 与非左心室肥厚组相比,左心室肥厚组患者IVST、LVEDD、LVPWT、LVMI水平较高,差异有统计学意义(P<0.05)。见表2。
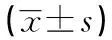
表2 左心室肥厚组和非左心室肥厚组患者IVST、LVEDD、LVPWT、LVMI水平比较
2.3左心室肥厚组和非左心室肥厚组患者血清miR-21和TGF-β1水平比较 与非左心室肥厚组相比,左心室肥厚组患者血清miR-21、TGF-β1水平较高,差异有统计学意义(P<0.05)。见表3。
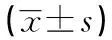
表3 左心室肥厚组和非左心室肥厚组患者血清miR-21和TGF-β1水平比较
2.4高血压患者血清miR-21、TGF-β1与IVST、LVEDD、LVPWT、LVMI的相关性分析 Pearson相关性分析显示,高血压患者血清miR-21与IVST、LVEDD、LVPWT、LVMI呈正相关关系(P<0.05),血清TGF-β1与IVST、LVEDD、LVPWT、LVMI呈正相关关系(P<0.05)。见表4。
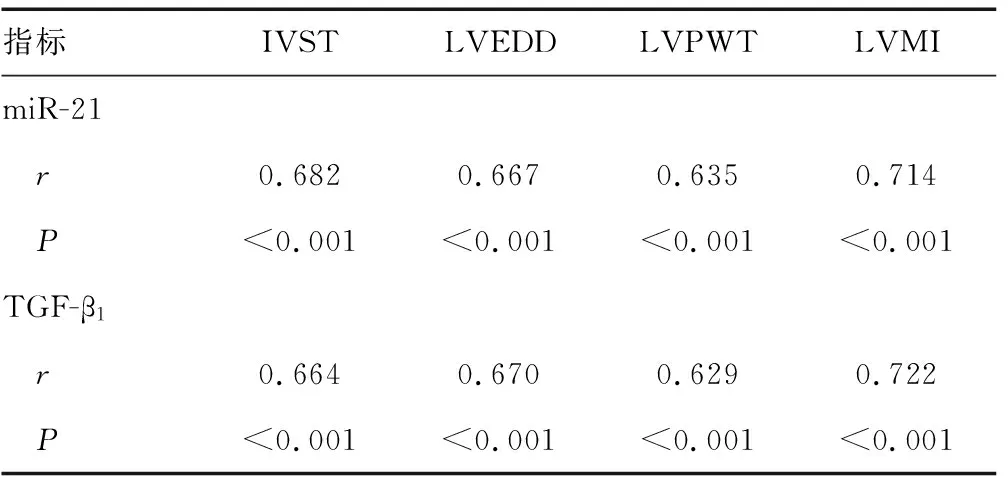
表4 高血压患者血清miR-21、TGF-β1水平与IVST、LVEDD、LVPWT、LVMI的相关性分析
2.5血清miR-21、TGF-β1及两者联合对高血压左心室肥厚诊断价值分析 绘制ROC曲线结果显示,miR-21、TGF-β1单项及联合检测诊断高血压左心室肥厚的曲线下面积(AUC)分别为0.882(95%CI:0.812~0.952)、0.847(95%CI:0.772~0.922)、0.947(95%CI:0.908~0.987)。见表5和图1。
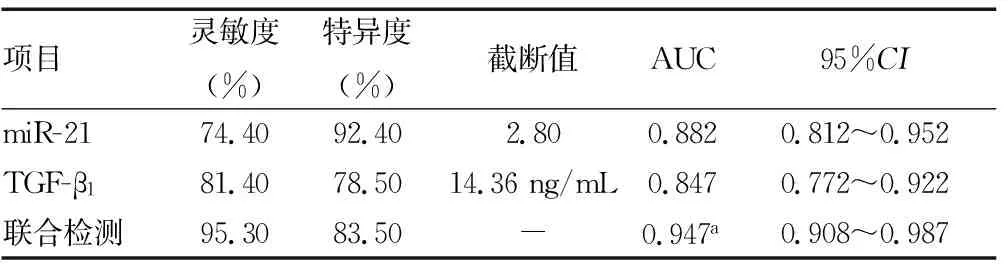
表5 血清miR-21、TGF-β1及两者联合对高血压左心室肥厚诊断价值

图1 ROC曲线分析血清miR-21、TGF-β1单项及联合检测对高血压左心室肥厚的诊断价值
3 讨 论
高血压是一种全身性慢性疾病,主要表现为体循环动脉血压升高。早期血压控制不好,持续升高,会使左心室心肌持续处于超负荷工作状态,导致左心室代偿性肥厚发生。另有报道显示,长期心脏压力负荷会刺激成纤维细胞增殖、心肌细胞胞外基质胶原过度沉积,最终导致心肌纤维化,促进左心室肥厚[10]。据报道,高血压患者发生左心室肥厚的概率为20.00%~30.00%,心室肥厚是心脏事件致死及全因死亡的独立危险因素[11]。分析左心室肥厚形成的机制有助于高血压左心室肥厚的诊断和治疗。
心肌成纤维细胞的增殖和心肌成纤维细胞向肌成纤维细胞转化是心肌纤维化的关键。TGF-β是结构和功能相关的多肽生长因子,可调节细胞的生长和分化,一共有5种亚型。目前哺乳动物中有TGF-β1、TGF-β2、TGF-β3。TGF-β1位于19q13染色体上,在体细胞系中分布最广泛、活性最强。TGF-β与多种疾病的发病机制相关,如肺纤维等纤维化疾病[12]。TGF-β1是心肌纤维化的主要调节因子,可通过TGF-β1/Smad信号通路减少细胞外基质降解,促进Ⅰ型胶原等蛋白合成,促进成纤维细胞分化[13]。夏勇等[14]报道高血压粥样硬化斑块患者和增厚患者TGF-β1水平明显高于颈动脉正常的高血压患者;高血压左心室肥厚患者TGF-β1水平明显高于无左心室肥厚患者,同时发现TGF-β1与LVMI水平呈正相关关系,表明TGF-β1与高血压患者左心室肥厚有关。本研究发现左心室肥厚组患者血清TGF-β1水平显著高于非左心室肥厚组患者,提示TGF-β1可能与高血压左心室肥厚发生有关系,进一步发现血清TGF-β1与IVST、LVEDD、LVPWT、LVMI呈正相关关系,进一步证实了TGF-β1可能参与高血压左心室肥厚的发生。ROC曲线分析发现血清TGF-β1对高血压左心室肥厚诊断的AUC为0.847,灵敏度为81.40%,特异度为78.50%,提示TGF-β1在临床上对高血压左心室肥厚的评估可能比较可靠。
miRNA是一类长度19~25个核糖核苷酸的单链小分子RNA,常作为内源性调节因子参与心脏疾病的发生过程,包括心肌纤维化[15]。与心肌纤维化有关的几种miRNAs中,miR-21因其靶点在肾、肝等多个器官的纤维化中发挥重要作用而受到特别关注[16-17]。人miR-21位于染色体17q23.2区域,与其他miRNA不同,其有独立的启动子区域。ZHOU等[18]在大鼠实验中发现miR-21能够靶向降解Jagged1蛋白,促进心肌成纤维细胞向肌成纤维细胞转化和心肌纤维化形成。薛贻敏等[19]在小鼠实验中发现,miR-21可促进慢性病毒性心肌炎小鼠心肌纤维化,这一过程是通过介导TGF-β1/Smad7信号通路实现的。孟华等[20]报道miR-21通过抑制Smad7表达,增强心脏成纤维细胞的增殖,加重心肌梗死后心肌纤维化,表明miR-21是作用于成纤维细胞,促进心肌纤维化,而非作用于心肌细胞本身,推测miR-21可能参与高血压左心室肥厚的心肌纤维化过程。周湘鸿等[21]报道高血压左心室肥厚患者miR-29b水平明显高于高血压非左心室肥厚患者,与高血压左心室肥厚呈正相关关系。本研究发现左心室肥厚组患者血清miR-21水平显著高于非左心室肥厚组患者,提示miR-21可能参与高血压左心室肥厚发生,猜测miR-21是通过促进成纤维细胞心肌纤维化,促进高血压患者左心室肥厚的发生。本研究发现血清miR-21与IVST、LVEDD、LVPWT、LVMI呈正相关关系,证实了miR-21与高血压患者的左心室肥厚发生具有紧密联系。ROC曲线分析发现miR-21对高血压左心室肥厚诊断的AUC为0.882,灵敏度为74.40%,特异度为92.40%;血清miR-21和TGF-β1联合对高血压左心室肥厚诊断的AUC为0.947,灵敏度为95.30%,特异度为83.50%,两者联合诊断的AUC显著高于单独诊断时AUC,提示两者联合检测对高血压左心室肥厚诊断效果可能更好。本研究从临床上分析了miR-21和TGF-β1对高血压左心室肥厚的评估价值,为预测高血压患者是否发生左心室肥厚提供了理论基础,为高血压左心室肥厚疾病在医学上的研究进展奠定基础。
综上所述,高血压左心室肥厚患者血清miR-21和TGF-β1水平上调,两者对高血压左心室肥厚具有较好的评估价值,两者联合诊断效果更好。
