转录因子TEAD4对猪早期胚胎发育的调控
2021-10-29张丹丹许腾腾高迪齐昕宁伟汝振远张翔栋郭腾龙申屠璐燕于童马洋洋李运生张运海曹祖兵
张丹丹,许腾腾,高迪,齐昕,宁伟,汝振远,张翔栋,郭腾龙,申屠璐燕,于童,马洋洋,李运生,张运海,曹祖兵
转录因子TEAD4对猪早期胚胎发育的调控
张丹丹,许腾腾,高迪,齐昕,宁伟,汝振远,张翔栋,郭腾龙,申屠璐燕,于童,马洋洋,李运生,张运海,曹祖兵*
安徽农业大学动物科技学院/地方畜禽遗传资源保护与生物育种安徽省重点实验室,合肥 230036
【背景】众所周知TEA结构域转录因子4(TEA domain transcription factor 4,TEAD4)是TEAD转录因子家族中的一员,在决定啮齿类动物着床前胚胎的特性中发挥关键作用。在小鼠胚胎中发现,可以通过促进表达来参与调控着床前胚胎滋养层细胞的谱系分化。若当小鼠胚胎中缺乏时可导致小鼠囊胚形成失败。然而,在猪早期胚胎发育中的作用尚不清楚。【目的】通过初步阐明对猪早期胚胎发育的影响,以期为进一步探索转录因子对猪早期胚胎发育的分子机制奠定理论基础。【方法】利用网页版工具对猪进行生物信息学分析,主要包括对猪序列的分析,猪与人、小鼠之间同源性的比较,以及在不同物种之间进化关系的比较。再通过试验检测在猪早期胚胎发育中的作用。首先采用荧光定量PCR技术检测在猪卵母细胞和早期胚胎中mRNA表达水平,再通过设计靶向TEAD4的siRNA,采用显微注射技术注入成熟卵母细胞中,降低卵胞质内源性的水平,并确定TEAD4 siRNA仅作用于,以期确定在猪早期胚胎发育中的作用。【结果】 序列分析结果显示:猪包含11个外显子,定位于5号染色体上,跨越长度37.188 kb,mRNA全长1 473 bp,编码区全长1 305 bp,编码434个氨基酸;与人、小鼠的同源性分析揭示在不同物种中的保守性较高;且在猪和牛上的亲缘关系最近。荧光定量PCR检测基因表达水平结果显示:mRNA在猪卵母细胞和早期胚胎中均有表达,且以GV期卵母细胞为参照时比较发现,MII期卵母细胞表达量最低,并保持较低水平直至4-细胞时期,但到8-细胞时期表达量达到最高,而到桑椹胚和囊胚时期又逐渐下降。通过显微注射靶向TEAD4的siRNA发现:TEAD4 siRNA仅作用于卵母细胞中内源性的,而对和不发挥作用;并与对照组和阴性对照siRNA组相比,注射TEAD4 siRNA显著降低8-细胞和桑椹胚时期mRNA表达量,敲低效率达到80%。当敲低表达时观察猪孤雌激活和体外受精胚胎的发育效率表明,与对照组和阴性对照siRNA组相比,显著降低TEAD4 siRNA敲低组从8-细胞至囊胚阶段的发育效率。【结论】在各物种间保守性高,在猪和牛上的亲缘性最近,可参与调控猪早期胚胎的发育。
猪;早期胚胎;;孤雌激活;体外受精
0 引言
【研究意义】猪作为重要的家畜和典型的疾病模型,其正常生长发育可促进畜牧业的稳定发展和推动生物医学进步[1-3]。以猪胚胎为基础延伸出的体外受精、体细胞核移植等辅助生殖技术在优良种猪选育、扩繁、种质资源保存、基因编辑猪创制、人类疾病模型制备及发育生物学基础研究等方面具有十分重要的应用价值[4-5]。然而,猪与其他动物(小鼠、牛及人)相比,体外生产的胚胎发育效率依然很低[6-7],究其原因主要是对猪着床前胚胎发育机制缺乏足够的了解。【前人研究进展】早期胚胎作为哺乳动物生长发育的起点,将经历精卵结合形成单细胞受精卵、胚胎细胞分裂增殖、胚胎基因组激活、桑椹胚致密化和囊胚形成。囊胚是哺乳动物胚胎中最为独特的结构[7],主要包括早期囊胚、扩张囊胚和孵化囊胚3个阶段。随着囊胚的发育,外周细胞分化形成滋养外胚层(trophectoderm, TE),内部细胞集群形成内细胞团(inner cell mass, ICM)[8],即完成第一次谱系分化。第一次谱系分化在哺乳动物早期胚胎的发育中发挥着至关重要的作用[9]。已有研究发现,转录因子在滋养外胚层和内细胞团分化即第一次谱系分化中起主导作用[10]。在小鼠胚胎干细胞研究中发现,Oct4和Cdx2间的相互拮抗作用参与调控内细胞团和滋养外胚层的分化[11]。在小鼠着床前胚胎发育研究中发现,HIPPO信号通路的激活诱导下游效应蛋白YAP转移至细胞核,促使卵裂球向内细胞团发育,而当HIPPO信号失活时可以诱导YAP激活,并与转录因子TEAD4结合,从而介导滋养外胚层分化[12]。在猪着床前胚胎发育研究中发现,CDX2在囊胚后期滋养层中特异性表达,OCT4在内细胞团中特异性表达[13]。最新研究发现,OCT4和YAP均参与调控猪囊胚的形成[13-14]。TEAD(transcriptional enhanced associated domain)蛋白是HIPPO信号通路下游效应因子YAP结合的转录因子[15],可以调控细胞增殖、干细胞命运等生物学过程[16-17]。TEAD蛋白家族包括4个成员,即:TEAD1、TEAD2、TEAD3和TEAD4。研究发现,TEAD1可促进心脏特定基因的表达,对心肌分化十分重要[18];TEAD2可能参与调控神经发育相关的基因;YAP/TEAD3可以共同调控由人多能干细胞诱导而成的心肌细胞分化[19];TEAD4与胚胎植入密切相关[20]。有研究发现,TEAD4可以参与调控基因转录[21],介导哺乳动物早期胚胎中第一次谱系分化的发生[22]。同时,TEAD4对小鼠早期胚胎发育中滋养层细胞的形成和发育也至关重要[23-24]。但随着进一步研究发现,TEAD4在小鼠囊胚形成和发育中的作用仍存在一定的争议。如:早期研究发现常规氧分压条件下TEAD4敲除并没有影响囊胚形成,而最新研究发现低氧条件下,TEAD4敲除导致胚胎发育阻滞未能形成囊胚[25]。此外,TEAD4还对早期胚胎发育中能量平衡维持发挥关键作用[26]。另外,发现TEAD4和CCN2相互作用是牛囊胚滋养层细胞发育中相关基因表达所必需的[27]。【本研究切入点】综合以上研究表明,TEAD4在哺乳动物早期胚胎发育中具有极其重要的作用,但TEAD4在猪早期胚胎发育中的作用和功能仍需进一步研究和发现。【拟解决的关键问题】本试验以猪胚胎为研究对象,旨在揭示TEAD4在猪早期胚胎发育中的作用,为深入研究TEAD4调控猪早期胚胎发育机制奠定基础,以及为提高胚胎正常生长发育,最终推动畜牧业和农业经济的快速稳定发展提供可能。
1 材料与方法
所有试验均于2018年12月至2019年6月在安徽农业大学地方畜禽遗传资源保护与生物育种安徽省重点实验室完成。Control组为未注射任何siRNA,未经任何处理的组别,negative control注射阴性对照siRNA组。
1.1 材料
获取合肥雨润屠宰场杜洛克×长白×大白三元杂交母猪卵巢和合肥安泰种猪育种公司成年公猪精液。
1.2 试剂
除特殊标注和说明外,本试验中所有化学试剂和用品均从美国Sigma公司购买。
1.3 试验方法
1.3.1 猪生物信息学分析 首先,利用NCBI和UCSC官网查找猪TEAD4基因生物学信息,包含外显子个数、染色体定位、跨越长度、mRNA 长度、CDS 长度、编码氨基酸个数、以及CDS和AA序列等。根据不同物种CDS和AA序列,利用DNAMAN和MEGA软件分别比较在不同物种间的同源性,以及分析在不同物种间的进化关系。
1.3.2 猪卵母细胞体外成熟 用含双抗的生理盐水将卵巢清洗干净后置于38.5 ℃水浴锅中,一次性注射器抽取直径3—6 mm卵泡中的卵泡液。将卵泡液转移至15 mL离心管中静置沉淀。用巴斯德吸管弃去上清,加入15 mL洗卵液吹打混匀,平均分至四个直径为60 mm培养皿中,挑选出胞质致密均匀且包裹2层及以上的卵丘卵母细胞复合物(cumulus-oocyte complexs, COCs)。用体外成熟液清洗COCs后转移至已加入猪体外成熟液(TCM199基础培养基中加入P.G-600、胎牛血清、猪卵泡液、青霉素和链霉素、L-半胱氨酸、表皮生长因子)的四孔板中(100枚/孔),38.5 ℃、5 % CO2培养箱中培养40—44 h。将成熟后COCs移入透明质酸酶液滴中,用移液器反复吹打去除周围包裹的卵丘细胞,再用T2(TCM199基础培养基 + 2 % 胎牛血清)液滴将卵母细胞清洗干净并移至T2液滴的培养皿,挑选排出第一极体的MII期卵母细胞备用。
1.3.3 显微注射 提前做好操作带并放入培养箱中预热平衡,将挑选出的MII期卵母细胞移入操作带下方,在显微操作仪上开始注射。先用固定针固定一枚MII期卵母细胞,用注射针拨动卵母细胞找到第一极体,将极体调至6点或12点钟方向。注射针吸取10 pL siRNA(表1)后从3点钟方向进针,破膜完成后匀速注入siRNA。结束后将MII期卵母细胞移入PZM-3培养皿中恢复15 min。
1.3.4 孤雌激活及胚胎培养 38.5℃提前预热f 2(向胚胎培养水中分别加入PVA、CaCl2·2H2O、甘露醇、MgCl2·6H2O、和HEPES)、PZM-3液体(向胚胎培养水中分别加入MgSO4、KH2PO4、NaCl、KCl、NaHCO3、青霉素和链霉素、丙酮酸钠、L-谷氨酰胺、亚牛磺酸、肌醇、乳酸钙、胎牛血清以及必需氨基酸和非必需氨基酸),先用f 2液体将排除第一极体的MII期卵母细胞清洗2遍。放入1枚MII期卵母细胞于融合槽中试电,通电后将余下MII期卵母细胞移入融合槽并一字排开,进行一次电激活(直流电 156 V、80 μs)。结束后将MII期卵母细胞移出并用PZM-3液体清洗2遍,移入PCC(向配制好的PZM-3培养液中加入细胞松弛素和放线菌酮)培养皿中,38.5 ℃、5% CO2培养箱中化学激活4 h。4 h后将胚胎移入PZM-3培养皿中,38.5 ℃、5 % CO2培养箱中培养7 d。
1.3.5 体外受精及胚胎培养 第一,处理精液:取两头不同品种的猪(如:大白和杜洛克)精液各3 mL于15 mL离心管并吹打混匀。取1 mL混合均匀后的精液于1.5 mL离心管中,共2管,1 200 r/min离心3 min。弃上清加入1 mL 精子洗涤液(向杜氏磷酸盐缓冲液中加入他牛血清以及青霉素和链霉素),吹打混匀后1 200 r/min离心3 min;弃上清加入1 mL 猪体外受精液(向胚胎培养水中分别加入NaCl、KCl、Tris、D-葡萄糖、CaCl2·2H2O、丙酮酸钠、咖啡因和胎牛血清),吹打混匀后1 200 r/min离心3 min;弃上清加入1 mL 猪体外受精液,吹打混匀后转移至新的1.5 mL离心管,38.5 ℃、5 % CO2培养箱中上浮1 h。第二,精子上浮30 min后用猪体外受精液将MII期卵母细胞清洗干净,每50 μL猪体外受精液滴中放入15枚MII期卵母细胞。精子上浮1 h后,检测精子密度和精子活力并将精液浓度调为2× 105个/mL。接着向猪体外受精液滴中依次加入50 μL稀释好的精液,38.5℃、5 % CO2培养箱中孵育5 h。5 h后,将卵母细胞移入PZM-3液体中,用移液器反复吹打直至卵母细胞透明带上无精子附着,接着分别对negative control和siRNA组卵母细胞显微注射negative control siRNA和siRNA。最后转移至PZM-3四孔板中,38.5 ℃、5 % CO2培养箱中培养7 d。
1.3.6 荧光定量PCR 定量试剂盒(AceQ qPCR SYBR Green Master Mix, Vazyme, 中国南京),按下述配制反应体系:2×SYBR Green 7.5 μL,50×Dye 1 0.3 μL,cDNA 1.5 μL,Forward Primer 0.5 μL,Reverse primer 0.5 μL,RNase-free water 4.7 μL(引物详细信息见表2)。混匀后加入八连管,盖好管盖,并置于PCR仪器中。反应条件如下:95 ℃、10 min,95 ℃、10 s,60 ℃、1 min,最后两步循环数为40。注意:试验中每3个复孔作为技术重复,同时要根据试验需要适当调整反应体系。
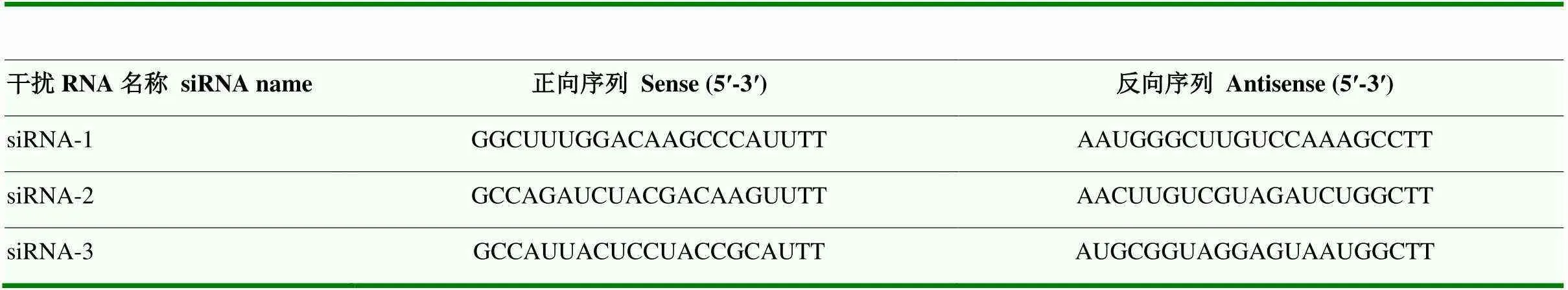
表1 TEAD4 siRNA序列

表2 试验所用引物
2 结果
2.1 猪TEAD4生物信息学分析
2.1.1 猪序列分析 通过对猪结构分析,结果显示,包含11个外显子,定位于5号染色体上,跨越长度37.188 kb,mRNA全长1 473 bp,CDS全长1 305 bp,编码434个氨基酸(图1)。
2.1.2 猪、人和小鼠 TEAD4 基因同源性比较 通过比对猪、人和小鼠同源性,结果显示,在核苷酸水平上,猪与人、小鼠同源性分别为90.96 %、77.93 %;在氨基酸水平上,猪与人、小鼠同源性分别为95.85 %、82.95 %(表2),表明在不同物种上都具有较高的保守性。
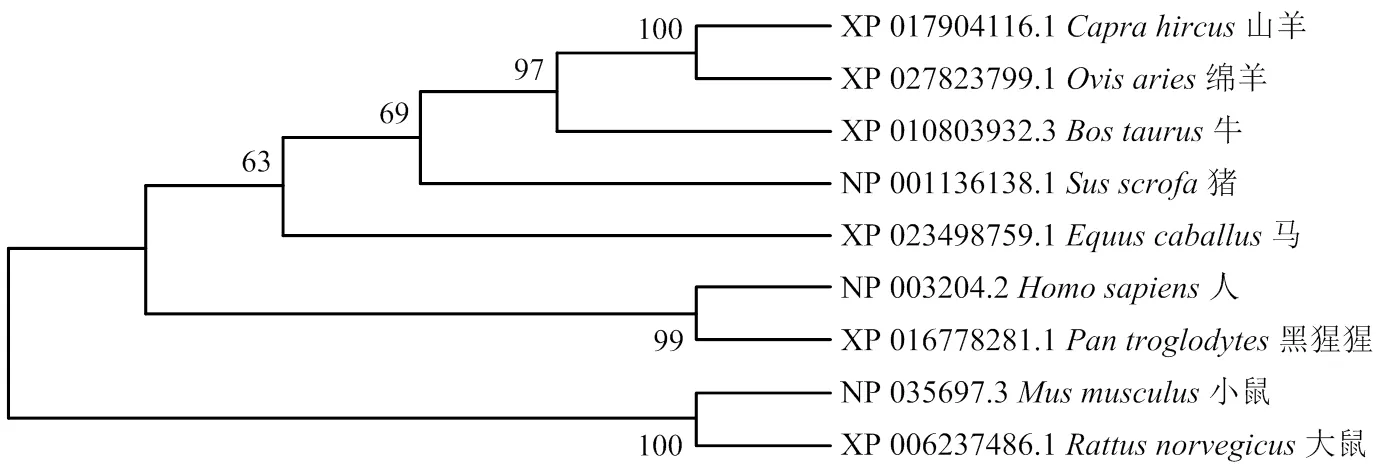
2.1.3在不同物种间的分子进化关系 通过比较在不同物种之间的进化关系,结果表明,在猪和牛上的亲缘关系最近(图2)。
2.2 猪早期胚胎发育中TEAD4 mRNA表达
利用荧光定量PCR技术检测猪早期胚胎发育中mRNA表达,结果显示,mRNA在猪卵母细胞和早期胚胎中均有表达,其中8-细胞时期表达量最高,其次是桑葚胚和囊胚时期,MII期卵母细胞表达量最低(图3)。

数字1-11代表TEAD4基因所包含外显子的位置 The numbers 1-11 represent the exon position of inTEAD4

表2 猪、人和小鼠TEAD4基因同源性比较
AA代表氨基酸水平 AA represents amino acid sequence

a,b,c,d字母表示存在显著性差异,P<0.05
2.3 TEAD4 siRNA特异性靶向TEAD4并有效降低猪早期胚胎TEDA4 mRNA表达
利用荧光定量PCR技术检测8-细胞和桑葚胚时期TEAD4 mRNA表达量,结果显示,与Control组和阴性对照 siRNA组相比,TEAD4 siRNA组中TEAD4 mRNA表达量均显著降低(图4-A、B),敲低效率达到80 % 。
另外,在注射TEAD4 siRNA后同样采用荧光定量PCR技术检测TEAD1、TEAD2和TEAD3 mRNA表达量,结果显示,相比较于对照组和阴性对照 siRNA组,TEAD4 siRNA组中TEAD1 mRNA和TEAD3 mRNA表达均无差异(图4-C、D),TEAD2 mRNA在对照组、阴性对照 siRNA组和TEAD4 siRNA组中均未检测到。表明TEAD4 siRNA对TEAD蛋白家族中除TEAD4外其他成员均无任何影响,TEAD4 siRNA特异性好,可用于后续研究。
2.4 TEAD4敲低对猪孤雌激活胚胎早期发育的影响
通过显微注射siRNA观察对猪孤雌激活胚胎早期发育的影响,结果显示,与对照组和阴性对照 siRNA组相比,siRNA组中8-细胞胚胎、桑葚胚和囊胚发育效率均显著降低(图5)。
2.5 TEAD4敲低对猪体外受精胚胎早期发育的影响
通过显微注射siRNA观察对猪体外受精胚胎早期发育的影响,结果显示,相比较对照组和阴性对照 siRNA组,siRNA组中8-细胞胚胎、桑葚胚和囊胚发育效率均显著降低(图6)。

图A和B: TEAD4 siRNA对8-细胞和桑葚胚中TEAD4 mRNA表达的影响; 图C和D:TEAD4 siRNA对TEAD1和TEAD3 mRNA表达的影响。a和b表示存在显著性差异,P<0.05。下同
3 讨论
本试验结果表明,TEAD4基因包含11个外显子,定位于5号染色体上,跨越长度37.188 kb,mRNA全长1 473 bp,CDS全长1 305 bp,编码434个氨基酸。并且通过比对不同物种中的CDS和AA序列,结果发现在不同物种上具有较高的保守性,据此推测在动物生长发育中具有重要作用,这为我们深入研究猪的生长发育机制提供理论依据。
本研究发现mRNA在猪早期胚胎发育中均有表达,其中MII期卵母细胞表达量最低,8-细胞时期表达量最高。与本研究结果不同的是,在牛上发现,mRNA和蛋白在8-细胞期、桑葚胚和囊胚期均有表达,但mRNA在8-细胞时期表达量较低,桑葚胚和囊胚时期表达量较高[28];在小鼠上发现,在早期胚胎发育过程中mRNA表达量逐渐增加[29]。以上研究表明mRNA在不同物种中的表达模式存在差异,具有物种多样性特征。与TEAD4转录本表达模式类似,TEAD4在动物早期胚胎发育中的作用也具有物种多样性,比如,敲低没有降低牛早期胚胎发育效率[28],但猪敲低显著降低早期胚胎发育效率。在小鼠囊胚时期,滋养外胚层和内细胞团中均有的表达,但因功能不同而发挥着不同的作用。值得注意的是,在囊胚细胞核和细胞质中的亚细胞定位是决定哺乳动物胚胎卵裂球发育命运的关键因素[22]。不仅是滋养外胚层特异性基因表达所必需的[23],也是小鼠早期胚胎发育中滋养层细胞发育所必需的特定转录因子[24]。在人胚胎干细胞中,缺失导致滋养细胞分化失败,但当对进行诱导表达时又可挽救滋养层细胞分化[30]。此外,还有研究发现,调节线粒体DNA转录是哺乳动物早期发育过程中调控能量代谢的方式之一,特别是可以通过调节滋养层细胞中能量代谢,从而保证哺乳动物囊胚形成和个体正常发育[25-26]。这一发现可以为今后深入研究猪早期胚胎发育过程中能量代谢机制提供重要的参考价值。

图5 TEAD4敲低对猪孤雌激活胚胎早期发育的影响(标尺= 50 μm)
综上所述,本研究结果加深了对猪早期胚胎发育过程中转录因子TEAD4功能的理解,为后续深入研究调控猪早期胚胎发育的分子机制奠定基础。

图6 TEAD4敲低对猪体外受精胚胎早期发育的影响(标尺= 50 μm)
4 结论
TEAD4基因在物种进化中具有较高的保守性;且在猪早期胚胎发育期间均有表达;参与调控猪早期胚胎发育。
[1] 颜泉梅, 赖良学.基因修饰猪模型应用于人类健康的相关研究进展.中国基础科学, 2015, 17(5): 20-27.doi:10.3969/j.issn.1009-2412.2015.05.004.
YAN Q M, LAI L X.Progress of genetically-modified pigs in the human health related research.China Basic Science, 2015, 17(5): 20-27.doi:10.3969/j.issn.1009-2412.2015.05.004.(in Chinese)
[2] 李文玲, 鲍磊, 肖磊.基因修饰猪作为异种器官移植供体的研究进展.中国细胞生物学学报, 2014, 36(9): 1300-1305.
LI W L, BAO L, XIAO L.The progress of genetic-modified pigs as donors in xenotransplantation.Chinese Journal of Cell Biology, 2014, 36(9): 1300-1305.(in Chinese)
[3] 黄耀强, 李国玲, 杨化强, 吴珍芳.基因编辑猪在生物医学研究中的应用.遗传, 2018, 40(8): 632-646.doi:10.16288/j.yczz.18-026.
HUANG Y Q, LI G L, YANG H Q, WU Z F.Progress and application of genome-edited pigs in biomedical research.Hereditas, 2018, 40(8): 632-646.doi:10.16288/j.yczz.18-026.(in Chinese)
[4] CHEN B Z, GU P, JIA J S, LIU W, LIU Y M, XU T, LIN X L, LIN T Y, LIU Y, CHEN H W, XU M C, YUAN J, ZHANG J N, ZHANG Y H, XIAO D, GU W W.Optimization strategy for generating gene-edited tibet minipigs by synchronized oestrus and cytoplasmic microinjection.International Journal of Biological Sciences, 2019, 15(12): 2719-2732.
[5] JUN S M, PARK M, LEE J Y, JUNG S, LEE J E, SHIM S H, SONG H, LEE D R.Single cell-derived clonally expanded mesenchymal progenitor cells from somatic cell nuclear transfer-derived pluripotent stem cells ameliorate the endometrial function in the uterus of a murine model with Asherman's syndrome.Cell Proliferation, 2019, 52(3): e12597.doi:10.1111/cpr.12597.
[6] GRUPEN C G.The evolution of porcine embryoproduction.Theriogenology, 2014, 81(1): 24-37.doi:10.1016/j.theriogenology.2013.09.022.
[7] PFEFFER P L.Building principles for constructing a mammalian blastocyst embryo.Biology (Basel), 2018,23;7(3):41.
[8] OESTRUP O, HALL V, PETKOV S G, WOLF X A.HYLDIG S, HYTTEL P.From zygote to implantation: morphological and molecular dynamics during embryo development in the pig.Reproduction in Domestic Animals, 2009, 44 (Suppl 3): 39-49.
[9] SAIZ N, PLUSA B.Early cell fate decisions in the mouse embryo.Development (Cambridge, England), 2013, 145(3): R65-R80.doi:10.1530/rep-12-0381.
[10] YAMANAKA Y, RALSTON A, STEPHENSON R O, ROSSANT J.Cell and molecular regulation of the mouse blastocyst.Developmental Dynamics, 2006, 235(9): 2301-2314.doi:10.1002/dvdy.20844.
[11] CHEN L, YABUUCHI A, EMINLI S, TAKEUCHI A, LU C W, HOCHEDLINGER K, DALEY G Q.Cross-regulation of the Nanog and Cdx2 promoters.Cell Research, 2009, 19(9): 1052-1061.doi:10.1038/cr.2009.79.
[12] NISHIOKA N, INOUE K, ADACHI K, KIYONARI H, OTA M, RALSTON A, YABUTA N, HIRAHARA S, STEPHENSON R O, OGONUKI N, MAKITA R, KURIHARA H, MORIN-KENSICKI E M, NOJIMA H, ROSSANT J, NAKAO K, NIWA H, SASAKI H.The Hippo signaling pathway components Lats and Yap pattern Tead4 activity to distinguish mouse trophectoderm from inner cell mass.Developmental Cell, 2009, 16(3): 398-410.doi:10.1016/j.devcel.2009.02.003.
[13] BOU G, LIU S, GUO J, ZHAO Y, SUN M, XUE B, WANG J, WEI Y, KONG Q, LIU Z.Cdx2 represses Oct4 function via inducing its proteasome-dependent degradation in early porcine embryos.Developmental Biology, 2016, 410(1): 36-44.doi:10.1016/j.ydbio.2015.12.014.
[14] CAO Z B, XU T T, TONG X,WANG Y Q, ZHANG D D, GAO D, ZHANG L, NING W, QI X, MA Y Y, YU T, KNOTT JG, ZHANG Y H.Maternal Yes-associated protein participates in porcine blastocyst development via modulation of trophectoderm epithelium barrier function.Cell, 2019, 8(12):1606.
[15] LIN K C, PARK H W, GUAN K L.Regulation of the hippo pathway transcription factor TEAD.Trends in Biochemical Sciences, 2017, 42(11): 862-872.doi:10.1016/j.tibs.2017.09.003.
[16] HOIDEN J K, CUNNINGHAM C N.Targeting the Hippo Pathway and Cancer through the TEAD Family of Transcription Factors.Cancers(Basel), 2018,10(3): 81.
[17] ZHAO B, YE X, YU J, LI L, LI W, LI S, YU J, LIN J D, WANG C Y, CHINNAIYAN A M, LAI Z C, GUAN K L.TEAD mediates YAP- dependent gene induction and growth control.Genes & Development, 2008, 22(14): 1962-1971.doi:10.1101/gad.1664408.
[18] TSIKA R W, MA L, KEHAT I, SCHRAMM C, SIMMER G, MORGAN B, FINE D M, HANFT L M, MCDONALD K S, MOLKENTIN J D, KRENZ M, YANG S, JI J.TEAD-1 overexpression in the mouse heart promotes an age-dependent heart dysfunction.The Journal of Biological Chemistry, 2010, 285(18): 13721-13735.doi:10.1074/jbc.m109.063057.
[19] HAN Z, YU Y, CAI B, XU Z, BAO Z, ZHANG Y, BAMBA D, MA W, GAO X, YUAN Y, ZHANG L, YU M, LIU S, YAN G, JIN M, HUANG Q, WANG X, HUA B, YANG F, PAN Z, LIANG H, LIU Y.YAP/TEAD3 signal mediates cardiac lineage commitment of human-induced pluripotent stem cells.Journal of Cellular Physiology, 2020, 235(3): 2753-2760.doi:10.1002/jcp.29179.
[20] GIBAULT F, STURBAUT M, BAILLY F, MELNYK P, COTELLE P.Targeting transcriptional enhanced associate domains (TEADs).Journal of Medicinal Chemistry, 2018, 61(12): 5057-5072.doi:10.1021/acs.jmedchem.7b00879.
[21] SHI Z, HE F, CHEN M, HUA L, WANG W, JIAO S, ZHOU Z.DNA-binding mechanism of the Hippo pathway transcription factor TEAD4.Oncogene, 2017, 36(30): 4362-4369.doi:10.1038/onc.2017.24.
[22] HOME P, SAHA B, RAY S, DUTTA D, GUNEWARDENA S, YOO B, PAL A, VIVIAN J L, LARSON M, PETROFF M, GALLAGHER P G, SCHULZ V P, WHITE K L, GOLOS T G, BEHR B, PAUL S.Altered subcellular localization of transcription factor TEAD4 regulates first mammalian cell lineage commitment.Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(19): 7362-7367.doi:10.1073/pnas.1201595109.
[23] YAGI R, KOHN M J, KARAVANOVA I, KANEKO K J, VULLHORST D, DEPAMPHILIS M L, BUONANNO A.Transcription factor TEAD4 specifies the trophectoderm lineage at the beginning of mammalian development.Development (Cambridge, England), 2007, 134(21): 3827-3836.doi:10.1242/dev.010223.
[24] NISHIOKA N, YAMAMOTO S, KIYONARI H, SATO H, SAWADA A, OTA M, NAKAO K, SASAKI H.Tead4 is required for specification of trophectoderm in pre-implantation mouse embryos.Mechanisms of Development, 2008, 125(3/4): 270-283.doi:10.1016/j.mod.2007.11.002.
[25] KUMAR RAM P, SOMA R, PRATIK H, BISWARUP S, BHASWATI B, WILKINS HEATHER M, HEMANTKUMAR C, AVISHEK G, JESSICA M F, ARINDAM P, PARTHA K, SWERDLOW RUSSELL H, SOUMEN P.Regulation of energy metabolism during early mammalian development: TEAD4 controls mitochondrial transcription.Development, 2018, 145(19): dev162644.doi:10.1242/dev.162644.
[26] KANEKO K J, DEPAMPHILIS M L.TEAD4 establishes the energy homeostasis essential for blastocoel formation.Development (Cambridge, England), 2013, 140(17): 3680-3690.doi:10.1242/dev.093799.
[27] AKIZAWA H, KOBAYASHI K, BAI H, TAKAHASHI M, KAGAWA S, NAGATOMO H, KAWAHARA M.Reciprocal regulation of TEAD4 and CCN2for the trophectoderm development of the bovine blastocyst.Reproduction (Cambridge, England), 2018, 155(6): 563-571.doi:10.1530/rep-18-0043.
[28] SAKURAI N, TAKAHASHI K, EMURA N, HASHIZUME T, SAWAI K.Effects of downregulating TEAD4 transcripts by RNA interference on early development of bovine embryos.The Journal of Reproduction and Development, 2017, 63(2): 135-142.
[29] 贲文锐.Tead1-3在小鼠围着床期子宫中的表达研究[D].哈尔滨: 东北农业大学, 2014.
BEN W R.Expression of Tead1-3 in Mouse Uterus during peri-i mplantation period [D].Harbin: Northeast Agricultural University, 2014.(in Chinese)
[30] XIAO L, MA L, WANG Z, YU Y, LYE S J, SHAN Y, WEI Y.Deciphering a distinct regulatory network of TEAD4, CDX2 and GATA3 in humans for trophoblast transition from embryonic stem cells.Biochimica et Biophysica Acta Molecular Cell Research, 2020, 1867(9): 118736.doi:10.1016/j.bbamcr.2020.118736.
Transcription Factor TEAD4 Regulates Early Embryonic Development in Pigs
ZHANG DanDan, XU TengTeng, GAO Di, QI Xin, NING Wei, RU ZhenYuan, ZHANG XiangDong, GUO TengLong, SHENTU LuYan, YU Tong, MA YangYang, LI YunSheng, ZHANG YunHai, CAO ZuBing*
Key Laboratory of Conservation and Biological Breeding of Local Livestock and Poultry Genetic Resources/College of Animal Science and Technology, Anhui Agricultural University, Hefei 230036
【Background】 TEA domain transcription factor 4 (TEAD4) is known to be a member of the TEAD family of transcription factors and plays a key role in determining the characteristics of the preimplantation embryo in rodents.In mouse embryos, it was found to be involved in regulating the genealogical differentiation of trophectoderm cells in preimplantation embryos by promoting Cdx2 expression.The absence of the TEAD4 gene in mouse embryos can lead to failure of mouse blastocyst formation.However, the role of TEAD4 in early porcine embryonic development is still unclear.【Objective】This study aimed to preliminarily elucidate the effect of TEAD4 on early porcine embryonic development, in order to lay the theoretical foundation for further exploring the molecular mechanisms of transcription factors on early porcine embryonic development【Method】In this study, the bioinformatics analysis of the porcinegene was performed by using web-based tools, including analysis of the porcinegene sequence, comparison of homology between pigs, human and mice, and comparison of the evolutionary relationship ofbetween different species.The role ofgene in porcine oocytes and the early embryos was firstly detected by fluorescence quantitative PCR.and then, siRNA targetingwas designed and injected into mature oocytes by microinjection technique to reduce the level of endogenousgene in the oocyte cytoplasm, and to determine thatsiRNA acts only ongene, with a view to determining the role ofgene in early porcine embryonic development.【Result】Sequence analysis showed that the porcinegene contained 11 exons and localized on chromosome 5, with spanning 37.188 kb, 1 473 bp in full mRNA length, and 1305 bp in full coding region, which encoded 434 amino acids.Homology analysis with human and mouse revealed that TEAD4 was highly conserved in different species and had the closest affinity on pig and cow.The results of fluorescence quantitative PCR showed thatmRNA was expressed in both porcine oocytes and early embryos; compared with GV-stage oocytes, the expression ofmRNA was lowest in MII-stage oocytes and remained low until the 4-cell stage, but reached the highest expression in the 8-cell stage, and then gradually decreased in the morula and blastocyst stages.Microinjection of siRNA targeting TEAD4 revealed thatsiRNA only acted on the endogenousgene in oocytes, but not onand,and compared with the control and negative control siRNA groups, the injection ofsiRNA significantly reducedmRNA expression at the 8-cell and morula embryo periods.Whengene expression was knocked down, observation of the developmental efficiency of porcine orphan activation and in vitro fertilization embryos showed that the developmental efficiency of TEAD4 siRNA knockdown group from 8-cell to blastocyst stage was significantly reduced compared to the control and negative control siRNA groups.【Conclusion】 The results of this study indicated that thegene was highly conserved across species, with the closest affinity on pigs and bovine, and that TEDA4 might be involved in regulating the development of early porcine embryos..
pig; early embryos;;parthenogenetic activation; in vitro fertilization
2020-09-09;
2021-07-08
安徽省科技重大专项(18030701185)、安徽省留学回国人员创新创业扶持计划项目(2020LCX015)、合肥市留学回国人员创新创业扶持计划项目(03082009)、国家自然科学基金青年基金(3180130169和31902226)
张丹丹,E-mail:1730504758@qq.com。通信作者曹祖兵,E-mail:zubingcao@ahau.edu.cn
(责任编辑 林鉴非)
