依达拉奉对视网膜脱离模型大鼠早期感光细胞自噬的调控作用
2021-10-27康紫薇任秀瑜张妍春裴澄张娜娜夏益敏杨菁茹
康紫薇 任秀瑜 张妍春 裴澄 张娜娜 夏益敏 杨菁茹
1西安交通大学第一附属医院 710049;2西安市人民医院(西安市第四医院) 陕西省眼科医院 西安市眼底病研究所 西安交通大学医学院附属广仁医院眼科 710004;3西安交通大学癌症研究所 710061;4西安市人民医院(西安市第四医院)病理科 710004
视网膜神经感觉层与色素上皮层之间的黏附力较弱,易发生视网膜脱离(retinal detachment,RD)及视网膜下液潴留,是许多眼底疾病,如年龄相关性黄斑变性等发生和发展过程中常伴发的病理现象[1]。尽管目前通过手术治疗可使90%以上的原发性RD解剖复位,但是术后大多数患者视功能丢失严重[2]。研究表明,感光细胞死亡是RD后视功能发生永久性损伤的主要原因,RD降低视网膜外层氧及营养供应,使感光细胞层处于低氧状态,产生大量氧自由基,进而导致感光细胞凋亡[3-4]。然而,神经上皮层与色素上皮层分离后并不立刻发生感光细胞的死亡,这就是临床所谓的能保存RD患者有用视力的“窗口期”,这段时间机体内促存活的分子通道被激活,阻止细胞凋亡的发生。研究证实RD能激活感光细胞自噬,减少感光细胞凋亡的发生[5-6]。然而,也有研究表明活性氧簇(reactive oxygen species,ROS)也可以诱导自噬小体的形成,自噬可通过减少蛋白质聚集物和清除受损细胞器来减轻氧化损伤[7-8]。RD后感光细胞发生自噬与ROS水平的相关性目前尚不清楚。依达拉奉(3-甲基-1-苯基-2-吡唑啉-5-酮)是一种有效的氧自由基清除剂,具有抗氧化和抗凋亡的作用[9-11]。动物实验已经证实依达拉奉能够有效减少实验性RD感光细胞凋亡,阻止视网膜外核层厚度比例的下降,显著降低活化caspase-3、caspase-8、caspase-9以及羰基蛋白水平[12]。然而,依达拉奉对RD模型中感光细胞自噬的调节作用目前尚不清楚。本研究拟使用依达拉奉减少早期RD模型大鼠眼内氧自由基水平,观察感光细胞自噬水平变化,探讨依达拉奉是否通过调节自噬来抑制感光细胞的凋亡。
1 材料与方法
1.1 材料
1.1.1实验动物 健康清洁级成年雄性SD大鼠75只,体质量263~274 g,由第四军医大学动物实验室提供,实验动物饲养于西安交通大学动物实验室,饲养温度为25~27 ℃,相对湿度为55%~70%,12 h光照昼夜循环,通风状况良好。动物分笼饲养,每笼6只,给予自由饮水、摄食。实验动物的使用及喂养遵循国家科学技术委员会颁布的《实验动物管理条例》,动物伦理经西安市第四医院伦理委员会审核批准(批文号:2016016)。
1.1.2主要试剂及仪器 总超氧化物歧化酶(total superoxide dismutase,T-SOD)测试盒、丙二醛(malondialdehyde,MDA)测试盒(南京建成生物工程研究所有限公司);SDS-PAGE蛋白上样缓冲液、RIPA裂解液、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、5倍蛋白上样缓冲液、TUNEL细胞凋亡检测试剂盒(上海碧云天生物技术研究所);聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(美国Millipore公司);兔抗自噬相关基因4B(autophagy related gene 4B,Atg4B)抗体(A2981,美国Sigma公司);兔抗微管相关蛋白质1轻链3B(microtubule-associated protein 1 light chain 3B,LC3B)抗体(#2775S,美国CST公司);兔抗超氧化物歧化酶2(superoxide dismutase 2,SOD2)抗体(ab16831)、兔抗核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)抗体(ab31163)(英国Abcam公司);鼠抗β-肌动蛋白(β-actin)抗体(NC010)、HRP标记的山羊抗兔IgG(EK020)、HRP标记的山羊抗鼠IgG(EK010)、SDS-PAGE凝胶制备试剂盒及ECL发光检测试剂盒(西安壮志生物科技有限公司);caspase-3抗体(74T2)、预染蛋白Marker、BCA定量试剂盒(美国Thermo Fisher公司);医用透明质酸钠凝胶(17 mg/ml)(美国博士伦公司);盐酸氯丙嗪(吉林省华牧动物保健品有限公司);复方托吡卡胺滴眼液(日本参天制药株式会社);眼用平衡盐溶液(H20171363,美国Alcon公司)。琼脂凝胶电泳装置(北京君意东方电泳设备有限公司);BioPhotometer plus核酸蛋白测定仪(德国Eppendorf公司);化学发光仪(上海天能科技有限公司);30G针头(美国BD公司);解剖显微镜(EZ4HD)、石蜡切片机(RM2016)(德国Leica公司);光学显微镜(BX51,日本Olympus公司);33G微量动物注射器(瑞士Hamilton公司)。
1.2 方法
1.2.1大鼠RD模型的建立及分组处理 取51只大鼠进行RD模型建立,另取24只大鼠作为PBS注射组。均以右眼为实验眼。采用盐酸氯丙嗪(0.03 ml/100 g)腹腔内注射麻醉大鼠,PBS注射组大鼠玻璃体腔内注射眼用平衡盐溶液15 μl。RD造模大鼠复方托吡卡胺滴眼液扩瞳后,取30G针头于颞上角巩缘后4 mm进入玻璃体腔,在鼻侧视网膜避开血管造孔,用微量进样针向视网膜下推注质量分数0.5%透明质酸钠15 μl,尽量扩大RD面积,行前房穿刺放出少量房水至角膜透明。剔除晶状体意外损伤、眼内大量出血的大鼠。采用随机数字法将造模成功大鼠随机分为RD模型组和依达拉奉治疗组。造模后每日扩瞳后使用瞳孔笔及直接检眼镜观察角膜、晶状体及眼底情况。造模后依达拉奉治疗组大鼠腹腔内注射依达拉奉3 mg/kg,2次/d,PBS注射组及RD模型组大鼠腹腔内注射等容量0.9%氯化钠溶液。各组于造模后1、3、7 d任意选取8只大鼠过量麻醉法处死并取材。
1.2.2眼内液中T-SOD活性、MDA含量测定 各组不同时间点取8只大鼠,30G针头行右眼前房穿刺并抽取眼内液。将各组中每2只大鼠的眼内液混匀在一起,成为1个实验样本,共4个样本。取10 μl眼内液,按T-SOD试剂盒说明书操作,采用BioPhotometer plus核酸蛋白测定仪测量各组波长550 nm处吸光度(A)值,计算各组眼内液中T-SOD活力值。另取10 μl眼内液,按照MDA试剂盒说明书操作,测量各组波长532 nm处A值,计算各组眼内液中MDA含量。
1.2.3Western blot法检测视网膜组织中各抗氧化、凋亡及自噬相关蛋白表达 各组不同时间点分别处死4只大鼠,于手术显微镜下分离取出右眼视网膜,显微剪剪碎组织,加入含有PMSF的预冷RIPA裂解液450 μl,4 ℃条件下1 200×g离心10 min,取上清;采用BCA定量试剂盒测定上清液中蛋白质量浓度;将蛋白样品质量浓度调整为2 μg/μl,与蛋白上样缓冲液混合后,100 ℃水浴5 min使蛋白变性;每孔上样量为10 μl,采用SDS-PAGE对蛋白样品进行电泳分离;采用湿转法将蛋白转印至PVDF膜,用三羟甲基氨基甲烷盐酸缓冲盐+吐温(Tris-HCl+Tween,TBST)溶液洗膜3次,每次5 min,质量分数5%脱脂牛奶37 ℃封闭2 h,TBST溶液洗膜3次,分别加入相应Atg4(1∶ 1 000)、LC3B(1∶ 1 000)、SOD2(1∶ 5 000)、Nrf2(1∶ 500)、caspase-3(1∶ 500)、β-actin(1∶ 5 000)抗体,4 ℃孵育过夜;TBST洗膜3次,每次5 min,加入HRP标记的IgG抗体(1∶ 2 000)37 ℃孵育1 h,TBST洗膜3次,每次5 min;使用ECL和化学发光仪显色并拍照,ImageJ软件分析蛋白灰度值,以β-actin为内参蛋白,计算各目的蛋白相对表达量,实验重复3次。
1.2.4TUNEL法标记视网膜切片凋亡细胞 各组不同时间点分别处死4只大鼠,取右眼全眼球进行石蜡包埋,沿眼球矢状位方向行4 μm厚石蜡切片;将石蜡切片常规脱蜡处理后滴加20 μg/ml不含DNase的蛋白酶K,37 ℃作用30 min,PBS洗涤3次,每次3 min;滴加体积分数3%过氧化氢溶液室温下避光孵育20 min,PBS洗涤3次,每次3 min;滴加生物素标记液37 ℃避光孵育1.5 h,PBS洗涤1次,每次3 min;滴加反应终止标记液,室温下孵育10 min,PBS洗涤3次,每次3 min;滴加Streptavidin-HRP工作液37 ℃湿盒中孵育40 min,PBS洗涤3次,每次3 min;DAB显色液孵育35 min,苏木素染色30 s,脱水,透明,树胶封片。于光学显微镜下观察视网膜凋亡细胞并拍照;采用Image-pro plus图像分析软件对外核层阳性染色细胞计数,计算其占总感光细胞数的比例。
1.3 统计学方法
采用SPSS 18.0统计学软件进行统计分析,计量数据经Shapiro-Wilk检验呈正态分布,以mean±SD表示,采用Levene检验证实方差齐。各组不同时间点T-SOD活力值、MDA含量以及各蛋白相对表达量总体差异比较采用两因素方差分析,组间多重比较采用Tukey检验。RD模型组与依达拉奉治疗组不同时间点TUNEL阳性细胞比率总体差异比较采用两因素方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 RD造模情况
造模过程中2眼在视网膜造孔时大量出血,1眼晶状体损伤,剔除这3只大鼠,其余48只制备RD模型眼于手术显微镜下观察鼻侧视网膜均高度隆起至晶状体后,RD范围>60%(图1),鼻下方近赤道部视网膜裂孔大小为1/2~1视盘直径,其中1眼视网膜表面少量出血,但不影响眼底观察。所有实验眼在实验观察期间,结膜囊内未见异常分泌物,球结膜稍充血,角膜均透明,前房清亮,玻璃体无明显混浊。实验期间各模型鼠鼻侧视网膜灰白色隆起持续存在。
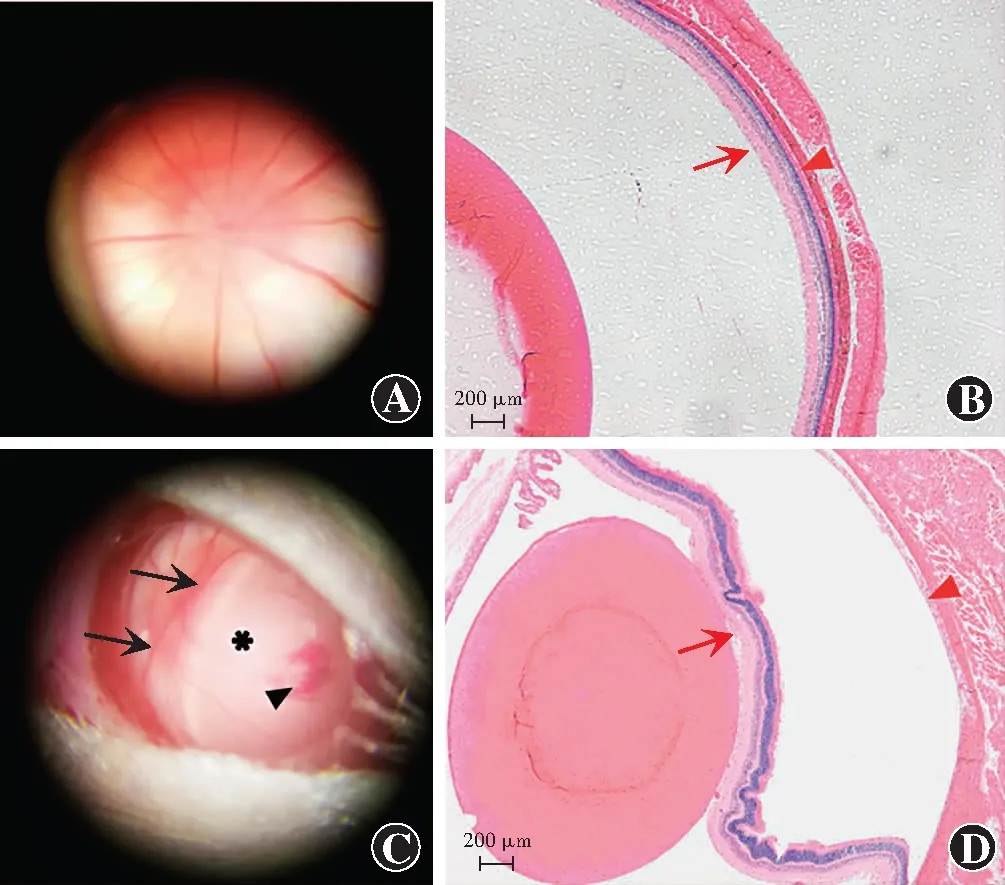
图1 PBS注射组与RD模型组大鼠眼底及组织病理图 A:手术显微镜下观察显示,PBS注射组大鼠视网膜平伏,血管走行正常 B:眼球石蜡切片病理学观察显示,PBS注射组大鼠神经上皮层与色素上皮层贴附良好(HE ×40,标尺=200 μm) C:手术显微镜下观察显示,RD模型组大鼠鼻侧视网膜灰白色高度隆起伴裂孔旁少量出血 D:眼球石蜡切片病理学观察显示,RD模型组大鼠视网膜脱离,视网膜高度隆起至晶状体后表面(HE ×40,标尺=200 μm) 红三角所指为神经上皮层,红箭所指为色素上皮层;*为视网膜隆起最高处,黑箭所指为视网膜脱离边缘,黑三角所指为造孔处Figure 1 Fundus and histopathology findings of rats in the PBS injection group and RD model group A:Normal retina was observed and vessel ran normally in rat of the PBS injection group under the operation microscope B:The neurepithelium layer (red triangle) and the pigment epithelium layer (red arrow) of the paraffin section attached well in the PBS injection group (HE ×40,bar=200 μm) C:Nasal retina elevated highly with little hemorrhage besides the artificial hole was observed in rats of the RD model group under the operation microscope D:The retinal neurepithelium layer (red triangle) detached from the retinal pigment epithelial layer (red arrow) and part of RNL reaching the posterior surface of the lens were observed in the paraffin section of the RD model group (HE ×40,bar=200 μm) * showed the highest site of elevated retina;black arrow showed the edge of retinal detachment;black triangle indicated the artificial hole
2.2 各组不同时间点眼内液中T-SOD活力及MDA含量比较
各组不同时间点眼内液中MDA含量及T-SOD活力总体比较,差异均有统计学意义(MDA:F分组=385.513,P<0.01;F时间=13.021,P<0.01.T-SOD:F分组=48.865,P<0.01;F时间=7.700,P=0.003)。造模后各时间点RD模型组眼内液中MDA含量较PBS注射组明显升高,T-SOD活力值较PBS注射组明显降低,差异均有统计学意义(均P<0.05);造模后各时间点依达拉奉治疗组眼内液中MDA含量较RD模型组均明显下降,较PBS注射组明显升高,差异均有统计学意义(均P<0.05);造模后各时间点依达拉奉治疗组T-SOD活力值均较RD模型组明显升高,较PBS注射组明显降低,差异均有统计学意义(均P<0.05);各组随造模后时间延长,眼内液中T-SOD活力值和MDA含量呈现先升高后降低的趋势(表1)。

表1 各组不同时间点眼内液中T-SOD活力值和MDA含量比较(mean±SD)Table 1 Comparison of T-SOD activity and MDA content in intraocular fluid at various time points among the three groups (mean±SD)组别样本量造模后不同时间点T-SOD活力值[mmol/(min·L)]造模后不同时间点MDA含量(mmol/ml)1d3d7d1d3d7dPBS注射组4309.81±0.55323.03±2.94294.60±4.865.31±1.086.00±0.425.47±0.99RD模型组4101.59±3.83a215.65±6.37a205.03±5.15a16.34±1.86a19.82±1.80a17.88±0.74a依达拉奉治疗组4261.54±8.48ab294.67±7.23ab227.87±7.03ab7.12±1.47ab9.32±1.12ab8.69±0.56ab 注:T-SOD:F分组=48.865,P<0.01;F时间=7.700,P=0.003.MDA:F分组=385.513,P<0.01;F时间=13.021,P<0.01.与各自时间点PBS注射组比较,aP<0.05;与各自时间点RD模型组相比,bP<0.05(两因素方差分析,Tukey检验) T-SOD:总超氧化物歧化酶;MDA:丙二醛;PBS:磷酸盐缓冲盐溶液;RD:视网膜脱离 Note:T-SOD:Fgroup=48.865,P<0.01;Ftime=7.700,P=0.003.MDA:Fgroup=385.513,P<0.01;Ftime=13.021,P<0.01.Compared with the PBS injection group at corresponding time points,aP<0.05;compared with the RD model group at corresponding time points,bP<0.05 (Two-way ANOVA,Tukey test) T-SOD:total superoxide dismutase;MDA:malondialdehyde;PBS:phosphate buffer saline;RD:retinal detachment
2.3 各组视网膜组织中抗氧化蛋白相对表达量比较
各组不同时间点视网膜组织中SOD2、Nrf2蛋白相对表达量总体比较,差异均有统计学意义(SOD2:F分组=33.717,P<0.01;F时间=11.745,P<0.01.Nrf2:F分组=37.329,P<0.01;F时间=27.002,P<0.01)。造模后各时间点RD模型组SOD2、Nrf2蛋白相对表达量明显高于PBS注射组,差异均有统计学意义(均P<0.05);造模后1、3、7 d依达拉奉治疗组SOD2相对表达量较RD模型组明显升高,造模后1、3 d依达拉奉治疗组Nrf2蛋白相对表达量较RD模型组明显升高,差异均有统计学意义(均P<0.05)(图2,表2)。

图2 各组不同时间点视网膜组织中SOD2和Nrf2蛋白表达电泳图 1:PBS注射组;2:RD模型组;3:依达拉奉治疗组 SOD:超氧化物歧化酶;β-actin:β肌动蛋白;Nrf:核因子E2相关因子Figure 2 Electropherograms of SOD2 and Nrf2 protein in retinal tissue at different time points in each group 1:PBS injection group;2:RD model group;3:edaravone treatment group SOD:superoxide dismutase;Nrf:nuclear factor E2-related factor
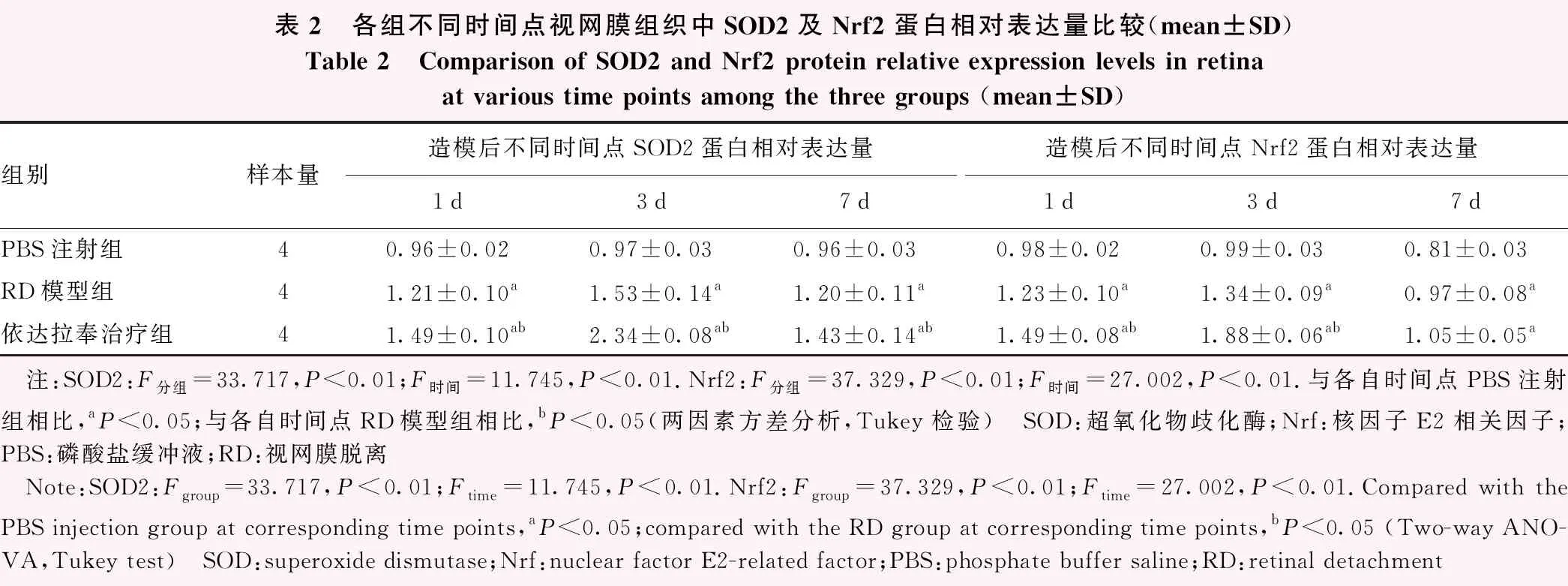
表2 各组不同时间点视网膜组织中SOD2及Nrf2蛋白相对表达量比较(mean±SD)Table 2 Comparison of SOD2 and Nrf2 protein relative expression levels in retina at various time points among the three groups (mean±SD)组别样本量造模后不同时间点SOD2蛋白相对表达量造模后不同时间点Nrf2蛋白相对表达量1d3d7d1d3d7dPBS注射组40.96±0.020.97±0.030.96±0.030.98±0.020.99±0.030.81±0.03RD模型组41.21±0.10a1.53±0.14a1.20±0.11a1.23±0.10a1.34±0.09a0.97±0.08a依达拉奉治疗组41.49±0.10ab2.34±0.08ab1.43±0.14ab1.49±0.08ab1.88±0.06ab1.05±0.05a 注:SOD2:F分组=33.717,P<0.01;F时间=11.745,P<0.01.Nrf2:F分组=37.329,P<0.01;F时间=27.002,P<0.01.与各自时间点PBS注射组相比,aP<0.05;与各自时间点RD模型组相比,bP<0.05(两因素方差分析,Tukey检验) SOD:超氧化物歧化酶;Nrf:核因子E2相关因子;PBS:磷酸盐缓冲液;RD:视网膜脱离 Note:SOD2:Fgroup=33.717,P<0.01;Ftime=11.745,P<0.01.Nrf2:Fgroup=37.329,P<0.01;Ftime=27.002,P<0.01.Compared with the PBS injection group at corresponding time points,aP<0.05;compared with the RD group at corresponding time points,bP<0.05 (Two-way ANO-VA,Tukey test) SOD:superoxide dismutase;Nrf:nuclear factor E2-related factor;PBS:phosphate buffer saline;RD:retinal detachment
2.4 各组视网膜组织中自噬相关蛋白相对表达量比较
PBS组、RD模型组和依达拉奉治疗组在不同时间点视网膜LC3B-Ⅱ/LC3B-Ⅰ与Atg4蛋白相对表达量总体比较差异均有统计学意义(LC3B-Ⅱ/LC3B-Ⅰ:F分组=9.620,P=0.001;F时间=20.831,P<0.001.Atg4:F分组=9.061,P=0.001;F时间=18.505,P<0.001)。造模后1 d和3 d PBS注射组LC3B-Ⅱ/LC3B-Ⅰ和Atg4相对表达量均明显低于RD模型组和依达拉奉治疗组,造模后3 d RD模型组LC3B-Ⅱ/LC3B-Ⅰ和Atg4相对表达量均明显低于依达拉奉治疗组,差异均有统计学意义(均P<0.05);造模后7 d各组间LC3B-Ⅱ/LC3B-Ⅰ和Atg4相对表达量比较差异均无统计学意义(均P>0.05)(图3,表3)。
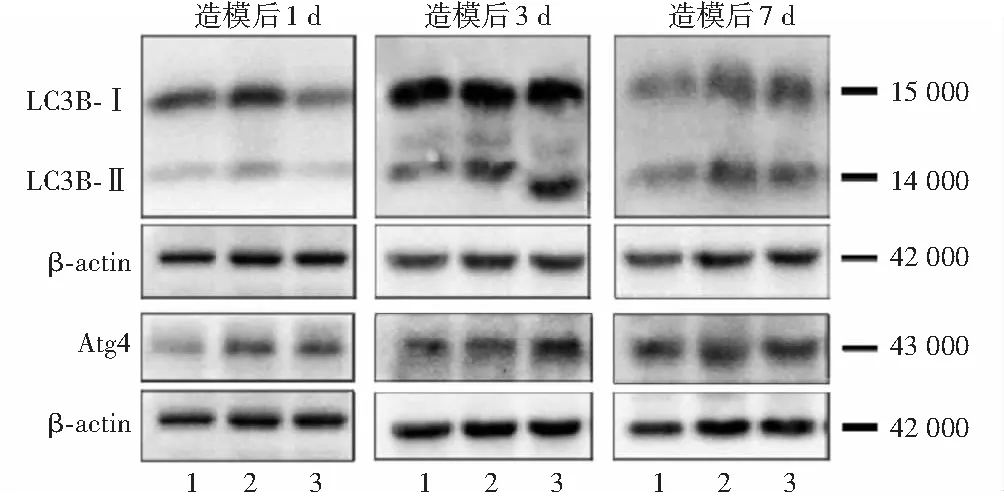
图3 各组不同时间点视网膜组织中LC3B-Ⅱ/LC3B-Ⅰ和Atg4蛋白表达电泳图 1:PBS注射组;2:RD模型组;3:依达拉奉治疗组 LC:微管相关蛋白质1轻链;β-actin:β肌动蛋白;Atg:自噬相关基因Figure 3 Electropherograms of LC3B-Ⅱ/LC3B-Ⅰ and Atg4 protein expression in retinal tissue at various time points in each group 1:PBS injection group;2:RD model group;3:edaravone treatment group LC:microtubule-associated protein 1 light chain;Atg:autophagy related gene
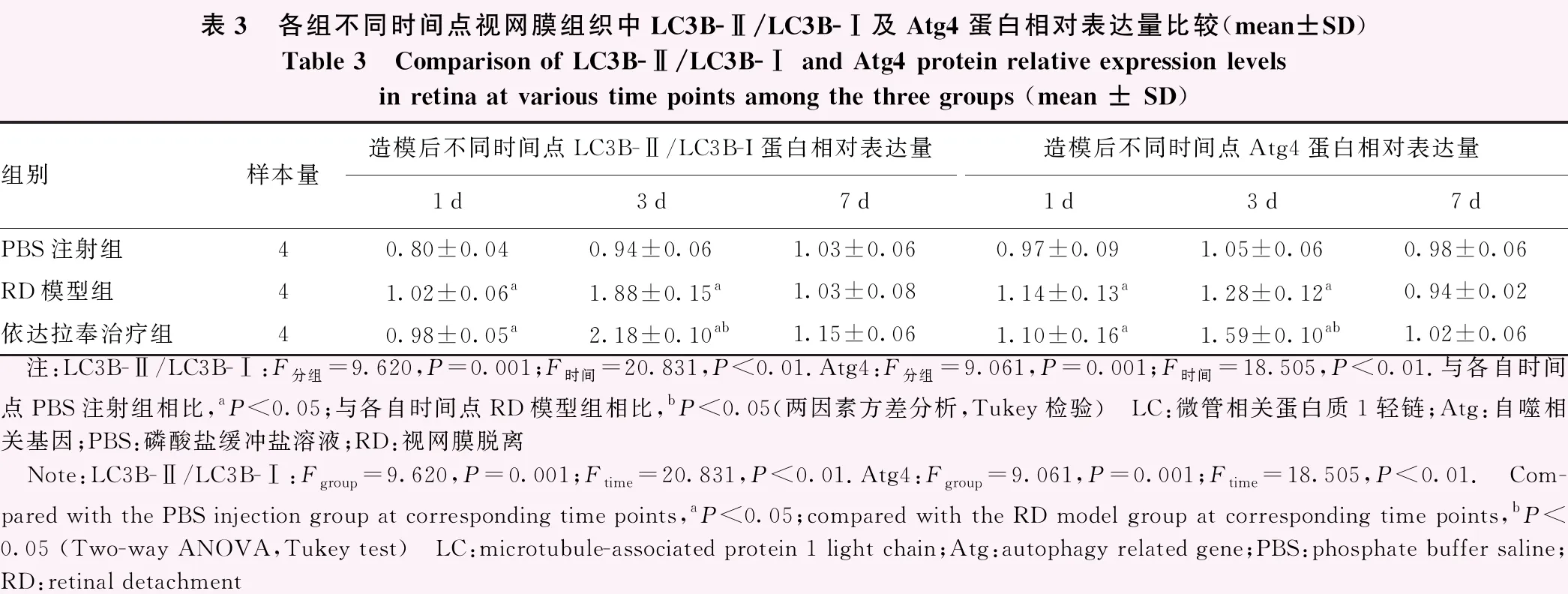
表3 各组不同时间点视网膜组织中LC3B-Ⅱ/LC3B-Ⅰ及Atg4蛋白相对表达量比较(mean±SD)Table 3 Comparison of LC3B-Ⅱ/LC3B-Ⅰ and Atg4 protein relative expression levels in retina at various time points among the three groups (mean ± SD)组别样本量造模后不同时间点LC3B-Ⅱ/LC3B-I蛋白相对表达量造模后不同时间点Atg4蛋白相对表达量1d3d7d1d3d7dPBS注射组40.80±0.040.94±0.061.03±0.060.97±0.091.05±0.060.98±0.06RD模型组41.02±0.06a1.88±0.15a1.03±0.081.14±0.13a1.28±0.12a0.94±0.02依达拉奉治疗组40.98±0.05a2.18±0.10ab1.15±0.061.10±0.16a1.59±0.10ab1.02±0.06 注:LC3B-Ⅱ/LC3B-Ⅰ:F分组=9.620,P=0.001;F时间=20.831,P<0.01.Atg4:F分组=9.061,P=0.001;F时间=18.505,P<0.01.与各自时间点PBS注射组相比,aP<0.05;与各自时间点RD模型组相比,bP<0.05(两因素方差分析,Tukey检验) LC:微管相关蛋白质1轻链;Atg:自噬相关基因;PBS:磷酸盐缓冲盐溶液;RD:视网膜脱离 Note:LC3B-Ⅱ/LC3B-Ⅰ:Fgroup=9.620,P=0.001;Ftime=20.831,P<0.01.Atg4:Fgroup=9.061,P=0.001;Ftime=18.505,P<0.01. Com-pared with the PBS injection group at corresponding time points,aP<0.05;compared with the RD model group at corresponding time points,bP<0.05 (Two-way ANOVA,Tukey test) LC:microtubule-associated protein 1 light chain;Atg:autophagy related gene;PBS:phosphate buffer saline;RD:retinal detachment
2.5 各组视网膜细胞凋亡情况比较
各组不同时间点视网膜组织中caspase-3蛋白相对表达量比较,差异均有统计学意义(F分组=31.314,P<0.01;F时间=10.460,P=0.001)。其中,造模后各时间点RD模型组视网膜组织中caspase-3蛋白相对表达量均较PBS注射组和依达拉奉治疗组明显升高,差异均有统计学意义(均P<0.05)(图4,表4)。
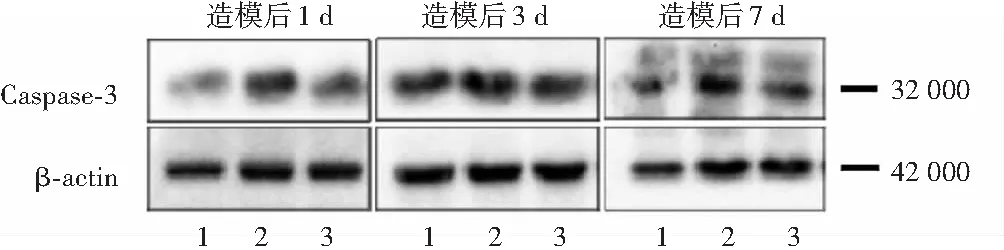
图4 不同时间点各组视网膜组织中caspase-3蛋白表达电泳图 1:PBS注射组;2:RD模型组;3:依达拉奉治疗组 β-actin:β肌动蛋白Figure 4 Electropherograms of caspase-3 expression in retinal tissue at various time points in each group 1:PBS injection group;2:RD model group;3:edaravone treatment group

表4 各组不同时间点视网膜组织中caspase-3蛋白相对表达量比较(mean±SD)Table 4 Comparison of caspase-3 protein relative expression levels in retina tissue at various time points among the three groups (mean±SD)组别样本量造模后不同时间点视网膜组织中caspase-3蛋白相对表达量1d3d7dPBS注射组41.10±0.081.06±0.080.95±0.09RD模型组41.76±0.13a2.89±0.12a1.60±0.19a依达拉奉治疗组41.47±0.11ab1.64±0.05ab1.28±0.15ab 注:F分组=31.314,P<0.01;F时间=10.460,P=0.001.与各自时间点PBS注射组相比,aP<0.05;与各自时间点RD模型组相比,bP<0.05(两因素方差分析,Tukey检验) PBS:磷酸盐缓冲盐溶液;RD:视网膜脱离 Note:Fgroup=31.314,P<0.01;Ftime=10.460,P=0.001.Compared with the PBS injection group at corresponding time points,aP<0.05;compared with the RD model group at corresponding time points,bP<0.05 (Two-way ANOVA,Tukey test) PBS:phosphate buffer saline;RD:retinal detachment
石蜡切片TUNEL染色结果显示,造模后各时间点RD模型组及依达拉奉治疗组外核层均见TUNEL阳性标记细胞,PBS注射组外核层未见TUNEL阳性标记细胞。各组不同时间点外核层TUNEL阳性细胞率比较差异均有统计学意义(F分组=60.783,P<0.01;F时间=64.381,P<0.01),其中RD模型组造模后各时间点TUNEL阳性细胞率均明显高于相应时间点依达拉奉治疗组,差异均有统计学意义(均P<0.05)(图5,表5)。

表5 各组不同时间点视网膜外核层TUENL阳性细胞率比较(mean±SD)Table 5 Comparison of ratio of TUENL-positive cells in the retinal outer nuclear layer at various time points among the three groups (mean±SD)组别样本量造模后不同时间点TUNEL阳性细胞率1d3d7dRD模型组40.26±0.030.45±0.040.35±0.04依达拉奉治疗组40.13±0.03a0.34±0.04a0.26±0.04a 注:F分组=60.783,P<0.01;F时间=64.381,P<0.01.与各自时间点RD模型组比较,aP<0.05(两因素方差分析,LSD-t检验) RD:视网膜脱离 Note:Fgroup=60.783,P<0.01;Ftime=64.381,P<0.01.Compared with the RD model group at corresponding time points,aP<0.05 (Two-way ANOVA,LSD-t test) RD:retinal detachment
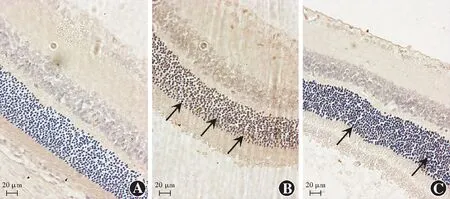
图5 各组造模后3 d眼球石蜡切片TUNEL染色图( ×400,标尺=20 μm) PBS注射组未见明显阳性细胞,RD模型组感光细胞层散在较多细胞核呈棕色着染的阳性细胞,依达拉奉治疗组阳性细胞散在,阳性细胞数量较RD模型组减少 箭头所指为TUNEL染色阳性细胞 A:PBS注射组 B:RD模型组 C:依达拉奉治疗组Figure 5 TUNEL staining findings in paraffin sections at 3 days after modeling(×400,bar=20 μm) No obvious TUNEL-positive cells were observed in the PBS injection group,and more TUNEL-positive cells with brown staining of nuclei were scattered in the photoreceptor cell layer in the RD model group,and the number of TUNEL-positive cells was reduced in the edaravone treatment group than that in the RD model group Arrow pointed to TUNEL-staining positive cells A:PBS injection group B:RD model group C:edaravone treatment group
3 讨论
细胞自噬是Ⅱ型细胞程序性死亡途径,包括启动、自噬体形成、溶酶体产生、自噬体溶酶体融合和降解等过程。在胞内或胞外压力应激条件下,多种基因和蛋白质复合物可介导自噬发生,将受损、衰老的细胞器或异常的蛋白质转运到溶酶体并降解,从而实现生命活动物质基础的补给、正常细胞结构基础的维持以及不利因素的清除。作为维持细胞内稳态的关键机制,自噬在细胞生长、饥饿、低氧适应、肿瘤抑制、衰老及先天和后天免疫中起着重要作用[13]。自噬与许多眼部疾病的发生和发展有关,包括角膜营养不良、白内障、青光眼、年龄相关性黄斑变性及RD[14-19]。Remé等[20]最早利用透射电子显微镜记录了感光细胞自噬,并认为自噬在生理状态下对视觉周期蛋白和细胞器降解发挥重要作用;而在病理状态下,自噬对感光细胞的作用比较复杂,包括保护性和创伤性2种作用。在体研究已经证实自噬对视网膜光损伤具有保护作用[21]。Besirli等[5]报道了大鼠RD造模后Atg5及LC3-Ⅱ表达水平升高,感光细胞自噬增强,而应用自噬抑制剂3-甲基腺嘌呤或敲除Atg5基因后RD模型鼠感光细胞丢失更严重,caspase-8表达明显增加。Liu等[22]研究表明,在缺氧环境下,抑制感光细胞自噬会增加细胞凋亡,降低细胞活性。以上研究证实,在病理状态下,感光细胞可以通过自噬抑制细胞凋亡。而Kunchithapautham等[23]研究发现,在氧化应激诱导的感光细胞凋亡过程中凋亡和自噬的标记基因共同表达,抑制自噬活性可减少凋亡,提示自噬通过触发凋亡参与感光细胞的死亡。本研究推测适度的自噬可发挥保护感光细胞、抑制凋亡发生的作用,但过度自噬可诱导细胞凋亡。
依达拉奉作为新型抗氧化剂已应用于脑损伤、肺损伤、缺血性心肌疾病以及脉络膜新生血管、RD的研究中[12,24-27]。药代动力学研究表明,依达拉奉在体内代谢迅速,半衰期短[28],Roh等[12]研究发现给予依达拉奉10 mg/kg每天1次腹腔内注射会引起视网膜毒性反应,而3 mg/kg每天1次腹腔内注射则无明显抑制感光细胞凋亡的作用。在脉络膜新生血管动物模型的研究中,给予每天2次腹腔内注射依达拉奉3 mg/kg取得了较好的实验结果[27]。分析依达拉奉相关研究及临床应用,推测每天2次的注射频次符合依达拉奉的代谢特点,安全性更高,故本研究采用此种给药剂量和频次。
ROS可攻击生物膜中的多种不饱和脂肪酸,形成MDA等脂质过氧化物,继而引起细胞损伤,因此测量MDA含量可反映机体内脂质过氧化的程度,间接反映细胞损伤程度。SOD可以清除超氧阴离子自由基,保护细胞免受损伤,因而SOD活性也可间接反应机体清除氧自由基的能力。Nrf2通过与抗氧化反应元件相互作用,参与活性氧化剂基因的表达,发挥抗氧化作用[29];同时,Nrf2可以通过调控p62基因的转录和表达,参与自噬过程中蛋白质的降解[30]。LC3B是自噬体复合体的一个重要组成部分,当自噬被激活时,非活性形式的LC3B-Ⅰ将转化为LC3B-Ⅱ,形成自噬体[31]。Atg4参与自噬体膜的生成和调节,将LC3剪切成LC3-Ⅰ[32]。故本研究以SOD2和Nrf2作为抗氧化蛋白,以LC3B-Ⅱ/LC3B-Ⅰ和Atg4作为自噬相关蛋白对RD模型大鼠视网膜进行检测。
在本研究中,RD模型组LC3B-Ⅱ/LC3B-Ⅰ及Atg4的表达水平于造模后3 d达高峰,并于造模后7 d表达下降,与Chinskey等[19]的研究结果一致。本研究进一步证实,与RD模型组比较,依达拉奉治疗组眼内液中T-SOD活性显著升高、MDA含量显著降低,同时视网膜组织中SOD2及Nrf2的蛋白水平升高,表明3 mg/kg依达拉奉每天2次腹腔内注射可以提高视网膜的抗氧化能力,降低眼内氧化应激损伤,在RD造模后7 d,与RD模型组相比,依达拉奉组眼内液中T-SOD活性增加、MDA含量下降、视网膜组织中SOD2蛋白相对表达量升高,RD模型组与依达拉奉组Nrf2蛋白相对表达量比较,差异无统计学意义,提示依达拉奉在造模后7 d内能较好地改善眼内氧化应激状态。与RD模型组比较,依达拉奉组大鼠视网膜组织中caspase-3蛋白相对表达量、外核层TUNEL阳性细胞率均显著降低,尤其在RD后1 d、3 d时降低更明显;同时,依达拉奉治疗组视网膜组织中LC3B-Ⅱ/LC3B-Ⅰ及Atg4蛋白水平较RD模型组升高,在造模后3 d差异显著,但造模后7 d时差异无统计学意义,表明抗氧化剂依达拉奉能够诱导RD造模后视网膜自噬,该作用可能与其抑制感光细胞凋亡相关,尤其在RD早期作用更为明显,随着RD时间的进一步延长,视网膜组织缺氧加重,依达拉奉不足以对抗视网膜氧化应激损伤,导致细胞自噬水平降低。
综上可知,在实验性RD早期,使用氧自由基清除剂依达拉奉能够降低视网膜氧化应激损伤,提高RD后自噬水平并减少感光细胞凋亡发生,提示ROS水平可能是该过程中自噬与凋亡发生转换的相关因素之一,但其具体机制仍有待进一步研究。本研究仍存在一些不足,如未能对视网膜ROS水平进行直接观察,同时也未进一步使用自噬抑制剂或促进剂进行干预,未对ROS在RD过程中感光细胞自噬与凋亡发生的调控作用进行更为深入的研究,后续将进一步细化研究。
利益冲突所有作者均声明不存在利益冲突
