肺亚实性结节CT定量分析对肺腺癌病理侵袭性诊断价值
2021-10-27蒋宇贾晓民赵杰
蒋宇,贾晓民,赵杰
随着胸部低剂量 CT 筛查的逐步推广和普及,肺亚实性结节(subsolid nodules,SSNs)的检出率越来越高,尤其是在年轻、女性、非吸烟者中[1,2]。SSNs也称为磨玻璃结节(ground-glass nodules,GGNs),在肺窗上表现为“云雾状”密度增高结节灶,通过这些密度增加的区域,正常的肺实质结构包括支气管和血管仍可显示。而在纵隔窗图像上不能显示或仅能显示病灶的实性成分[3]。据其影像学上是否含有实性成分分为两种亚型:纯磨玻璃结节(pure ground-glass nodules,pGGNs)和部分实性结节(part solid nodules,PSNs)[4]。SSNs可在各种良性疾病中检出,包括炎性疾病、局灶性出血、纤维化以及非典型腺瘤样增生。而高分辨CT上显示SSNs还提示恶性肿瘤的可能性,如早期肺腺癌[5]。许多研究报告指出亚实性结节可能比实性结节具有更高的恶性潜能[6]。
据世界卫生组织肺腺癌病理分类[7],肺腺癌分为浸润前病变[非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH),原位腺癌(adenocarcinoma in situ,AIS)],微浸润性腺癌(minimally invasive adenocarcinoma,MIA)和浸润性腺癌(invasive adenocarcinoma,IAC)。2019年美国国立综合癌症网络关于肺癌筛查的指南指出pGGNs或实性成分<5 mm的PSNs应该密切随访。对于表现为SSNs的AIS或MIA患者,基于其100%的5年生存率,每年CT扫描随访是合理可靠的。而IAC的5年无病生存率只有74.6%[4,8]。此外,研究表明病理上疑为AIS或MIA的pGGNs可考虑行密切随访或局限切除(节段或楔形切除),而肺叶切除仍然被认为是IAC的标准外科治疗方法[9]。因此,评价存在SSNs患者的IAC发生率,对于确定最佳治疗方案和评估预后具有重要意义。
以往研究已经通过定性或定量测量揭示SSNs的病理学类型或侵袭性与CT表现之间的相关性。目前研究表明[10,11]只有很少的研究探讨了组织学类型与SSN质量或CT差值之间的关系。事实上质量测量可同时反映SSN体积和密度,其精确度可能优于体积、直径或CT值[12]。此外,尚未见基于肺结节分析软件结合胸部HRCT对表现为SSNs的CT值与肺组织差值的报道。本研究我们使用肺结节分析软件,自动准确测量SSNs的体积、CT值,结合HRCT测得正常肺组织CT值,由此计算出结节的质量和CT差值。此外,还考虑了其他定量影像学特征。我们目的是探讨这些影像学特征在鉴别IAC与MIA及浸润前病变的有效性。
材料与方法
1.研究对象
回顾性搜集2017年4月-2020年8月获得明确病理诊断101例患者107个切除的SSNs的临床与影像资料。纳入标准:①HRCT检出至少1个直径≤3 cm的SSNs;②pGGNs或实性成分最大直径≤5 mm的PSNs;③术前1个月内行HRCT检查者;④有完整的临床和病理资料。排除标准:①病理诊断证实的良性病变如纤维化或慢性炎症者;②弥漫性GGNs,间质性肺病、毛细支气管炎、肺部严重感染、外伤或合并肿瘤、转移瘤等肺基础疾病而影响诊断者;③术前1个月内未行HRCT检查;④CT 图像有金属或呼吸伪影而影响图像质量者。
最后,共搜集101例患者107个SSNs,其中60个SSNs为pGGNs,47个为实性成分≤5 mm的PSNs。这项回顾性研究已获得本院伦理委员会批准,所有患者均放弃知情同意的要求。
2.影像学检查
采用GE Revolution CT扫描仪,常规取仰卧位,所有患者均在吸气末屏气后进行扫描。扫描参数:管电压120 kV,管电流自动调整,螺距为1.0,层厚5 mm,标准算法及肺算法进行重组图像,重组层厚0.625 mm,层间距1.25 mm,并做冠状面、矢状面重组。肺亚实性结节的观察采用中华放射学会胸部学组推荐的窗宽及窗位即肺窗窗宽1500 HU,窗位-600~650 HU;纵隔窗宽350 HU,窗位40 HU。
3.图像采集与分析
由2名高年资放射科医师对所有肺结节进行后处理分析,双方达成一致意见。将所有薄层图像传到PACS后处理工作站,使用深睿肺结节分析软件,软件可对肺部行自动分割和可疑结节位置自动检测,系统将自动统计结节的定量参数分析:平均直径、最大/最小CT值、平均CT值、体积、最大横截面积。SSNs质量由以下公式计算:质量=体积·(平均CT值+1000);单位:mg。再以结节为中心,于肺窗结节最大薄层横断面上,勾画与该病灶大小相似的周围正常肺组织的感兴趣区,测得周围肺组织CT值,CT差值由以下公式计算:CT差值=平均CT值-肺组织CT值。每位医师测量3次并取平均值,综合两位医师数据为最终结果。
4.病理诊断
所有病理标本由一名具有丰富肺部肿瘤诊断经验的高年资病理科医师进行审核。组织学诊断遵循2015年世界卫生组织对肺腺癌的分类,分为AAH、AIS、MIA和IAC。这项研究我们将浸润前病变(包括AAH、AIS)和MIA归为预后相似且较好的A组,将IAC分为B组。
5.统计分析
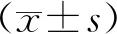
结 果
101名患者共检出107个SSNs,其中女64例,男43例(平均年龄61.20±13.39岁,年龄30~86岁);31例有吸烟史;93例为无症状筛查者,14例有咳嗽、咳痰、咯血、胸痛等症状。
其中pGGNs60例,实性成分≤5 mm的PSNs47例。根据病理检查结果,将107个SSNs分为两组:A组,包括AAH、AIS和MIA(n=52);B组,包括IAC(n=55)(图1~3)。两组患者的临床资料比较性别、吸烟史、症状经χ2检验结果显示差异均无统计学意义(P>0.05)。两组患者年龄经独立样本t检验结果显示差异亦无统计学意义(P>0.05,表1)。
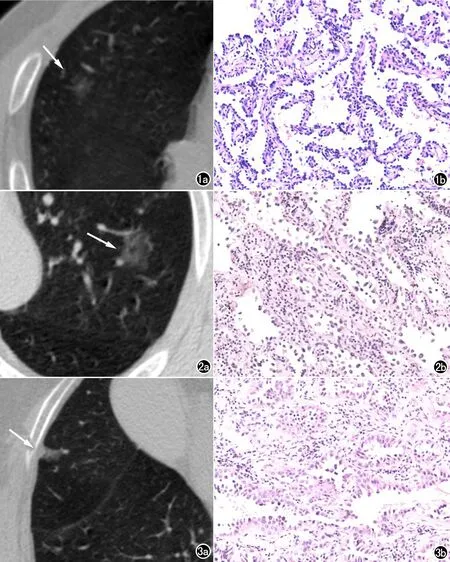
图1 男,63岁,AIS。a)结节分析软件自动检测右肺上叶1枚pGGN(箭),大小9mm×9mm,平均直径9mm,体积328.4mm3,平均CT值-619HU,HRCT肺窗上计算CT差值157HU;b)病理图像(HE×50)示以贴壁生长为主的腺癌,倾向原位腺癌,切缘未见病变累及。 图2 男,41岁,MIA。a)结节分析软件自动检测左肺上叶1枚PSN(箭),大小19mm×15mm,平均直径17mm,体积2529.5mm3,平均CT值-629HU,HRCT肺窗上计算CT差值213HU;b)病理图像(HE×50)示以贴壁为主的腺癌,局部倾向微浸润。 图3 女63岁,IAC。a)结节分析软件自动检测右肺中叶1枚pGGN(箭),大小9mm×6mm,平均直径7.5mm,体积182.7mm3,平均CT值-429HU,HRCT肺窗上计算CT差值366HU;b)病理图像(HE×50)示浸润性腺癌,未见明确脉管内癌栓及神经侵袭。

表1 患者临床资料
影像学定量参数与不同病理类型的关系(表2),经Mann-WhitneyU检验两组患者最大CT值、最小CT值、最大横截面积在A、B组差异均无统计学意义(P>0.05)。B组患者平均直径、平均CT值、CT差值、体积、质量均明显高于A组,差异均有统计学意义(P<0.05)。
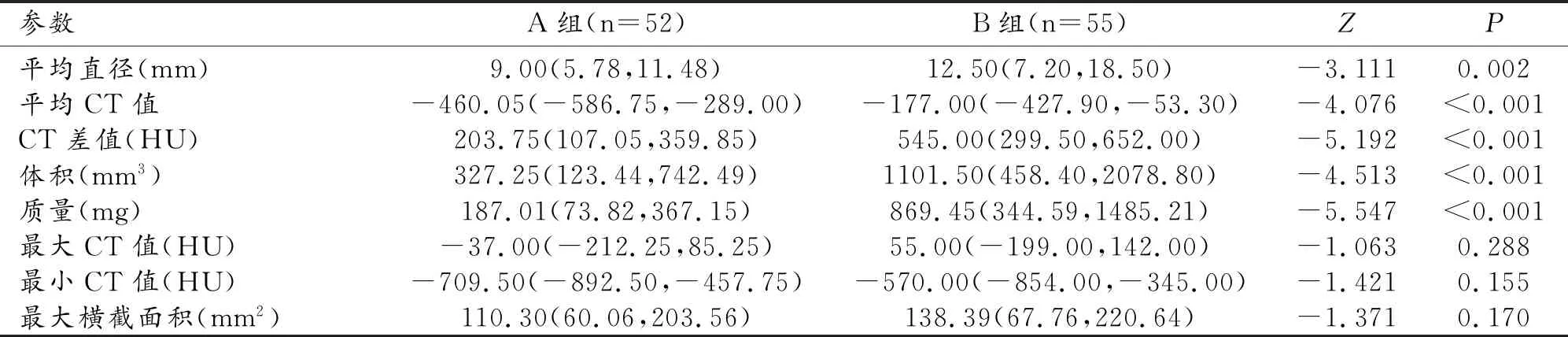
表2 两组患者定量参数比较 [M(Q25,Q75)]
影响患者发生IAC的多因素logistic回归结果见表3。以患者是否发生IAC为因变量,以平均直径、平均CT值、CT差值、体积、质量为自变量,采用进入法建立二元logistic回归模型。结果显示CT差值、质量在模型中均有统计学意义(P<0.05)且均为影响患者发生IAC的独立危险因素即CT差值每增加一个单位,患者发生IAC的风险是原来的1.006倍;质量每增加一个单位,患者发生IAC的风险是原来的1.004倍。
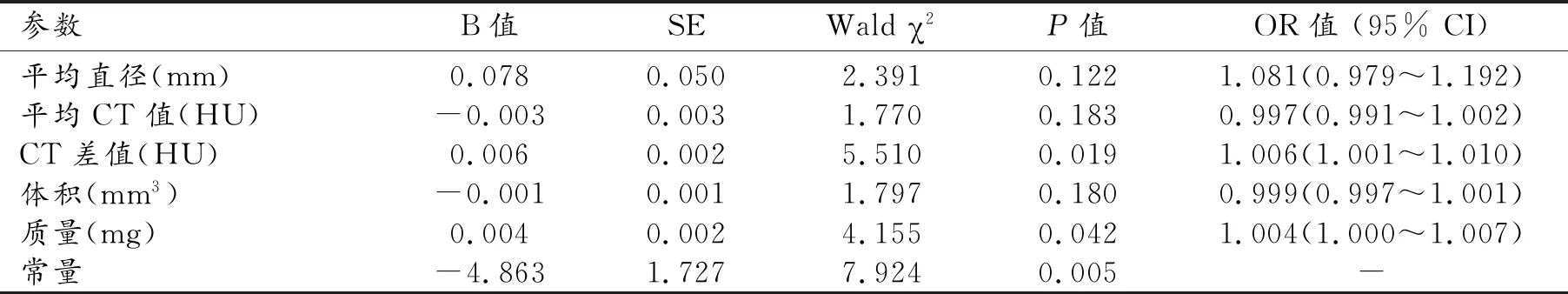
表3 影响患者发生IAC的多因素logistic回归
CT差值及质量鉴别IAC与MIA和浸润前病变的ROC曲线(图4)可知CT差值、质量以及二者联合鉴别IAC的曲线下面积分别为0.791、0.811、0.842,对应P<0.05,说明两指标对鉴别IAC与MIA和浸润前病变均有统计学意义。CT差值鉴别IAC的临界值为342.55 HU,对应的敏感度72.7%,特异度73.1%;质量鉴别患者发生IAC的临界值376.54 mg,对应的敏感度72.7%,特异度80.8%;二者联合鉴别IAC与MIA和浸润前病变对应的敏感度81.8%,特异度75.0%。
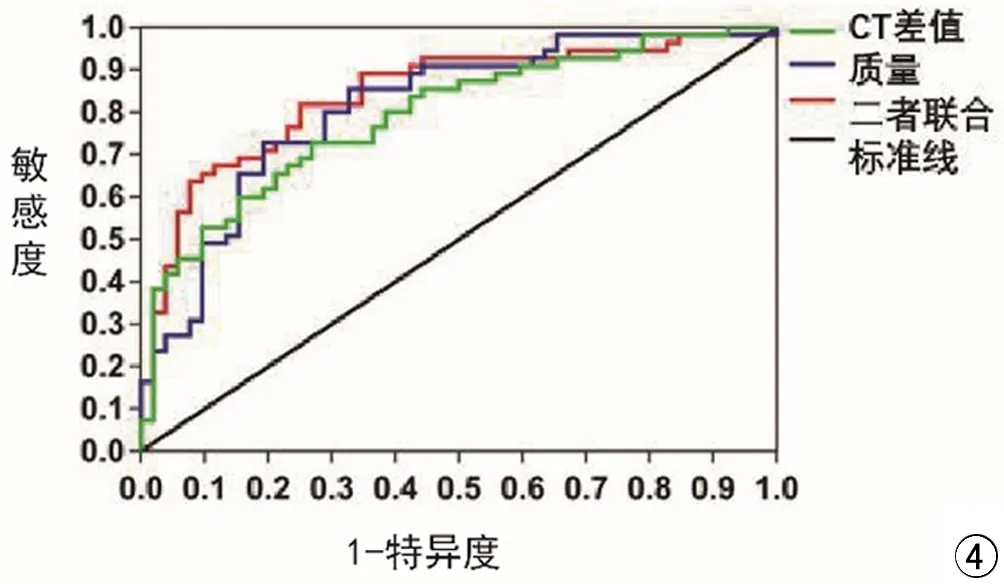
图4 CT差值及质量鉴别发生IAC的ROC曲线
讨 论
以往的研究AIS和MIA通常被视为叶下切除的指标,若进行完全切除且切缘为阴性,其术后5年无病生存率几乎为100%[13]。因此,使用CT评价SSNs的侵袭性可能会影响肺结节管理方法的选择。本研究结果提示SSNs的CT定量指标对鉴别IAC与MIA及浸润前病变有重要意义且发现SSNs的CT差值和质量是发生IAC的独立危险因素,其最佳临界值分别为342.55 HU(敏感度72.7%,特异度73.1%)和376.54 mg(敏感度72.7%,特异度80.8%)。
本研究我们采用了不同于其他相关研究的分组方法来分析肺结节的定量影像学特征是否能区分IAC和MIA及侵袭前病变。通常来说AAH不接受手术切除[13];然而,无论是从CT上表现的磨玻璃外观还是其他形态学特征来看AAH都不容易与AIS及MIA区分[14]。Ding等尝试将AIS与MIA作为同一组,研究该组与IAC组的侵袭性[15]。他们认为对于pGGNs其最大直径>12 mm是IAC的可靠预测因子,而PSNs其最大直径>15.4 mm更倾向IAC,但并未将AAH考虑在内。本研究11个AAH被纳入MIA及浸润前病变组(A组),作为对Ding等研究的补充,这可能导致两项研究结果的差异。因此,这两项研究的结果仍有待进一步验证。
值得一提地是我们只纳入直径≤3 cm的pGGNs和实性成分≤5 mm、总直径≤3 cm的PSNs。入选标准的主要原因有3个:首先,取肺结节的直径临界值为3 cm。与直径>3 cm的SSNs相比对于直径≤3 cm的SSNs的管理存在很大争议。其次,0.6~3 cm的pGGNs临床T分期被分为cTis;pGGNs>3 cm被认为是鳞状为主型腺癌。总直径≤3 cm且实性成分≤5 mm的PSNs认为是cT1mi;如果PSNs的实性成分>5 mm,则T分期由实性成分[16]的大小决定。第三,临床实践中我们发现pGGNs和实性成分≤5 mm的PSNs有相同的生物学行为,因此把他们放在一起。
质量可以同时反映肺结节的体积和密度,从而更准确地反映结节特征[12]。因此,质量有助于鉴别SSNs中IAC的发生,其精确度可能优于直径、密度或体积。本研究单变量分析显示两组患者平均直径、体积、质量等方面存在显著差异,而在二元logistic回归分析中质量的诊断效能更高,其最佳临界值是376.54 mg。Lim等[17]报道鉴别IAC和AIS/MIA的质量最佳临界值是0.472 g,Liu等[10]报告指出区分IAC和AAH/AIS/MIA的质量最佳临界值为386 mg。这种差异可能是由于纳入SSNs的类型和大小不同造成的。本研究我们纳入直径≤3 cm的pGGNs和总直径≤3 cm且实性成分≤5 mm的PSNs,而Lim等[17]仅纳入直径≥1 cm的pGGNs且未纳入AAH;Liu等[10]报告鉴别IAC和AAH/AIS/MIA的质量临界值为386 mg,仅适用于pGGNs。此外,Son等[18]报告IAC与MIA或AIS之间的质量在单变量分析上存在显著差异;但是,在多变量分析中没有显著差异。
以往对SSNs的定量影像学特征分析多集中在最大/最小CT值和平均CT值等[19-21]。但平均 CT 值即使避开血管等部位仍易受患者年龄、病灶的部位、患者不同的呼吸程度、是否合并肺部基础疾病、是否注射对比剂等因素的影响。本研究采用结节与肺组织的CT差值作为定量指标,用来减少各种因素对于研究的影响,具有较可靠的诊断效能。经ROC曲线分析CT差值是鉴别IAC发生的独立危险因素。当 CT 差值>342.55 HU,鉴别SSNs发生IAC的敏感度72.7%,特异度73.1%,AUC 0.791。谢超等报道CT差值作为IAC的预测因素,当阈值为226 HU,敏感度和特异度分别为81.94%和85.71%,AUC为0.87。这种差异可能是由于谢超等仅纳入pGGNs且病理类型未包含AAH造成的。
本研究利用ROC分析危险因素对鉴别IAC和MIA及浸润前病变的诊断价值,经ROC分析,质量和CT差值二者结合起来,AUC值为0.842,这表明与这些因素的单独使用相比联合使用有助于更准确地鉴别IAC的发生。
本研究还存在一些局限性。本研究为回顾性研究,病例数较少,所选择的SSNs仅包含外科手术后的SSNs,排除了有长期随访但没有手术干预的SSNs,样本存在选择偏倚;第二,测量方法存在误差,尽管是计算机自动计算,但人为勾画肺组织的感兴趣区不能避开所有的血管、支气管等,这些都存在误差,影响结果的重复性。
综上所述,我们认为CT差值和质量的最佳临界值分别为342.55 HU和376.54 mg,可作为鉴别IAC与MIA和浸润前病变的可靠指标。联合这两个指标鉴别IAC与MIA和浸润前病变的效能大于单独指标。
