复方阿胶浆质量标准提升研究
2021-10-25刘晓云宋若兰于啊香马嘉慕折改梅
许 啸 ,张 淹,刘晓云,王 宇,刘 越,董 英,宋若兰,于啊香,马嘉慕,折改梅*
1.北京中医药大学中药学院,北京 100102
2.中国热带农业科学院分析测试中心,海南 海口 571101
3.东阿阿胶股份有限公司国家胶类中药工程技术研究中心,山东 聊城 252201
中药复方制剂药味复杂,化学成分种类繁多,其有效、专属的质量可控是其发展的关键因素。当前,很多中药复方制剂质量控制方法存在着仅对部分药味鉴别和缺乏活性成分或者专属性成分的含量测定等不足。因此,中药复方制剂采用全药味鉴别以及有效、特征和专属的成分含量测定等质控思路得到广大科学家的认可[1-2]。
复方阿胶浆(Fufang E’jiao Jiang,FEJ),原方出自明代《景岳全书》中“两仪膏”,由动物药阿胶和4味植物药红参、熟地黄、党参、山楂组成。《中国药典》2020年版复方阿胶浆质量标准仅收录了阿胶、红参、党参、山楂的鉴别方法和总氮量含量测定方法[3]。本研究鉴于国家重点研发计划(2018YFC1707300)全药味整体质控的思路,将一板多鉴法(identification of multi-herbal medicines by a single-thin layer chromatography,IMMS)和一测多评法(quantitative analysis of multi-components by single marker,QAMS)用于复方阿胶浆质量标准提升研究。
IMMS是复方制剂中不同药味使用不同或相同的供试品溶液,在相同薄层色谱条件(吸附剂、展开剂)、使用相同/不同显色方法进行鉴别,可实现在一块薄层板上同时鉴别多个药味。《中国药典》2020年版中,IMMS在牛黄解毒片、清脑降压片等复方制剂中得到了应用[3]。本研究采用IMMS法建立了复方阿胶浆中植物来源中药的薄层色谱鉴别,即“4-3-2-2”模式,4味中药、3种供试品溶液制备方法、2种展开剂、2种对照物的双对照方法,以相对较少的薄层色谱试验次数,进行有效鉴别。
《中国药典》2020年版规定阿胶药材使用L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸4种氨基酸进行含量测定[3]。以药材含量测定指标性成分为依据建立复方制剂含量测定方法,是质量标准中含量测定较为认可的方法。本研究在建立复方阿胶浆4种氨基酸含量测定的基础上,根据L-羟脯氨酸与其他成分的相对校正因子,通过测定L-羟脯氨酸以计算甘氨酸、丙氨酸、脯氨酸的含量,达到一测多评的目的,在一定程度上解决对照品紧缺和检测成本高的问题[4]。
1 仪器与试药
1.1 仪器
华谱科仪Acc horm S6000高效液相色谱仪,配备在线脱气机、四元泵、自动进样器、柱温箱、DAD检测器,华谱科仪(北京)科技有限公司;Waters e2695高效液相色谱,配备在线脱气机、四元泵、自动进样器、柱温箱、UV-Vis检测器,沃特世科技(上海)有限公司;岛津Nexera LC-40高效液相色谱,配备在线脱气机、二元泵、自动进样器、柱温箱、PDA检测器,岛津企业管理(中国)有限公司;Linomat-5半自动点样台,Reportstar薄层色谱摄像系统,瑞士CAMAG公司;BT25S十万分之一电子天平,北京赛多利斯科学仪器有限公司;TD5A-WS台式离心机,常州市万合仪器制造有限公司;8302恒温水浴锅,上海利浦自动化仪表厂;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;KQ-250DE超声波清洗器,昆山市超声仪器有限公司;101FXB-2电热鼓风干燥箱,上海树立仪器仪表有限公司。
Welch Ultimate AQ C18色谱柱(250 mm×4.6 mm,5 μm)、Waters T-nature C18色谱柱(250 mm×4.6 mm,5 μm)、Agilent Zorbax XDB C18色谱柱(250 mm×4.6 mm,5 μm)。硅胶G薄层板(批号HX87113742),购自德国Merck公司。
1.2 试药
对照药材红参(批号121045-201806)、党参(批号121057-201206)、熟地黄(批号121196-202007)、山楂(批号121626-201402)及对照品人参皂苷Rg1(批号110703-201832,质量分数为95%)、党参炔苷(批号111732-201908)、毛蕊花糖苷(批号111530-201914,质量分数为95%)、牡荆素鼠李糖苷(批号111668-200602)、L-羟脯氨酸(批号111578-201602,质量分数为99.9%)、甘氨酸(批号140689-202006,质量分数为100%)、丙氨酸(批号140680-202005,质量分数为99.9%)、脯氨酸(批号140677-201808,质量分数为99.9%),均购自中国食品药品检定研究院。乙腈,批号204197,购自美国Fishier Scientific公司,为色谱纯;异硫氰酸苯酯(PITC),批号C11507973,购自上海麦克林生化科技有限公司;其他试剂均为分析纯。超纯水由实验室Millipore Synergy超纯水系统自制。
1.3 样品
复方阿胶浆(批号1905075、1907011、1907012、1907014、1907015、1907017、1907020、1907021、1907022、1909004、1909007、1909010、1909011、1909013、1909015、1909016)以及批号为1905075批次所对应的红参阴性样品、党参阴性样品、熟地黄阴性样品、山楂阴性样品均由东阿阿胶股份有限公司提供。
2 方法与结果
2.1 IMMS薄层色谱鉴别的建立
2.1.1 红参、党参 取本品20 mL,用水饱和正丁醇振摇萃取3次,每次20 mL,合并正丁醇液。用氨试液30 mL洗涤,弃去水液。再用正丁醇饱和水30 mL洗涤,弃去水液。正丁醇液回收至干,残渣加甲醇1 mL使溶解,作为供试品溶液。另取红参对照药材1 g、党参对照药材1 g,分别加水50 mL,超声处理45 min,滤过,水液浓缩至20 mL,自“用水饱和正丁醇振摇萃取3次”,同法制成对照药材溶液;再取人参皂苷Rg1、党参炔苷对照品适量,分别加甲醇制成含0.5 mg/mL的对照品溶液。
取3批复方阿胶浆(批号1905075、1907011、1907012)及对应批次的红参阴性样品、党参阴性样品各20 mL,自“用水饱和正丁醇振摇萃取3次”,同法分别制成供试品溶液1~3、红参阴性对照溶液、党参阴性对照溶液。
照薄层色谱法(通则0502)试验,吸取上述溶液2~6 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-醋酸乙酯-甲醇-水(15∶40∶22∶10)的下层溶液为展开剂,连续展开3次,取出,晾干,喷以10%硫酸乙醇溶液,105 ℃加热至斑点显色清晰,置日光下检视。结果显示,供试品色谱中,在与对照药材和对照品色谱相应的位置上,显相同颜色的斑点。阴性对照色谱相应的位置上,无斑点干扰,表明该方法专属性、重复性良好。见图1。
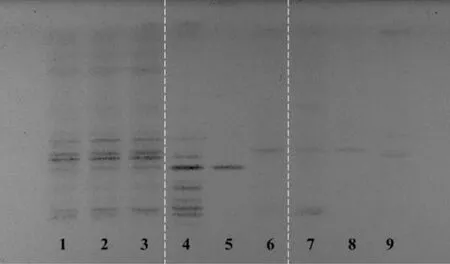
图1 复方阿胶浆中红参、党参薄层色谱图Fig.1 TLC of GRRR and CR in FEJ
2.1.2 熟地黄、山楂
(1)熟地黄供试品溶液的制备:取本品20 mL,加甲醇50 mL,离心,上清液蒸干,残渣加水20 mL溶解,用醋酸乙酯萃取3次,每次20 mL,合并醋酸乙酯液,回收至干,残渣加甲醇1 mL使溶解,作为供试品溶液;另取熟地黄对照药材1 g,加水50 mL,超声处理45 min,滤过,滤液浓缩至20 mL,自“加甲醇50 mL”,同法制成对照药材溶液;再取毛蕊花糖苷适量,分别加甲醇制成含0.5 mg/mL的溶液,作对照品溶液。
(2)山楂供试品溶液的制备:取本品50 mL,加聚酰胺(30~60目)6 g,混匀,静置30 min,用脱脂棉滤过,聚酰胺用水洗脱至近无色,加乙醇50 mL,超声处理10 min,滤过,回收至干,残渣加甲醇1 mL使溶解,作为供试品溶液;另取山楂对照药材1 g,加水50 mL,超声处理45 min,滤过,自“加聚酰胺(30~60目)6 g”,同法制成对照药材溶液;再取牡荆素鼠李糖苷适量,分别加甲醇制成含0.5 mg/mL的溶液,作对照品溶液。
取3批复方阿胶浆(批号1905075、1907011、1907012)及对应批次的熟地黄阴性样品,自“加甲醇50 mL”,同法分别制成熟地黄供试品溶液1~3、熟地黄阴性对照溶液。再取3批复方阿胶浆(批号1905075、1907011、1907012),及对应批次的山楂阴性样品50 mL,自“加聚酰胺(30~60目)6 g”,分别同法制成山楂供试品溶液1~3、山楂阴性对照溶液。
照薄层色谱法(通则0502)试验,吸取上述溶液2~8 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇-甲酸(8∶2∶0.2)为展开剂,连续展开3次,取出,晾干,置紫外灯光(365 nm)下检视。结果显示,供试品色谱中,在与熟地黄对照药材和毛蕊花糖苷对照品色谱对应的位置上,显相同颜色的荧光斑点;熟地黄阴性对照色谱相应的位置上,无斑点干扰,表明该方法专属性、重复性良好。见图2-A。
再喷以三氯化铝试液,置紫外灯光(365 nm)下检视。结果显示,供试品色谱中,在与山楂对照药材和牡荆素鼠李糖苷对照品色谱对应的位置上,显相同颜色的荧光斑点;山楂阴性对照色谱相应的位置上,无斑点干扰,表明该方法专属性、重复性良好。见图2-B。
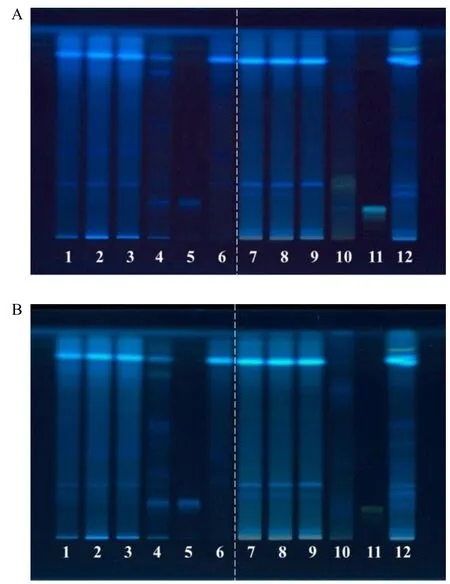
图2 复方阿胶浆中熟地黄和山楂薄层色谱图Fig.2 TLC of RRP and CF in FEJ
2.2 QAMS阿胶含量测定的建立
2.2.1 色谱条件 色谱柱为Welch Ultimate AQ C18柱(250 mm×4.6 mm,5 μm),以乙腈-0.1 mol/L乙酸钠溶液(用醋酸调节pH值至6.5)(7∶93)为流动相A,以乙腈-水(4∶1)为流动相B进行梯度洗脱,梯度洗脱程序:0~11.0 min,100%~93% A;11.0~13.9 min,93%~88% A;13.9~14.0 min,88%~85% A;14.0~29.0 min,85%~66% A;29.0~30.0 min,66%~0% A;体积流量1 mL/min;柱温43 ℃;检测波长254 nm;进样量5 μL。理论板数按L-羟脯氨酸峰计算不低于4000,色谱图见图3。
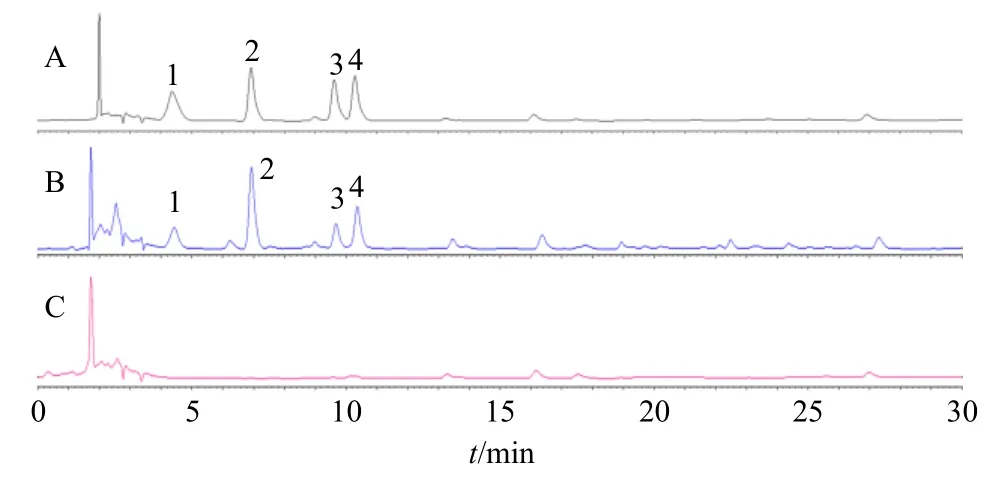
图3 混合对照品 (A)、复方阿胶浆供试品 (B) 和阴性样品(C) 的色谱图Fig.3 HPLC of mixed reference substances (A), FEJ sample(B), and blank sample (C)
2.2.2 供试品溶液的制备 取复方阿胶浆(批号1905075)1支,摇匀,精密量取本品2 mL,置10 mL量瓶中,加0.1 mol/L盐酸溶液稀释至刻度,摇匀。精密量取2 mL,置于顶空瓶中,加盐酸2 mL,加盖密封,于150 ℃水解1 h,放冷,移至蒸发皿中,用水10 mL分次洗涤顶空瓶,洗液并入蒸发皿中,蒸干,残渣加0.1 mol/L盐酸溶液溶解,转移至25 mL量瓶中,加0.1 mol/L盐酸溶液至刻度,摇匀,过滤,即得。
精密量取上述供试品溶液5 mL,分别置25 mL量瓶中,各加0.1 mol/L PITC的乙腈溶液2.5 mL,1 mol/L三乙胺的乙腈溶液2.5 mL,摇匀,室温放置1 h后,加50%乙腈至刻度,摇匀。取10 mL,加正己烷10 mL,振摇,放置10 min,取下层溶液,滤过,取续滤液,即得。
2.2.3 混合对照品溶液的制备 取L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸对照品适量,精密称定,加0.1 mol/L盐酸溶液制成分别含L-羟脯氨酸40µg/mL、甘氨酸80 µg/mL、丙氨酸40 µg/mL、脯氨酸60 µg/mL的混合对照品溶液,即得。
精密量取上述混合对照品溶液5 mL,置25 mL量瓶中,加0.1 mol/L PITC的乙腈溶液2.5 mL,1 mol/L三乙胺的乙腈溶液2.5 mL,摇匀,室温放置1 h后,加50%乙腈至刻度,摇匀。取10 mL,加正己烷10 mL,振摇,放置10 min,取下层溶液,滤过,取续滤液,即得。
2.2.4 线性关系考察 取按“2.2.3”项方法制成的含L-羟脯氨酸0.438 mg/mL、甘氨酸0.774 mg/mL、丙氨酸0.401 mg/mL、脯氨酸0.572 mg/mL的混合对照品溶液。取该混合对照品溶液,用0.1 mol/L盐酸溶液分别稀释0、5、10、25、50倍,自“2.2.3”项中“精密量取上述溶液5 mL”进行操作,即得系列质量浓度溶液。分别进样5 μL,测定L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸4个氨基酸成分的峰面积,以质量浓度(X)对色谱峰面积(Y)绘制标准曲线,进行线性回归,得4种成分回归方程分别为L-羟脯氨酸Y=3×107X+2 596.6,r=1.000 0,线性范围1.75~87.60 μg/mL;甘氨酸Y=4×107X-4 790.7,r=1.000 0,线性范围3.10~155.00 μg/mL;丙氨酸Y=3×107X+13 876,r=0.999 8,线性范围1.60~80.20 μg/mL;脯氨酸Y=3×107X+6 372.65,r=1.000 0,线性范围2.29~114.00 μg/mL;结果表明,各氨基酸在各自的线性范围内线性关系良好。
2.2.5 精密度试验 取供试品溶液(批号1905075),连续进样6次,测定L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸4个氨基酸成分,结果各成分峰面积的RSD分别为1.02%、1.27%、1.22%、1.15%,表明仪器精密度良好。
2.2.6 稳定性试验 取供试品溶液(批号1905075),分别于0、2、4、8、12、24 h进样,测定L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸4个氨基酸成分,结果各成分峰面积的RSD分别为1.24%、1.25%、1.37%、1.33%,表明24 h内,供试品溶液稳定性良好。
2.2.7 重复性试验 取复方阿胶浆(批号1905075)6份,分别制备供试品溶液,测定L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸4个氨基酸成分,结果各成分质量浓度的RSD分别为1.55%、1.96%、2.30%、1.51%,表明方法重复性良好。
2.2.8 加样回收试验 取已测定的复方阿胶浆(批号1905075)6份,精密加入与样品中待测成分含量相当的氨基酸混合对照品溶液,依法提取测定,计算各成分的回收率。结果表明,L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸的平均回收率分别为97.30%、94.10%、93.98%、97.91%,RSD分别为2.35%、1.59%、2.14%、1.83%,表明方法的准确度良好。
2.2.9 QAMS的建立
(1)相对校正因子(relative correction factor,RCF)的测定:阿胶中的主要成分是胶原蛋白,L-羟脯氨酸是胶原蛋白中特有的氨基酸,其含量在胶原蛋白中比例基本固定[11],因此,选用L-羟脯氨酸作为内参物,根据L-羟脯氨酸与其他成分的RCF来计算其他成分的含量。
取“2.2.4”项下的系列浓度的混合对照品溶液,即得对照品母液(I)、稀释5倍对照品溶液(II)、稀释10倍对照品溶液(III)、稀释25倍对照品溶液(IV)、稀释50倍对照品溶液(V),分别进样。以公式fs/i=fs/fi=AsCi/AiCs(式中As为内参物对照品峰面积,Cs为内参物对照品质量浓度,Ai为待测成分对照品峰面积,Ci为某待测成分对照品质量浓度),分别计算L-羟脯氨酸与甘氨酸、丙氨酸、脯氨酸的RCF分别为0.643、0.939、0.870,RSD分别为2.19%、2.96%、1.89%。
(2)不同进样量对RCF的影响:考察了在不同进样量2、4、5、8、10 μL对RCF的影响。结果(表1)表明,不同进样量下,L-羟脯氨酸与甘氨酸、丙氨酸、脯氨酸的RCF分别为0.647、0.980、0.853,RSD分别为1.20%、1.12%、1.23%,无显著性影响(RSD<3%)。
(3)不同仪器对RCF的影响:考察了不同高效液相色谱仪Acchorm S6000、Waters e2695、岛津Nexera LC-40对RCF的影响。结果(表1)表明,不同高效液相色谱仪中,L-羟脯氨酸与甘氨酸、丙氨酸、脯氨酸的RCF分别为0.661、0.958、0.848,RSD分别为0.87%、1.43%、1.99%,无显著性影响(RSD<3%)。
(4)不同色谱柱对RCF的影响:考察了不同色谱柱Waters T-nature C18、Agilent Zorbax XDB C18、Welch ultimate AQ C18对RCF的影响。结果(表1)表明,不同色谱柱中,对L-羟脯氨酸与甘氨酸、丙氨酸、脯氨酸的RCF分别为0.654、0.954、0.857,RSD分别为1.29%、0.06%、0.70%,无显著性影响(RSD<3%)。
(5)RCF的确定:综合以上对RCF影响因素的考察,对所得数据取平均值,最终确定L-羟脯氨酸与甘氨酸、丙氨酸、脯氨酸间的RCF分别为0.651、0.958、0.857,RSD分别为1.20%、1.78%、1.09%。结果见表1。
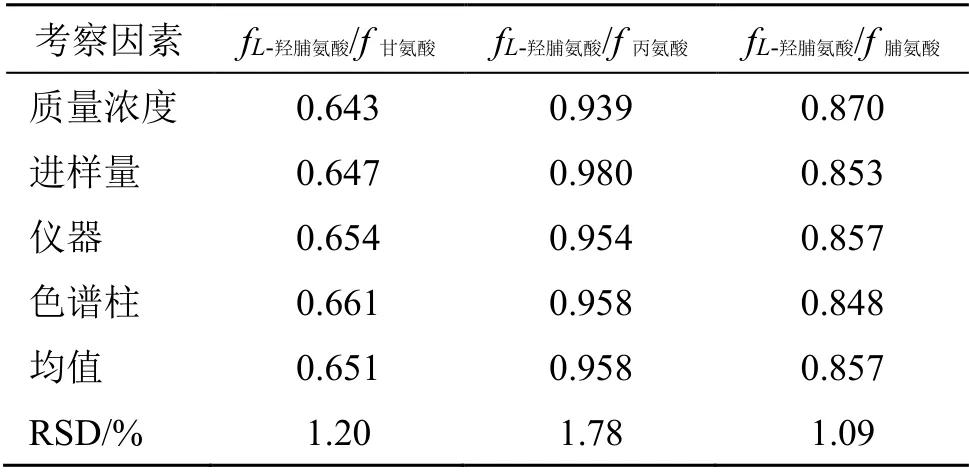
表1 各成分的RCFTable 1 RCF of each component
(6)待测组分色谱峰的定位:当仅使用L-羟脯氨酸作为对照品时,为了能够准确确认甘氨酸、丙氨酸和脯氨酸色谱峰的位置,利用相对保留值定位,即确认内参物的保留时间,加上相对保留值,再根据峰形判断,辨别目标峰的准确峰位置。
考察了采用不同仪器Acchorm S6000、Waters e2695、岛津Nexera LC-40和不同色谱柱Waters Tnature C18、Agilent Zorbax XDB C18、Welch ultimate AQ C18时,L-羟脯氨酸色谱峰与甘氨酸、丙氨酸和脯氨酸色谱峰的相对保留值(tis=tRi/tRs,公式中ti/s为相对保留时间,tRi为待测成分对照品保留时间,tRs为内参物保留时间)。对不同仪器与不同色谱柱所得数据取平均值,结果显示,L-羟脯氨酸色谱峰与甘氨酸、丙氨酸和脯氨酸色谱峰的tis为1.417、1.941、2.084,RSD分别为2.32%、3.26%、3.37%,均小于5%。表明采用相对保留值法对待测成分定位是合理的。
2.2.10 样品测定及验证结果 为了进一步验证所建立的QAMS法的准确性,本研究采用外标法(ESM)和QAMS法15批复方阿胶浆中L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸的含量进行测定。取15个批次(批号1907011、1907012、1907014、1907015、1907017、1907020、1907021、1907022、1909004、1909007、1909010、1909011、1909013、1909015、1909016,编号依次对应为S1~S15)的复方阿胶浆,每个批次平行制备3份供试品溶液,依次进样测定,结果见表2。

表2 EMS法与QAMS法测定4种氨基酸的含量 (n = 3)Table 2 Contents of four amino acids by QAMS and EMS(n = 3)
同时采用t检验、相对偏差法和Pearson相关系数法对两种方法的含量测定结果进行比较分析。经t检验比较,结果显示常规的外标法实测含量值与QAMS计算的含量无显著性差异(P<0.001);相对偏差法计算结果显示,外标法实测含量值与QAMS计算的各成分含量相对偏差分别为1.88%、2.97%、0.74%;Pearson相关系数结果均为1,说明2种方法得到含量相似性极高。以上结果表明ESM法和QAMS法测定结果无显著性差异。
3 讨论
3.1 IMMS薄层色谱鉴别
3.1.1 对照物的选择 复方阿胶浆的制备工艺是红参、党参、熟地黄、山楂水煎煮的提取方法。前期实验采用HPLC-Q-TOF-MSn技术研究表明复方阿胶浆化学成分组成复杂,包括人参皂苷类、苯乙醇苷类、环烯醚萜类、有机酸类等多种结构类型,且多为大极性化合物。
复方阿胶浆质量标准(2020版)红参仅采用对照品(人参三醇)对照的鉴别方法。但是人参三醇为皂苷元,化合物极性较小。人参皂苷Rg1具有良好的调控血管新生的作用[5-6],且该化合物为红参饮片薄层鉴别的对照品之一。因此,本研究中红参的薄层色谱鉴别采用人参皂苷Rg1和红参对照药材的双对照方法。
《中国药典》2020年版中,复方阿胶浆山楂的鉴别方法是采用山楂对照药材进行对照。《中国药典》收录的山楂药材及含有山楂的复方制剂鉴别方法多用熊果酸作为对照品。复方阿胶浆化学成分组成研究中未发现熊果酸,这可能与其极性较小有关。牡荆素鼠李糖苷属于黄酮二糖苷类化合物,主要分布于山楂叶和山楂中,具有调节血管内皮细胞产生的血管活性物质、改善心肌供血量等作用[7-8]。本研究采用山楂对照药材和牡荆素鼠李糖苷对照品的双对照方法。
3.1.2 供试品制备方法的优化 《中国药典》2020年版复方阿胶浆质量标准中未收录熟地黄的薄层鉴别方法。含有熟地黄的口服液体制剂,多以熟地黄对照药材为对照物,其供试品溶液制备方法多采用醋酸乙酯溶剂萃取富集。毛蕊花糖苷易溶于醋酸乙酯[9]。因此,本研究中熟地黄薄层色谱鉴别的供试品溶液制备采用甲醇沉淀蛋白后,醋酸乙酯萃取富集的方法。拟将山楂薄层色谱鉴别采用熟地黄相同供试品制备方法,但经过多次尝试,均不能满足鉴别的专属性要求。山楂的供试品溶液的制备方法采用复方阿胶浆质量标准(2020版)鉴别项下山楂的薄层色谱鉴别的供试品制备方法。
《中国药典》2020年版中收录含有红参的复方制剂在薄层色谱鉴别中供试品溶液的制备多采用水饱和正丁醇萃取皂苷类成分。结合参芪口服液、归脾合剂等复方制剂质量标准,党参的薄层色谱鉴别的供试品溶液制备也使用水饱和正丁醇溶液萃取的方法[3]。再者,现有的供试品制备方法中,对皂苷类成分如人参皂苷、黄芪甲苷等多采用1%~2%氢氧化钠溶液(pH 13.40)或浓氨试液(pH 11.12)多次洗涤正丁醇萃取液。文献报道党参炔苷在碱性溶液pH值大于12时,对其稳定性影响较为显著[10],因此,以党参炔苷为对照品时,供试品溶液的制备不宜用强碱性的氢氧化钠溶液或浓氨试液(pH>12)进行处理。本研究对不同浓度的氢氧化钠试液及氨试液进行考察,最终确定使用水饱和正丁醇用量(20 mL)的1.5倍体积比的弱碱性氨试液(30 mL)洗涤1次。
3.1.3 展开方法 薄层同向多次展开技术是薄层展开一定展距后,取出晾干,再进行展开。多次展开等于延长展开距离,从而提高了分离效果[11]。本研究党参阴性样品和党参炔苷对照品在同一比移值(Rf)均存在斑点,无法满足党参鉴别的专属性要求。将展开后的薄层板晾干后继续在同一展开剂中展开,连续展开3次,有效区别了干扰斑点与鉴别斑点。该方法为其他中成药的质量控制的鉴别提供了借鉴。
3.2 QAMS含量测定
3.2.1 指标成分的选择 阿胶是复方阿胶浆中的君药,占据重要的地位。复方阿胶浆现行质量标准中含量测定项仅有总氮量一项,该质控方法专属性较差[12]。阿胶的化学成分主要为驴皮所含原胶原的降解物,包括明胶、蛋白质及多种氨基酸。其中氨基酸作为蛋白质的基本结构单位,也是生物代谢过程中的重要物质[13]。L-羟脯氨酸是胶原蛋白中特有的氨基酸,其含量在胶原蛋白中比例基本固定[14]。甘氨酸、丙氨酸、脯氨酸在阿胶中含量较高[15]。《中国药典》2020年版阿胶药材含量测定的指标成分也是L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸。因此,选用这4个成分作为指标成分的复方阿胶浆含量测定方法,其专属性和有效性更好。再者可以有效地控制从单味药(阿胶)到成方制剂(复方阿胶浆)的转移和传递过程。
此外,将QAMS应用于4种氨基酸的含量测定,可以改善检测多种指标成分检测而造成的操作繁琐、成本高、耗时长等现状。建立一种测定单个有效成分实现同时测定多个有效成分的快速测定方法,可以很大程度上克服对多指标成分质量控制的限制[16]。
3.2.2 测定方法的优化 以《中国药典》2020年版中阿胶药材的测定方法为基础,本研究对复方阿胶浆样品的稀释倍数、盐酸的用量、水解时间和水解温度进行了考察,以确定复方阿胶浆样品酸水解的实验条件。同时也考察了PITC的用量对衍生化的影响。研究发现0.5倍和1倍量PITC反应后,氨基酸含量无明显差异。考虑到PITC对色谱柱损害较大,因此,使用0.5倍量PITC试剂,并使用等体积的正己烷萃取除去衍生化试剂,避免色谱柱柱效降低[17]。
利益冲突所有作者均声明不存在利益冲突