温度和起始密度比对舟形藻和小球藻生长和竞争的影响
2021-10-23李晓莉代梨梨
李晓莉,陶 玲,代梨梨,彭 亮,李 谷
(中国水产科学研究院长江水产研究所,湖北 武汉 430223)
浮游微藻在池塘养殖中具有举足轻重的作用,对于维持池塘生态系统的正常功能、稳定池塘环境十分重要。建立优良的藻相一直是水产科技工作者追求的目标,优良的藻相需要多种有益藻共存。小球藻 (Chlorella vulgaris) 为绿藻门单细胞藻类,以光合自养生长繁殖,分布极广泛,是养殖水体中常见的有益藻类,近年的研究常把小球藻作为处理养殖尾水及调控养殖水体的重要藻种[1-2]。舟形藻(Navicula) 隶属于硅藻门、羽纹硅藻纲,是一种分布广泛的单细胞硅藻,因其易于生长、生物量较大,在海水养殖中是很多珍贵水生动物的天然饵料[3-5],在淡水养殖中,舟形藻也因易被滤食性鱼类摄食和消化而有利于鱼类产卵率和生长率的提高[6-7]。小球藻和舟形藻作为养殖中的有益藻,能否共同成为池塘藻相中的优势种、其相互之间的竞争关系以及影响因素等研究尚未见报道。
种间竞争是2种或以上生物共同利用同一资源而产生的相互作用,研究其机理有助于进一步了解竞争生物的生长及抑制规律,可用来调控生物的生长和繁殖,进行有害生物的防治和有益生物的共培养利用[8]。温度、细胞起始密度比是影响藻类生长和竞争的重要因素[9-10],其中,温度通过改变细胞膜流动性、脂质组成和酶活性对藻类产生影响;初始藻细胞密度通过产生的化感物质数量和有限营养物质占比,对藻类竞争表现出直接或间接影响[11-12]。本文研究了不同温度和起始密度比对小皮舟形藻(N. pelliculosa) 和小球藻生长和竞争的影响,为利用种间竞争进行有益微藻共培养和构建池塘优良藻相提供参考依据。
1 材料与方法
1.1 实验材料
实验所需小皮舟形藻 (FACHB-1709) 和小球藻(FACHB-1458) 均购自中国科学院水生生物研究所。培养基为BG11与CSI混合培养基 (体积比为1∶1)。将藻种接种到无菌培养基中,放入光照培养箱进行扩大培养,培养条件为:温度25 ℃,光照强度 3 000 lx,光周期 12 L∶12 D。藻种经扩培至所需生物量后,摇匀并计数,供实验接种使用。
1.2 实验设计
实验分为单种培养和混合培养。1) 单种培养:将小皮舟形藻和小球藻分别接入预先装有灭菌培养基的三角瓶中进行培养;2) 混合培养:将小皮舟形藻和小球藻按实验设计的密度比接入同样处理的三角瓶中进行培养,每个处理设3个平行。不同培养温度和起始密度比见表1。培养条件与藻种扩培条件一致。每3 h摇晃三角瓶,每4 d更换30%新鲜培养基。
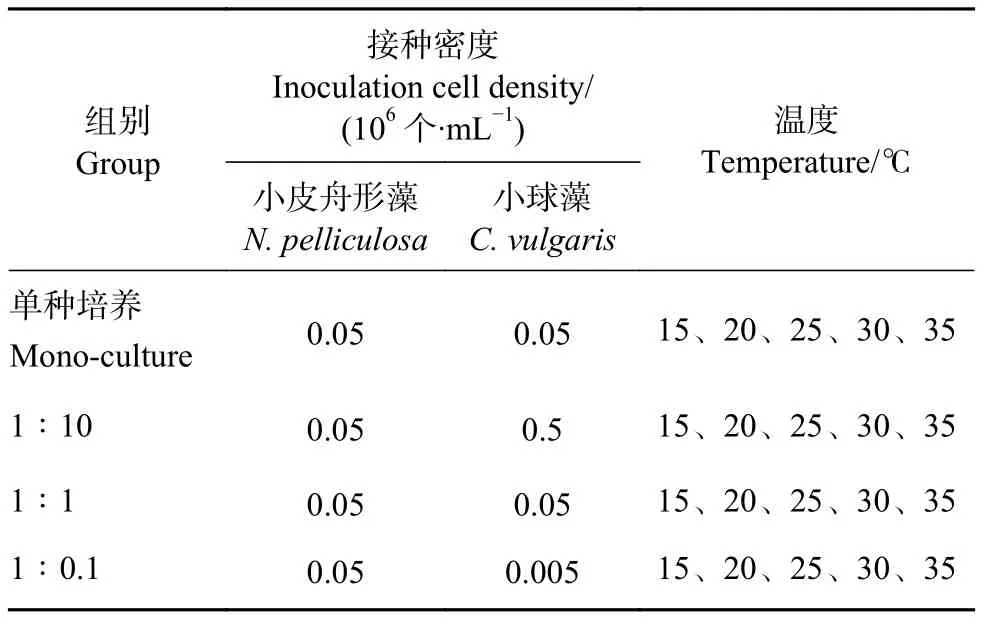
表1 各处理组藻种接种数量和温度设置Table 1 Inoculation quantity of each algae and setting of temperature
1.3 细胞计数
自接种之日起,每2 d在同一时间取样0.1 mL,滴加于浮游植物计数框中,置于显微镜下观察并计数。取样在超净工作台中进行。
1.4 数据整理
生长曲线拟合以逻辑斯谛方程拟合藻类的增长过程[13]。首先进行参数估计,以每个处理组的最大生物量 (Nmax) 作为各自的K估计值。应用逻辑斯谛方程的对数形式 (式1),以最小二乘法进行回归分析,获得该方程的截距和斜率作为a和r的估计值。

式中:N为藻类生物量;K为最大生物量;r为内禀增长率;t为培养时间。
竞争抑制参数的计算参考孟顺龙等[14]、茅华等[15]的方法,利用Lotka-Volterra竞争模型的差分形式 [式 (2)、(3)]计算竞争抑制参数。

式中:Nnn和Ncn分别为混合培养中的小皮舟形藻和小球藻在时间 tn时的数量 (106个∙mL−1);Npn−2和Ncn−2分别为混合培养中小皮舟形藻和小球藻在时间 tn−2时的数量 (106个∙mL−1);rp和 rc分别为小皮舟形藻和小球藻的内禀增长率 (由单种培养经回归计算获得);Kp和Kc分别为小皮舟形藻和小球藻的最大环境容量 (由单种培养获得);α和β分别为混合培养中小球藻对小皮舟形藻和小皮舟形藻对小球藻的竞争抑制参数。
1.5 统计分析
采用SPSS 15.0软件进行统计分析。用Oneway ANOVA 检验不同条件下各指标显著性差异;P<0.05为差异显著。
2 结果
2.1 小皮舟形藻在不同条件下的生长情况
小皮舟形藻的生长在低温时呈先升高后降低的趋势 (图1)。10 ℃时细胞生长缓慢,除1∶10组外,基本在第6—第8天出现峰值后逐渐下降,然后再逐渐升高。20~30 ℃时细胞密度呈逐渐升高的趋势,在细胞培养结束时达到峰值,35 ℃时小皮舟形藻不能生长,逐渐空泡化死亡,因此对35 ℃下各实验组数据未做分析。无论是单种培养还是混合培养,细胞峰值均随温度的升高逐渐增大 (表2)。单种培养峰值介于 0.31~0.50×106个∙mL−1,混合培养组峰值介于 0.28~1.03×106个∙mL−1。从细胞峰值来看,25~30 ℃更适合小皮舟形藻的增殖。

图1 不同温度和起始密度比条件下小皮舟形藻的密度变化Figure 1 Variation in cell densities of N. pelliculosa at different temperatures and initial cell density ratios
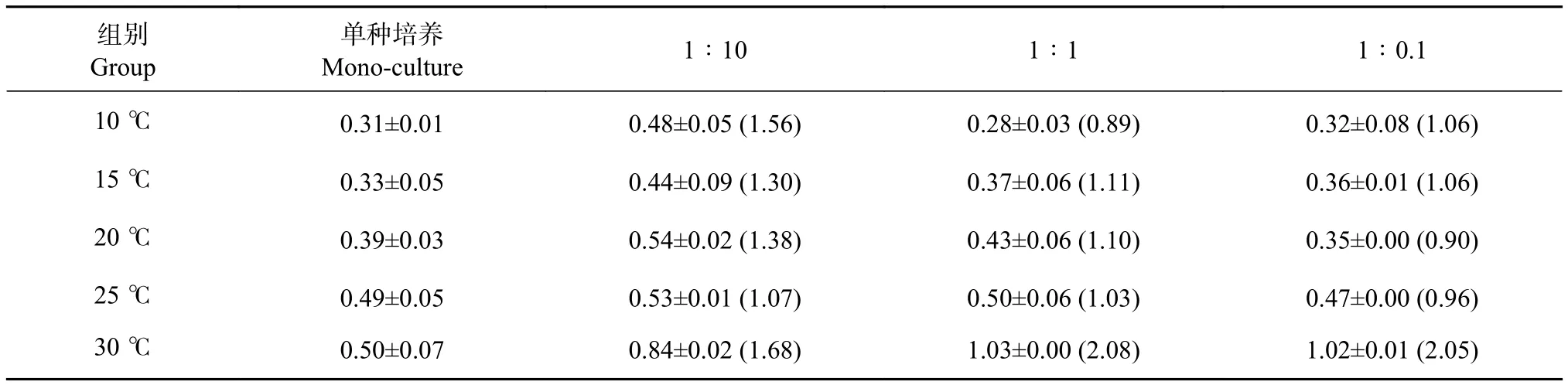
表2 小皮舟形藻在不同温度和起始密度比条件下细胞峰值Table 2 Maximum cell density of N. pelliculosa at different temperatures and initial cell density ratios106 个·mL−1
混合培养中,10~25 ℃下1∶1和1∶0.1组与单种培养组无显著差异 (P>0.05),1∶10组在各个温度下峰值均高于单种培养组,按照温度从低到高依次为单种培养组的1.56、1.34、1.38和1.07倍,表明小球藻不会抑制小皮舟形藻的生长,且在一定范围内,其密度越大越能促进小皮舟形藻的生长。30 ℃下,混合培养组的细胞峰值均显著高于单种培养,1∶10、1∶1和1∶0.1组分别是单种培养组的1.68、2.08和2.05倍。
2.2 小球藻在不同条件下的生长情况
根据小球藻在各处理组的生长曲线和细胞峰值(图2和表3) 可以看出,各处理组均表现出温度对小球藻生长有显著影响。10 ℃下,细胞几乎停止生长,由于细胞分裂惯性,均在第2天达到峰值后逐渐下降。15 ℃下,小球藻生长较缓慢,单种培养组的峰值为 0.39×106个∙mL−1;20~35 ℃ 下,小球藻细胞生长迅速,细胞密度均在培养结束时达到最大,单种培养条件下细胞峰值依次为4.52×106、5.45×106、10.00×106、14.15×106个∙mL−1,从细胞峰值来看,35 ℃更适合小球藻的增殖。
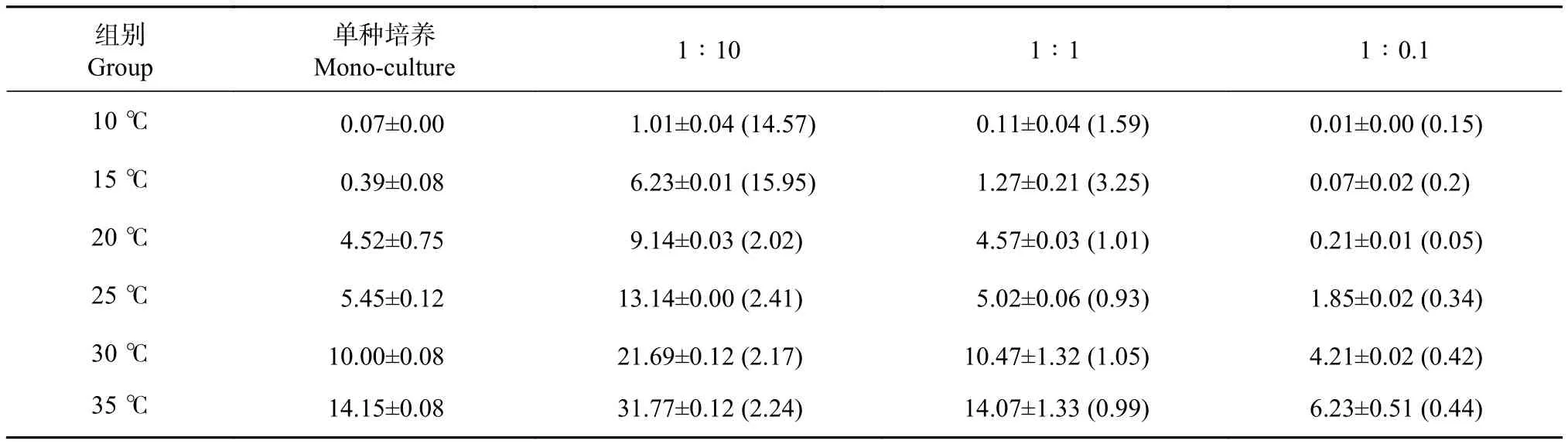
表3 小球藻在不同温度和起始密度比条件下的细胞峰值Table 3 Maximum cell density of C. vulgaris at different temperatures and initial cell density ratios106 个·mL−1
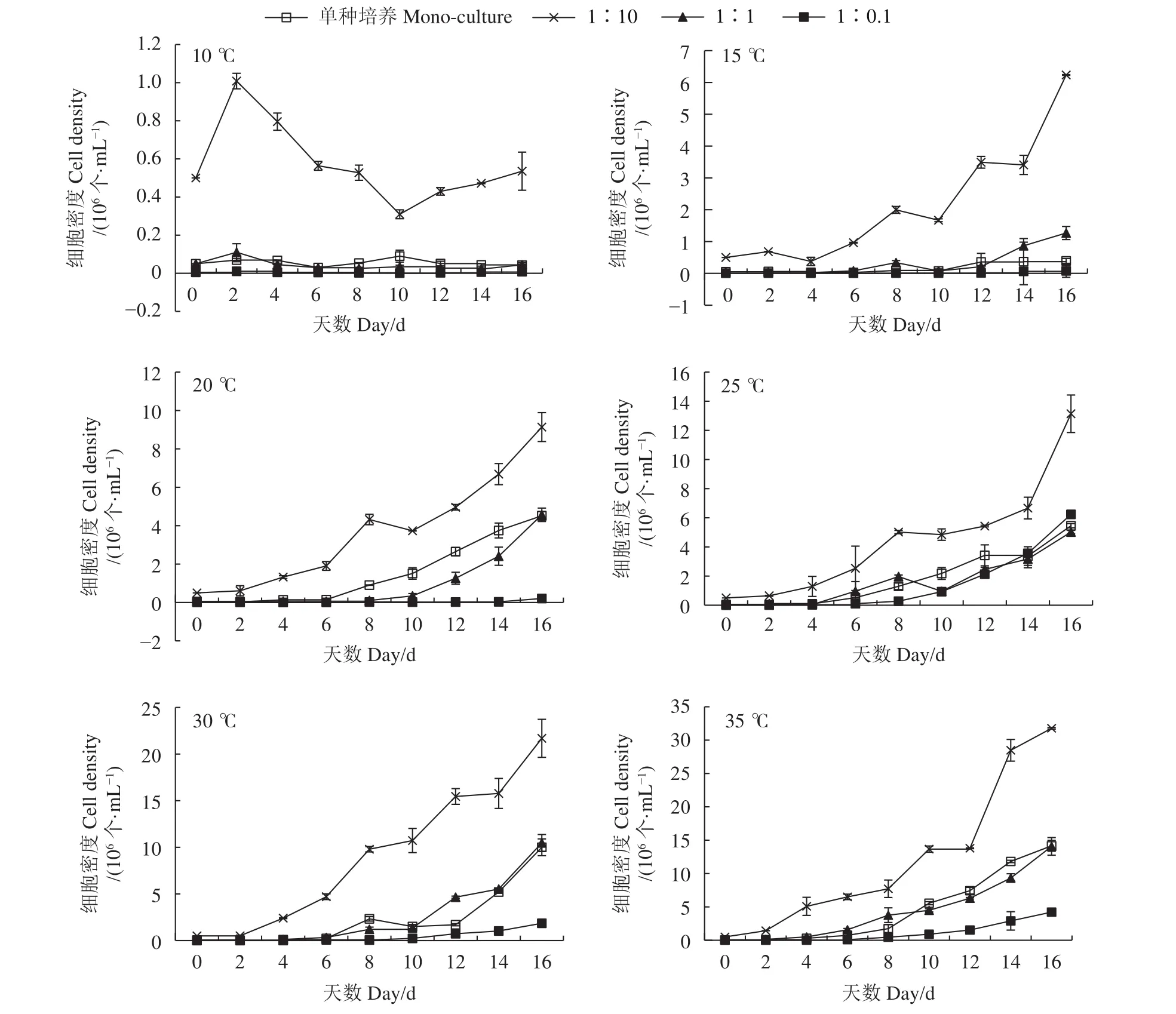
图2 不同温度和起始浓度比条件下小球藻的密度变化Figure 2 Variation in cell densities of C. vulgaris at different temperatures and initial cell density ratios
混合培养中,1∶10组在各温度下生长趋势和峰值均优于单种培养,在不适合小球藻生长的低温情况下,也可以达到单种培养的14.57倍 (10 ℃下1∶10组);1∶1组中,除15 ℃组细胞峰值显著高于单种培养 (P<0.05) 外,其余温度组均与单种培养差异不显著 (P>0.05);1∶0.1组中细胞峰值均显著低于单种培养 (P<0.05),说明在舟形藻共培养中,增大小球藻的接种密度能够显著增加其在混养体系中的细胞数量,反之则显著降低其在混养体系中的细胞数量。
2.3 不同条件下小皮舟形藻和小球藻的生长速率
小皮舟形藻的生长速率随温度升高呈上升趋势(图3),变化介于0.12~0.16;混合培养中小皮舟形藻的生长速率均高于单种培养,1∶1和1∶0.1组与单种培养组相比差异不显著 (P>0.05),1∶10组则显著高于单种培养组 (P<0.05),均值大小依次为1∶10组>1∶1组>1∶0.1组>单种培养组。在10~25 ℃下生长速率随着混养体系中小球藻比重下降逐渐降低,介于0.12~0.20,30 ℃时各组无显著差异 (P>0.05)。
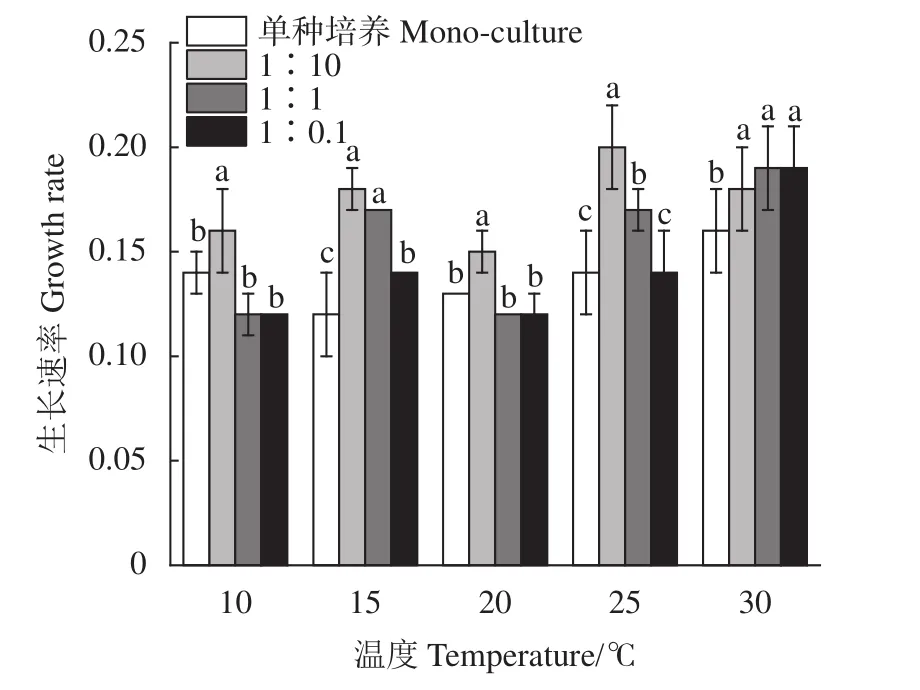
图3 不同条件下小皮舟形藻的生长速率Figure 3 Growth rate of N. pelliculosa under different conditions
小球藻的生长速率随温度升高显著上升 (图4),35 ℃时达到最大值,变化介于0~0.35。混合培养中,随着小球藻初始密度降低生长速率逐渐升高,1∶10组显著低于单种培养组 (P<0.05),1∶1组与单种培养组相比差异不显著 (P>0.05),1∶0.1组则显著高于单种培养组 (P<0.05)。表明小球藻的起始接种密度可能是引起生长速率差异的原因。

图4 不同条件下小球藻的生长速率Figure 4 Growth rates of C. vulgaris under different conditions
2.4 不同条件下小皮舟形藻和小球藻的竞争抑制参数
以单独培养中拟合获得的小皮舟形藻和小球藻种群环境容量 (K)、内禀增长率 (r) 以及混合培养中拐点后的小皮舟形藻和小球藻细胞密度代入Lotka-Volterra竞争模型,计算各自的竞争抑制参数 (α、β)。10 ℃ 下,小皮舟形藻生长极缓慢,小球藻则停止生长;35 ℃小皮舟形藻死亡。因此,10和35 ℃下,各实验组未进行竞争参数计算。
不同温度和起始密度下,α随温度升高而增大,变化范围较小 (−4.66~0.06,表4),说明小球藻的共存对小皮舟形藻的竞争抑制作用较小,且小球藻的存在可能会促进小皮舟形藻的生长。随着小球藻接种比例降低,α的绝对值逐渐减小,说明随着小球藻密度降低,其对小皮舟形藻的影响逐渐减小。

表4 不同温度和起始密度比条件下小皮舟形藻和小球藻之间的竞争抑制参数Table 4 Competition inhibition parameters of N. pelliculosa and C. vulgaris at different temperatures and initial cell density ratios
对小球藻而言,随着温度的升高,1∶1和1∶0.1组中,β呈逐渐升高趋势,变化范围较大(−3.89~26.92),表明温度对β有较大影响,这与小皮舟形藻的适宜生长温度相吻合。1∶10组中β均为负值,说明在高密度小球藻的混养体系中,小皮舟形藻对小球藻的生长可能起促进作用。β随小皮舟形藻比重升高逐渐增大,均值分别为−7.26、3.67和10.18,说明起始密度比对β有较大影响。
3 讨论
3.1 温度对2种微藻生长和竞争的影响
环境变化是藻类季节性演替最主要的影响因子,某些特殊条件 (如低温、光照改变) 导致一些物种不适应,物种发生更替,适应环境的物种占据空余出来的资源空间而大量繁殖[16]。因此,浮游藻类群落结构一直是许多实验的研究对象,尤其是环境因子限制下的种群竞争与变化[17-18]。温度是最重要的环境因子之一,水温不仅影响藻类生命活动的活性、速率,还影响其对水中营养物的利用率和自身代谢率。多项研究表明,硅藻一般适宜较低的温度,在低温水体环境中有较强的竞争力[19],张俊芳等[20]认为汤浦水库每年春季暴发以链状弯壳藻(Achnanthidium catenatum) 和丝状蓝藻 (Filamentous cyanobacteria) 为绝对优势种的藻类水华,其中水温是最为关键的驱动因子,由于春季水温较低,适于链状弯壳藻等硅藻的生长繁殖,当水温逐渐升高,喜高温的丝状蓝藻则开始大量繁殖。本研究中,10~15 ℃下小皮舟形藻生长缓慢,20~30 ℃下生长良好,35 ℃下细胞逐渐空泡化至最后死亡。其中30 ℃下细胞生长峰值显著高于其他实验组,笔者之前的研究显示舟形藻适宜的生长温度为30 ℃[21],王卓等[22]的研究结果为25 ℃,与本研究结果基本一致。同时,30 ℃下的生长速率也显著高于其他组。对小球藻而言,10 ℃下小球藻基本停止生长,15 ℃下生长较缓慢,25~35 ℃下生长迅速,单种培养中35 ℃细胞密度达到峰值,高出10 ℃单种培养组3个数量级,可见温度对小球藻生长的影响非常显著,35 ℃更适合小球藻的增殖。这与前人的报道基本一致[23-24]。
温度对混合培养体系中藻间竞争关系也有显著影响。研究表明,在环境发生改变如温度胁迫等条件下,这种竞争和排斥会发生明显变化,藻类相互间的竞争作用会因温度等变化而进一步强化或减弱[25]。本研究中,30 ℃下混合培养的小皮舟形藻细胞峰值均高于单种培养组,说明小球藻大量繁殖未对舟形藻生长造成竞争抑制,甚至可能因为小球藻的存在或分泌某种物质促进了小皮舟形藻的生长。而低温情况下,小球藻生长缓慢,对小皮舟形藻的影响较小。有研究表明,当温度与藻类适宜温度一致时,其竞争力较强[26],本实验中β在15~30 ℃呈逐渐升高趋势,这与其生长的适宜温度一致。
3.2 种群密度对2种微藻生长和竞争的影响
种群密度是种群增长的重要参数,也是影响种间竞争的重要因素之一。魏杰等[27]在研究蛋白核小球藻 (C. pyrenoidosa, C) 和湛江等鞭金藻 (Isochrysis zhanjiangensis, I) 的种间竞争中发现,ρ(C)∶ρ(I)=1∶4时,湛江等鞭金藻在竞争中占优势;ρ(C)∶ρ(I)=1∶1时,初期湛江等鞭金藻占竞争优势,随蛋白核小球藻的迅速生长,后期蛋白核小球藻占竞争优势;ρ(C)∶ρ(I)=4∶1时,蛋白核小球藻占绝对竞争优势。刘潇等[28]认为在丰富的营养盐环境中,种间竞争具有明显的密度依赖性,根据初始细胞密度的不同,两竞争物种既可以相互排斥,也可能共存。在本实验设定的温度和起始密度比范围内,混养体系中的小皮舟形藻无论在细胞生长趋势、细胞峰值还是生长速率方面,均未表现出小球藻对其竞争者所产生的不利影响,反而因为小球藻的共存促进了生长,且随着小球藻密度增加,这种共存效应愈发明显,表现为密度依赖性共存。
对小球藻而言,1∶0.1组在不同温度下,峰值均低于同温度的单种培养组,1∶10组无论是细胞峰值还是生长趋势均优于其他处理组,说明提高小球藻的接种密度能够显著增加混合体系中的细胞数量,即使在不适合生长的低温情况下,也可以达到单种培养组的14.57倍。从生长速率看,高起始密度组 (1∶10) 生长速率显著低于单种培养组,可能由于营养盐限制,小球藻在生长后期密度较大,虽定期添加新鲜培养基,仍不能满足其迅速增殖的需求,导致细胞生长速率降低。1∶1和1∶0.1组生长速率略高于单种培养组,但差异不显著,说明对其生长速率影响较大的是起始密度,小皮舟形藻的共存对其也有影响,但影响小于起始密度。随着混合培养中小皮舟形藻比例降低,β呈逐渐降低趋势,均值从10.18降至−7.26。即初始细胞密度比决定了二者之间的竞争结果,表现为明显的密度依赖性竞争。
3.3 2种微藻种间竞争结局及应用展望
根据Lotka-Volterra 竞争模型的解释,当1/K1>α21/K2且1/K2>α12/K1时,物种1和物种2的种内竞争强度均大于种间竞争强度,此时两物种稳定共存[29]。本研究中所有处理组均为1/Kc>α/Kp,1/Kp>β/Kc,说明小皮舟形藻和小球藻能够稳定共存。实际生产中,以硅藻为主的藻相和以绿藻为主的藻相被认为对水产养殖有益,前人试图通过各种方法提高其在藻类群落结构中的优势地位。小皮舟形藻和小球藻分别为硅藻和绿藻的代表物种,本研究表明,2种藻在适宜的温度条件下可以共存,小球藻对小皮舟形藻的竞争抑制较小,影响小皮舟形藻生长的主要因子是环境温度。王朝晖等[30]的研究表明虽然初始密度影响甲藻海洋卡盾藻 (Chattonella marina)、锥状斯氏藻 (Scrippsiella trochoidea) 和硅藻中肋骨条藻 (Skeletonema costatum) 细胞种群的初始增长,但在一定环境条件下 (营养、温度、光照和培养容量) 每个物种都有自己的环境容量。本研究中小皮舟形藻在不同温度下最大细胞密度为1.03×106个∙mL−1,远低于小球藻。郑维发等[31]研究发现舟形藻最大细胞密度达 0.23×106个∙mL−1。笔者之前的研究显示,优化培养基中舟形藻最大密度达 3.74×106个∙mL−1,CSI培养基中则仅为1.46×106个∙mL−1,可见舟形藻存在最大环境容量,且最大细胞密度数量级约为 105~106个∙mL−1。另外,虽然小皮舟形藻的共存对小球藻有一定影响,但提高起始浓度会显著增加其细胞密度,在实际生产中可以通过添加小球藻增大其在养殖水体藻相中的竞争优势。
