干露对克氏原螯虾成虾存活、相关代谢酶及组织结构的影响
2021-10-23王源源成永旭李晨露刘明明奚业文朱传忠李嘉尧
王源源,成永旭,李晨露,刘明明,奚业文,朱传忠,李嘉尧
(1. 上海海洋大学/农业农村部淡水种质资源重点实验室/水产科学国家级实验教学示范中心/上海水产养殖工程技术研究中心,上海 201306; 2. 安徽省水产技术推广总站,安徽 合肥 230000;3. 大北农水产科技集团股份有限公司,福建 诏安 363500)
克氏原螯虾 (Procambarus clarkii),俗称小龙虾,属于淡水螯虾[1]。2019年中国克氏原螯虾养殖总产量达208.96×104t,成为产量第一的淡水养殖经济虾类[2]。克氏原螯虾在养殖过程中,可离水存活较长时间,故在其流通过程中多采用干法运输[3]。
干法运输时水产动物常遭受干露胁迫,干露胁迫主要包括失水胁迫和低氧胁迫[4]。失水胁迫使机体水分丧失,打破细胞内外水平衡,造成组织结构损伤;低氧胁迫下机体氧供应不足,制约有氧呼吸,最终导致生理代谢失衡[5-6]。已有研究表明,干露胁迫会影响脊尾白虾[7](Exopalaemon carinicauda) 的呼吸代谢和日本囊对虾[8](Marsupenaeus japonicus) 的抗氧化应激,降低三疣梭子蟹[9](Portunus trituberculatus) 的成活率。克氏原螯虾幼虾免疫系统尚未发育完全,体质弱、抗逆性差,在进行干法运输时成活率低,影响经济效益,有些地区专以运输成虾的方法获得亲本,通过繁育获得虾苗以保证当地的规模养殖[10]。
目前关于干露对克氏原螯虾成虾影响的研究尚未见报道,本研究采用温度为 (16±1) ℃、相对湿度 (Relative humidity, RH) 为 (55±5)% 的干露条件对雌、雄成虾进行不同时间的干露胁迫,通过记录成虾死亡时间、测定相关代谢酶、H.E染色的方法,研究了干露对克氏原螯虾成虾的存活、相关代谢酶和组织结构的影响,为调整其运输时间,改善其运输方式,提高其运输成活率提供参考依据。
1 材料与方法
1.1 实验材料
实验时间为2019年9月,克氏原螯虾取自上海海洋大学崇明基地,选择附肢健全、活力旺盛的雌、雄虾各90尾,将雌、雄各30尾分别暂养于单个循环水槽 (长 293 cm×宽 80 cm×高 20 cm,水深15 cm) 7 d。养殖用水为经充分曝气的自来水,水温为 (23.0±1.0) ℃,pH 为 7.5±0.5,持续充氧以保证水中溶氧充足。在养殖水桶中放入适量假水草,供克氏原螯虾栖息,且减少个体之间互相打斗。每天17时用虹吸管吸出残饵与粪便,并换水1/3以确保养殖水质清洁,投喂虾体质量3%~5%的配合饲料 (大北农水产科技集团股份有限公司)。实验前 24 h 停止投喂;雄虾体质量为 (44.4±6.5) g,体长为 (79.2±3.6) mm;雌虾体质量为 (41.9±5.9) g,体长为 (82.5±3.4) mm。
1.2 实验方法
实验在崇明基地实验室内进行,提前24 h调节加湿器 (广东容声电器,PH-88) 和除湿机(GEDRYC20C),并通过温湿度记录仪 (精创RC-4HC) 显示情况,控制房间温度为 (16±1) ℃,RH为 (55±5)%。
1.2.1 预实验 取雌、雄虾各 8尾,单尾分别装于1 000 mL的聚丙烯 (PP) 盒 (14.9 cm×6.2 cm×15.0 cm),观察并统计克氏原螯虾死亡时间。根据死亡率与时间进行回归分析,建立回归方程,根据方程求得干露条件下的半致死时间 (LT50)。
1.2.2 正式实验 雌、雄虾各 60尾,干露前擦干体表水分后称质量,即为初始湿体质量 (WO),于上述温湿度条件下进行干露胁迫,每6 h观察虾体存活情况,以晃动PP塑料盒虾体包括触角无反应判定虾体死亡,分别在第0、第3、第6、第12、第24、第36、第48、第60、第72、第96、第132和第144小时随机挑选雌、雄虾各4尾进行采样。
1.2.3 样品采集与处理 采样时将克氏原螯虾体表水分擦干后称质量 (WT),计算其体质量消耗率后 [体质量消耗率=(WO−WT)/WO×100%],置于解剖盘上,剪开头胸甲和腹部,取出肝胰腺和肌肉,解剖盘上将其快速切割成约0.2 g的小块,分装于0.2 mL离心管中,液氮速冻后放入−80 ℃冰箱中保存用于酶活力测定。另取适量肝胰腺、鳃和肌肉组织于Bouin's液中固定,用于后续组织切片的制作与观察。
1.2.4 酶活力测定 样品按质量体积比 1∶9加入0.9%生理盐水,冰上研磨将其制成10%的组织匀浆,离心取上清液待测。乳酸脱氢酶 (LDH) 活力采用苏州科铭生物技术有限公司的试剂盒进行测定,琥珀酸脱氢酶 (SDH) 活力和乳酸 (LA) 浓度采用南京建成生物工程研究所试剂盒测定,具体方法参照试剂盒说明书操作。LDH酶活的单位定义为每克组织每分钟催化产生1 nmol丙酮酸定义为1个酶活力 (U·g−1)。SDH酶活的单位定义为每毫克蛋白每分钟使反应体系的吸光度降低0.01为1个比活性单位。
1.2.5 组织切片 Bouin's液固定 24 h 后换70%乙醇并进行乙醇梯度脱水,二甲苯透明,石蜡包埋,切片机 (LEICA RM2125 RTS) 5~7 μm 切片,苏木精-伊红染色,中性树胶进行封片,研究级显微镜 (ECLIPES 80i) 观察并拍照。
1.3 数据分析
采用SPSS 19.0软件进行数据分析,实验结果以“平均值±标准差 ()”表示,不同干露时间点数据运用单因素方差分析 (One-way ANOVA)进行比较,差异显著时采用Duncan's多重比较,P<0.05认为差异显著。
2 结果
2.1 预实验结果分析
预实验雌、雄克氏原螯虾死亡情况见图1。实验开始第75小时雄虾开始出现死亡,在干露258 h后全部死亡;雌虾第82小时开始死亡,在干露272 h后全部死亡。将雌、雄虾死亡率与时间进行回归分析,分别得到干露时间与累积死亡率的直线关系,线性显著相关。由线性回归方程可以得到该干露胁迫条件下克氏原螯虾雄虾的LT50为148.36 h,雌虾的 LT50为 144.01 h。
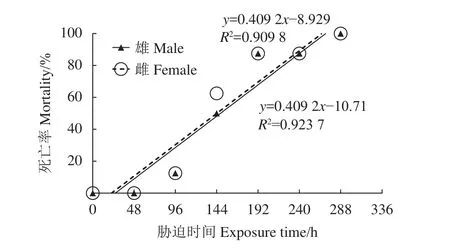
图1 干露胁迫下克氏原螯虾的死亡率Figure 1 Mortality of P. clarkii in air exposure periods
2.2 克氏原螯虾的体质量消耗率分析
克氏原螯虾成虾的体质量消耗率随干露时间的延长逐渐增大 (图2)。干露前期雌、雄虾体质量消耗率无显著差异,雄虾体质量消耗率在干露第72和第132小时出现显著升高 (P<0.05),雌虾体质量消耗率在干露第36、第60和第72小时出现显著升高 (P<0.05),干露48 h后,在同一干露时间雌虾的体质量消耗率均高于雄虾。
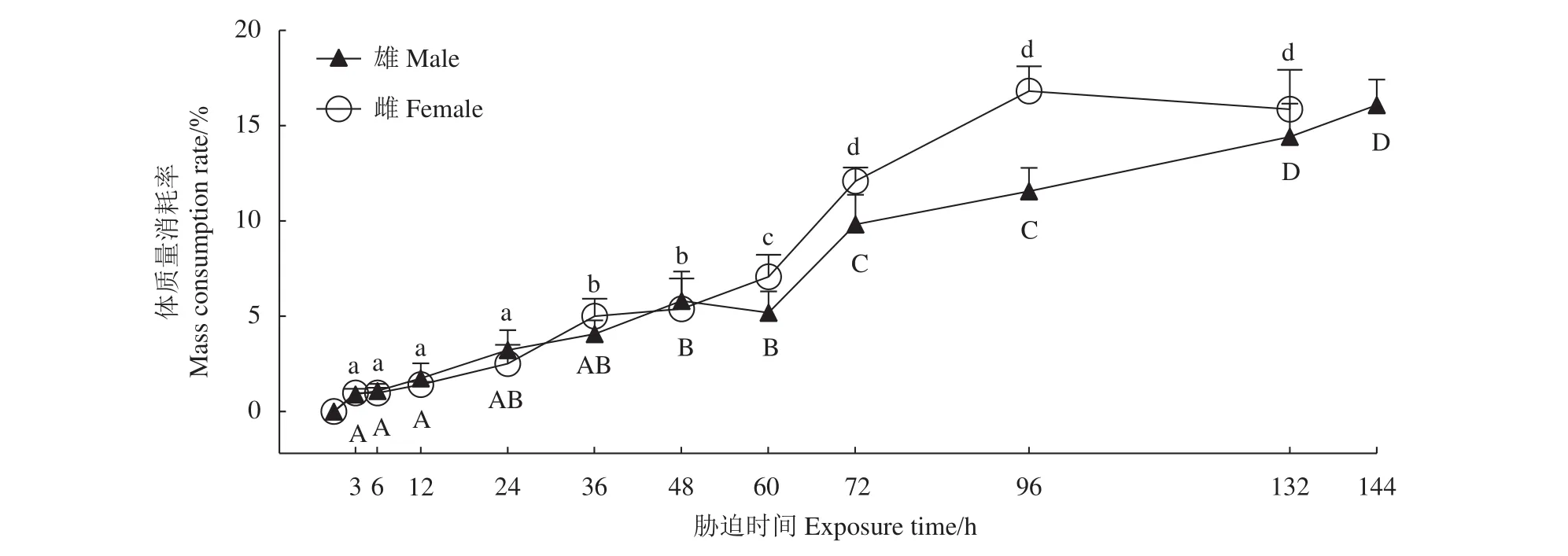
图2 干露胁迫下克氏原螯虾的体质量消耗率大写字母不同表示雄虾不同胁迫时间组的差异显著 (P<0.05),小写字母不同表示雌虾不同胁迫时间组的差异显著 (P<0.05)。Figure 2 Mass consumption rate of P. clarkii in air exposure periodsValues with different uppercase and lowercase letters indicate significantly difference in male and female crayfish among different groups, respectively (P<0.05).
2.3 克氏原螯虾LDH活力的变化
2.3.1 干露胁迫对肝胰腺 LDH 活力的影响 雄虾肝胰腺LDH活力在第6、第12、第24和第36小时呈逐级递增趋势 (图3-a),在第36小时达到最大(204.16 U·g−1),在随后的第 48、第 60和第 72小时 LDH 活力仍显著高于 0 h 组 (P<0.05),但相比前期胁迫稍有降低。在第96、第132和第144小时雄虾LDH活力无明显变化 (P>0.05)。雌虾肝胰腺LDH活力在整个干露时间段内呈现先上升后下降的趋势 (图3-b),在干露第3和第6小时LDH活力显著降低 (P<0.05),在第12、第24和第48小时LDH相比0 h组有所升高 (P<0.05),在第24小时达到峰值 (154.17 U·g−1)。干露第 36小时无显著差异 (P>0.05)。在干露后期的第60、第72和第96小时雌虾肝胰腺LDH显著低于干露0 h组(P<0.05)。
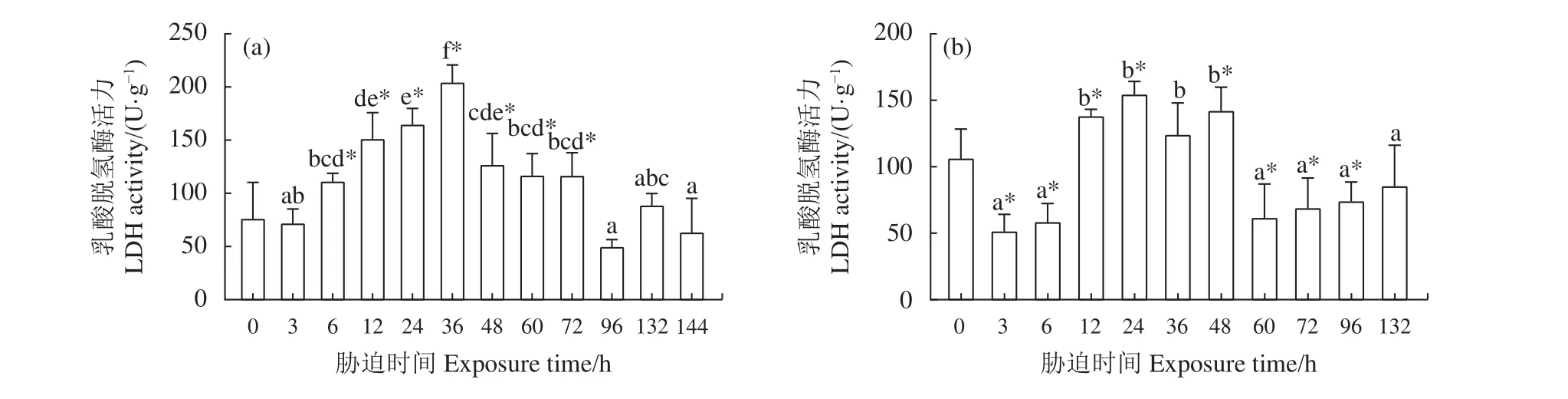
图3 干露胁迫对克氏原螯虾雄虾 (a) 和雌虾 (b) 肝胰腺乳酸脱氢酶活力的影响*. 各组与0 h组的差异显著 (P<0.05);不同字母上标表示除0 h组外不同胁迫时间组的差异显著 (P<0.05);后图同此。Figure 3 Effect of dry exposure on hepatopancreas LDH activity of male (a) and female (b) P. clarkii*. Significant difference between each group and 0 h group (P<0.05); different letters represent significant difference among different groups except 0 h group (P<0.05). The same case in the following figures.
2.3.2 干露胁迫对肌肉 LDH 活力的影响 雄虾肌肉LDH活力见图4-a,在干露24、第36、第48和第60小时显著高于0 h组,在第48小时达到峰值 (120.22 U·g−1),随后 LDH 活力与 0 h 组无显著差异 (P>0.05)。随着干露时间的延长,雄虾肌肉LDH活力整体呈现先升高后下降的趋势。干露期间雌虾肌肉LDH活力先升高后下降 (图4-b),在第 132小时达到最低 (40.88 U·g−1)。雌虾肌肉LDH活力在第6、第12、第24和第36小时显著高于0 h组 (P<0.05),在第36小时达到最大活力值 (104.63 U·g−1),干露 48~96 h 阶段 LDH 活力与干露 0 h 组无显著差异 (P>0.05)。
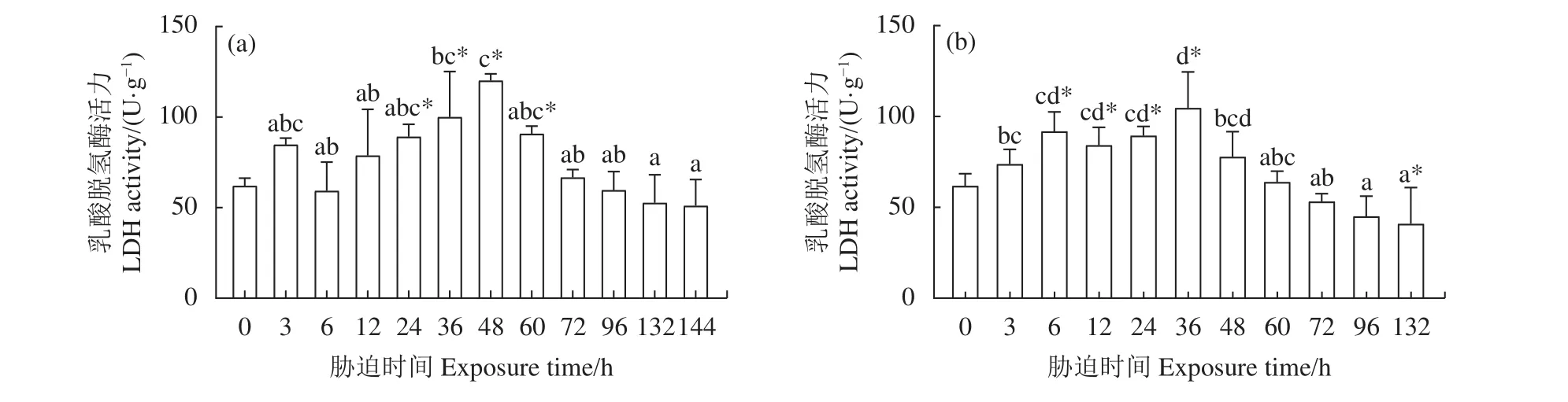
图4 干露胁迫对克氏原螯虾雄虾 (a) 和雌虾 (b) 肌肉乳酸脱氢酶活力的影响Figure 4 Effect of dry exposure on muscle LDH activity of male (a) and female (b) P. clarkii
2.4 克氏原螯虾SDH活力变化
2.4.1 干露胁迫对肝胰腺 SDH 活力的影响 雄虾肝胰腺SDH活力在干露期间呈现先下降后升高趋势 (图5-a),在干露第48小时达到最低 (4.36 U·mg−1),第 60小时达到峰值 (11.65 U·mg−1)。而雌虾肝胰腺SDH活力在干露前期梯度递减 (图5-b),第 36小时达到最低 (1.97 U·mg−1),在第 48和第60小时明显激增,但与0 h组无显著差异 (P>0.05),在干露 60 h 后活力显著降低 (P<0.05)。

图5 干露胁迫对克氏原螯虾雄虾 (a) 和雌虾 (b) 肝胰腺琥珀酸脱氢酶活力的影响Figure 5 Effect of dry exposure on hepatopancreas SDH activity of male (a) and female (b) P. clarkii
2.4.2 干露胁迫对肌肉 SDH 活力的影响 雄虾肌肉SDH活力见图6-a,在干露第24和第60小时明显降低 (P<0.05),在第36小时达到最大 (9.76 U·mg−1)。雌虾肌肉SDH活力在第12小时达到最低 (7.18 U·mg−1),第 36小时后随干露时间的延长显著降低 (P<0.05,图 6-b)。

图6 干露胁迫对克氏原螯虾雄虾 (a) 和雌虾 (b) 肌肉琥珀酸脱氢酶活力的影响Figure 6 Effect of dry exposure on muscle SDH activity of male (a) and female (b) P. clarkii
2.5 克氏原螯虾肌肉LA浓度变化
雌、雄虾肌肉LA水平随干露时间的延长呈现先升高后下降的变化 (图7),其中雄虾LA水平在第 48小时达到最大值 (732.33 μmol·g−1),雌虾在第 60小时达到峰值 (706.01 μmol·g−1)。

图7 干露胁迫对克氏原螯虾雄虾 (a) 和雌虾 (b) 肌肉乳酸质量摩尔浓度的影响Figure 7 Effect of dry exposure on muscle LA molar concentrations of male (a) and female (b) P. clarkii
2.6 干露胁迫对克氏原螯虾组织结构的影响
2.6.1 干露胁迫对肝胰腺的影响 干露 0 h 组雌、雄虾肝胰腺肝小管排列紧密,细胞结构正常,细胞界限清晰 (图8和图9)。随着干露时间的延长,雄虾肝小管形态有明显膨胀,管壁外侧基膜在第72小时开始有离散现象,在第96小时更为明显;管腔内壁基膜逐渐扩张,形状呈不规则多边形,尤其在第36小时之后明显变大;肝小管内部细胞收缩,B细胞以及内部运转泡体积增大,数量增多,雌虾此现象较雄虾明显。雌虾肝小管在持续干露时间段内除第132小时外始终紧密排列,内部基膜扩张明显,管腔随干露时间逐渐变大,在第132小时达到最大;内部细胞在第48、第96和第132小时结构模糊,细胞界限不清晰。随着干露时间的增加,雌、雄虾柱状上皮细胞的细胞质内均出现许多空泡,空泡随干露时间数量增多、体积增大,干露终期细胞空泡化严重。雌、雄虾干露期间肝胰腺R细胞数量无明显变化。
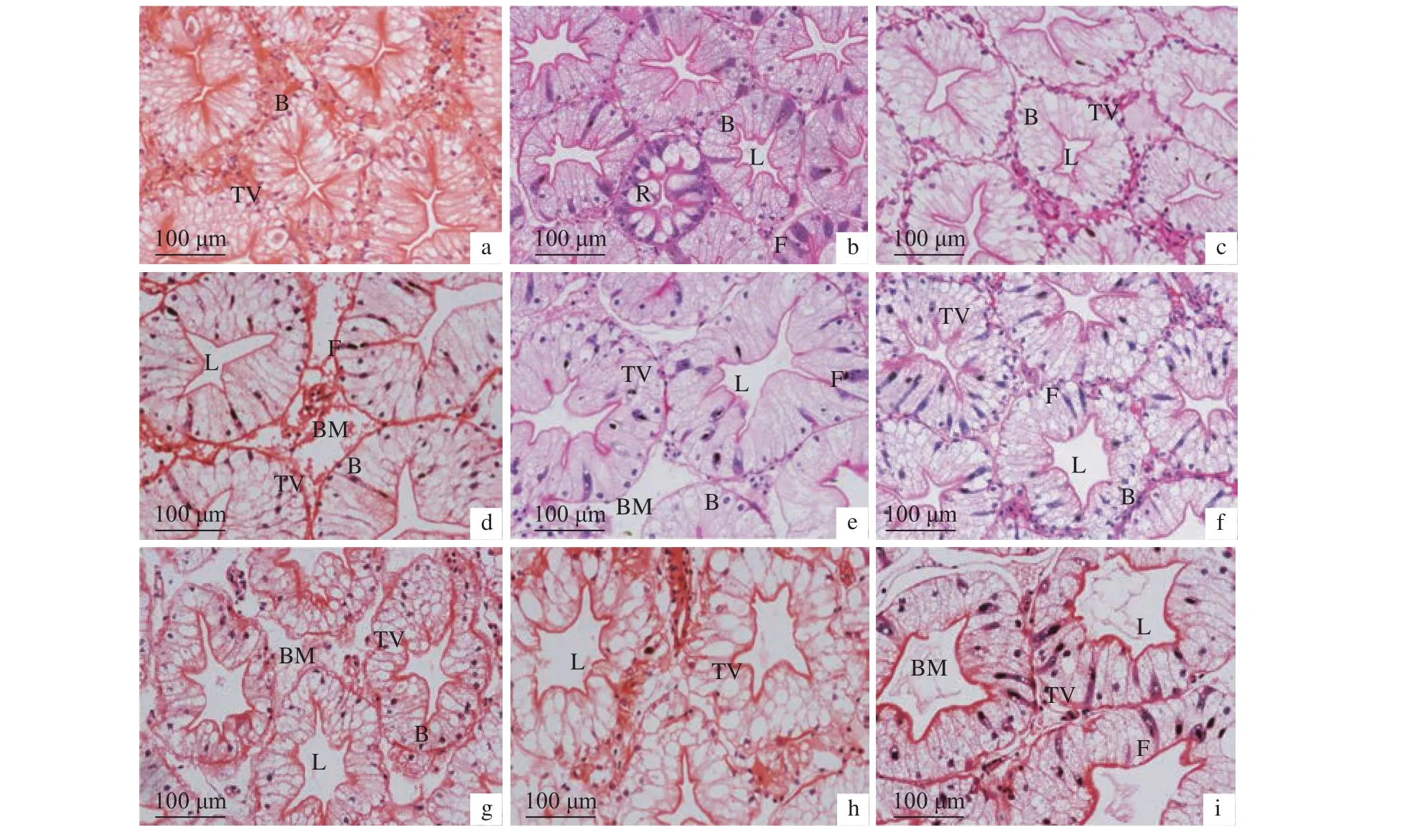
图8 干露胁迫对雄性克氏原螯虾肝胰腺显微结构的影响a—i分别代表干露胁迫 0、12、24、36、48、60、72、96 和 132 h;B. B 细胞;R. R 细胞;F. F 细胞;L. 管腔;BM. 基膜;TV. 转运泡;图 9同此。Figure 8 Effect of dry exposure on hepatopancreas microstructure of male P. clarkiia–i represent dry exposure of 0, 12, 24, 36, 48, 60, 72, 96 and 132 h, respectively; B. B cell; R. R cell; F. F cell; L. Lumen;BM. Basement membrane; TV. Transferred vacuoles; the same case in Figure 9.

图9 干露胁迫对雌性克氏原螯虾肝胰腺显微结构的影响Figure 9 Effect of dry exposure on hepatopancreas microstructure of female P. clarkii
2.6.2 干露胁迫对鳃的影响 干露 0 h 组雌、雄虾鳃叶结构完整,鳃膜薄且平整光滑、形状规则整齐(图10和图11),正常内部呼吸上皮细胞单层逐个相连围成微血管腔,微血管腔内有血细胞和血淋巴液。在干露第12小时出现雄虾鳃膜边缘结构模糊,雌虾鳃丝轻微肿大现象。在随后的干露时间,鳃膜皆出现褶皱弯曲,表面有严重粗糙感,尤其在干露第24和第36小时上皮细胞有部分脱落现象,随着干露时间延长,雌、雄虾鳃组织上皮细胞脱落、坏死愈发严重。干露后期的第96和第132小时鳃细胞数量减少,鳃膜受损严重,微血腔中的血淋巴液弥散严重,基本失去正常鳃细胞结构。

图10 干露胁迫对雄性克氏原螯虾鳃显微结构的影响GM. 鳃膜;H. 血细胞;CL. 微血管腔;REC. 呼吸上皮细胞;图 11同此。Figure 10 Effect of dry exposure on gill microstructure of male P. clarkiiGM. Gill membranes; H. Hemocytes; CL. Capillary lumen; REC. Respiratory epithelium cells; the same case in Figure 11.

图11 干露胁迫对雌性克氏原螯虾鳃显微结构的影响Figure 11 Effect of dry exposure on gill microstructure of female P. clarkii
2.6.3 干露胁迫对肌肉的影响 肌肉组织变化见图12和图13,干露0 h组肌肉组织结构排列较为整齐,肌纤维间隙紧致、平整,雄虾在干露第12、第36、第60、第72和第96小时,雌虾在干露第24、第36、第48、第60、第96和第132小时组织肌纤维弯曲呈波浪状,间隙褶皱疏松。
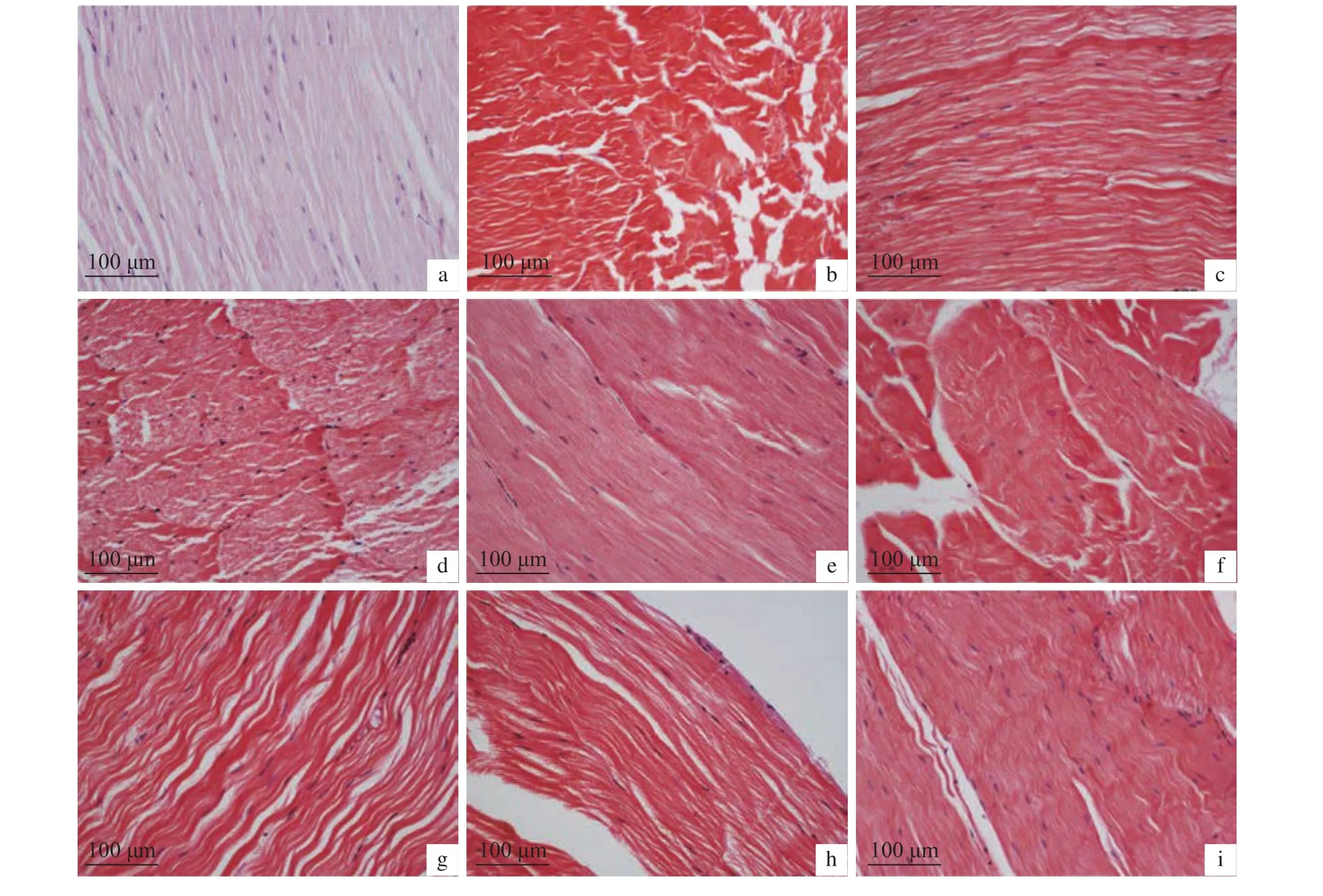
图12 干露胁迫对雄性克氏原螯虾肌肉显微结构的影响Figure 12 Effect of dry exposure on muscle microstructure of male P. clarkii
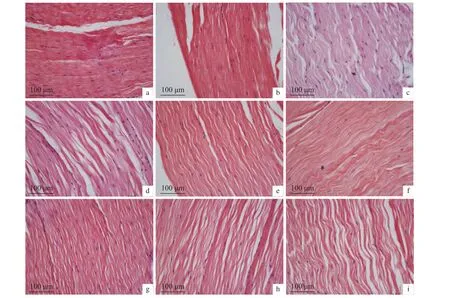
图13 干露胁迫对雌性克氏原螯虾肌肉显微结构的影响Figure 13 Effect of dry exposure on muscle microstructure of female P. clarkii
3 讨论
3.1 克氏原螯虾成虾的耐干露能力
半致死时间能反映生物对胁迫因子的耐受能力[11]。克氏原螯虾成体在水中的窒息点低至0.061 mg·L−1[12],在本研究 (16±1) ℃、RH (55±5)% 干露胁迫条件下,雄虾LT50为148 h,雌虾为144 h。三疣梭子蟹[9]幼蟹在15 ℃干露4 h后全部死亡;未抱卵天津厚蟹[13](Helice tientsinensis) 在 RH 50%~60% 下5 d后全部死亡;克氏原螯虾[14]幼虾在20 ℃、RH 50% 干露 24 h 后成活率为 53.3%。相比来说,克氏原螯虾成虾对干露环境的耐受能力较好。机体的耐干露时间与自身的保水能力有关[15-16],克氏原螯虾具有独特的羽毛状鳃丝,在扩大与水体接触面积的同时也能保留大部分水分[17],从而能够在失水环境中存活一段时间。另外,干露耐受时间与自身水分丧失速度有关[15-16],体质量消耗率可反映机体的水分丧失,雄、雌虾体质量消耗率分别在第60和第48小时后急剧增加,第48小时后雌虾体质量消耗率皆高于雄虾,因而其干露耐受时间小于雄虾。雌虾体质量消耗率急剧升高的时间早于雄虾的原因还有待进一步研究。
3.2 干露胁迫对克氏原螯虾呼吸代谢酶的影响
本研究干露初期第3和第6小时,雌、雄虾肝胰腺、肌肉的LDH活力及LA浓度与0 h组相比变化不显著,机体脱离水体刚进入干露环境,鳃部仍留有一定水分,以维持正常的呼吸代谢[18]。随着干露时间的延长,在干露12~48 h 阶段,雌、雄虾的肝胰腺和肌肉LDH活力呈上升趋势,LA浓度变化趋势与LDH相同。LDH作为机体无氧代谢的标志酶[19],陶易凡等[20]在研究低pH对克氏原螯虾鳃的呼吸代谢酶的影响时指出,LDH活力上升,表明此时机体有氧代谢受阻,会迅速提高无氧代谢强度来满足自身缺氧条件下的能量需求。类似的呼吸代谢变化在日本囊对虾[21]干露胁迫第1和第3小时也有发生。本研究在12~48 h干露时间内LDH活力升高,表明机体无氧呼吸代谢强度增加,LDH催化还原丙酮酸致使LA逐渐积累[22],同时SDH作为有氧呼吸中琥珀酸转变为延胡索酸的关键脱氢酶,其在干露期间活力降低也同样反映了机体有氧代谢水平的下降[23-24],克氏原螯虾的呼吸方式逐渐从有氧代谢向无氧代谢转变。在干露48~132 h阶段,LDH活力和LA浓度逐渐降低,脊尾白虾[7]在常温干露胁迫末期也出现类似的酶活力下降变化,推测过长的胁迫时间导致机体的代谢系统受到影响,LA浓度的下降是机体应对严重的低氧胁迫将LA转化为葡萄糖来维持内环境稳态所做的调整[25],这种调整是机体短时间内为消耗过量LA而采取的糖异生作用[25],但长时间的干露胁迫,使机体耐受能力到达极限,致使酶的调节功能丧失,内稳态失衡,造成不可逆损伤[5]。
3.3 干露胁迫对肝胰腺、鳃和肌肉组织结构的影响
组织结构变化反映出机体生理状态的改变[26]。肌肉组织拥有致密的结缔组织,蛋白质是肌肉组织的主要组成成分。有研究指出,肌肉蛋白溶解性与蛋白持水性息息相关[27],尼罗罗非鱼 (Oreochromis niloticus) 在冷藏期间肌肉肌原纤维蛋白含量下降,肌肉蛋白溶解性降低[28]。本研究中雄、雌虾在干露第24小时后肌肉纤维出现有规律的疏松、褶皱、弯曲现象,推测可能是在干露条件下肌肉肌原纤维蛋白含量和持水量下降,导致肌肉收缩,从而产生组织损伤。
鳃作为参与气体交换和离子调节的重要器官,通常最先受到环境胁迫影响并造成损伤[29]。本研究中克氏原螯虾的鳃组织在干露第12小时出现轻微损伤,第24和第36小时大部分呼吸上皮细胞脱落。有研究表明呼吸上皮细胞的脱落使机体气体交换的能力减弱,造成组织缺氧[20],而本研究中干露第24和第36小时无氧代谢酶LDH处于活力最大值,LA浓度增大,无氧代谢水平增强,结合组织结构变化可知,干露胁迫导致机体鳃组织损伤,损伤的鳃组织使机体获氧能力下降,缺氧条件下机体通过提高无氧代谢水平满足自身能量需求[20,30]。克氏原螯虾鳃组织随着干露时间的延长损伤加剧,本研究干露第96和第132小时的损伤与过量的硫酸锌 (ZnSO4) 胁迫[30]条件下克氏原螯虾鳃组织出现情况类似,包括鳃膜和呼吸上皮细胞分离,许多呼吸上皮细胞坏死、脱落,失去正常鳃细胞结构。干露条件下鳃缺少用于有氧呼吸的溶解氧,同时鳃组织的严重损伤进一步降低了自身氧气的利用,严重影响了机体的离子代谢和渗透调节功能[31],制约了呼吸代谢的进行,造成克氏原螯虾死亡。
肝胰腺是克氏原螯虾重要的代谢器官,具有消化、吸收、储存和排泄的功能[32]。对于不同胁迫,甲壳动物的肝胰腺细胞会出现一些相似的变化,盐度9.0暴露下的三疣梭子蟹[33]、氨氮 (NH4-N) 胁迫 15 d 后的中华绒螯蟹[34](Eriocheir sinensis) 以及在低pH胁迫下的克氏原螯虾[20]皆出现了B细胞内部空泡增多、体积增大的现象。B细胞具有消化、吸收营养物质的功能,其数量多少反映机体消化能力的强弱[35]。本研究中B细胞及内部转运泡增多、体积增大,可能有助于加快营养物质的运输[33],进而有助于克氏原螯虾消耗营养物质来提供能量[26]。R细胞除具有吞噬作用外,还可以储存脂肪和糖原。本研究中R细胞空泡化可能是细胞中营养物质的消耗造成的[33,36],尤其在干露48 h后空泡化的细胞数量增多,约占据整个细胞的80%,甚至出现肝细胞溶解的现象。此外,随着干露胁迫时间的延长,肝胰腺细胞管腔逐渐变大,在干露第132小时约占细胞体积的50%。干露胁迫下伴随失水胁迫,肝小管收缩变形,进一步表明机体细胞严重失水,过长时间的胁迫已严重破坏肝胰腺的正常组织结构,可能影响机体的正常生理功能。
综上,鳃组织在干露第12小时即出现损伤,随着干露时间的延长肝胰腺组织损伤愈严重,两者在干露第36小时均受到严重损伤,影响了基本结构功能。雌虾体质量在干露第48小时后下降显著,而雄虾在第60小时后下降明显,同时以无氧呼吸代谢为主的呼吸强度减弱,机体面临耐受极限。因此,克氏原螯虾雌、雄成虾抗干露胁迫能力存在差异,在进行成体运输时干露时间不宜超过36 h。
