STS联合吉非替尼对NSCLC患者血小板活化功能及炎症因子的影响
2021-10-22瞿小应
瞿小应, 杜 旋
(1.应城市人民医院肿瘤血液内科,湖北省应城市432400;2.孝感市中心医院肿瘤科,湖北省孝感市432000)
非小细胞肺癌(non-small cell lung cancer,NSCLC)临床上较为多见,占肺癌三分之二以上,其发病具有隐匿性,大多数患者在确诊时已经发展到晚期,70%晚期患者确诊时已有转移病灶,不宜进行手术治疗,临床上药物治疗为其主要治疗方式[1]。吉非替尼是一种选择性表皮生长因子受体酪氨酸激酶抑制剂的靶向治疗药物,广泛应用于晚期NSCLC的靶向治疗[2],但晚期NSCLC患者大部分存在凝血功能异常,经吉非替尼治疗后其凝血功能异常程度显著增加,炎症因子过度表达,对患者生存质量造成极大影响[3-4]。研究表明,丹参酮ⅡA磺酸钠(sodium tanshinone ⅡA sulfonate,STS)不仅能够抑制肿瘤生长,而且能够改善患者微炎症反应及血液黏度[5]。目前,尚无将该药用于治疗晚期NSCLC的报道,因此,本研究探讨STS联合吉非替尼对NSCLC患者血小板活化功能及炎症因子的影响,现报道如下。
1 资料和方法
1.1 研究对象
选择本院2017年3月—2019年10月住院的晚期NSCLC患者110例,随机分为两组。联合STS组55例,其中男26例,女29例,年龄27~82岁,平均(62.35±4.18)岁;鳞癌21例,腺癌34例;TNM分期Ⅲb期22例,Ⅳ期33例。吉非替尼组55例,其中男28例,女27例,年龄26~84岁,平均(63.45±5.16)岁;鳞癌19例,腺癌36例;TNM分期Ⅲb期21例,Ⅳ期34例。两组基本资料比较差异无显著性(P>0.05),具有可比性。本研究经本院伦理委员会批准,患者及家属均知情同意。
纳入标准:①参照《新编常见恶性肿瘤诊治规范》[6]中NSCLC诊断标准;②经细胞学及组织学检查确诊为TNM分期Ⅲb及Ⅳ期;③1月前未接受其他抗肿瘤治疗;④未合并其他组织及器官恶性肿瘤;⑤卡氏评分≥70分;⑥同意随访。排除标准:①出现严重意识障碍、生命体征不稳;②合并精神或神经系统疾病;③既往进行过放化疗治疗;④并发自身免疫性疾病;⑤并发慢性感染及全身炎症性疾病;⑥合并心、肝、肾等全身重要器官疾病。
1.2 治疗方法
吉非替尼组给予常规维持电解质平衡、吸氧等治疗,并给予吉非替尼[齐鲁制药(海南)有限公司,批号DC1B7016、DC1B8022、DC1B9017],每次250 mg口服,每日1次。联合STS组在吉非替尼组治疗基础上,给予STS注射液[阿尔贝拉医药控股(通化)有限公司,批号1703309、1811308、1906301],每次40 mg加入250 mL 5%葡萄糖注射液,每天1次,静脉滴注。两组均10天为1个疗程,连续治疗2个疗程。
1.3 客观疗效观察及评价标准
根据WHO实体瘤疗效评价标准[7]观察两组治疗后疗效。①进展(PD):有新病灶出现,或肿瘤体积变大超过25%;②稳定(SD):肿瘤体积变大低于25%,或变小不超过50%;③部分缓解(PR):肿瘤体积变小至少50%;④完全缓解(CR):肿瘤完全消除,无新病灶出现。总有效率(%)=(CR+PR)/总例数×100%,疾病控制率(%)=(CR+PR+SD)/总例数×100%。
1.4 生存质量观察及评价标准
根据卡氏评分(KPS)标准[8]对生存质量进行评价。与治疗前比较,KPS评分治疗后减少10分及以上即为降低;增加10分及以上即为提高;其他情况为稳定。改善率(%)=(提高例数+稳定例数)/总例数×100%。
1.5 酶联免疫吸附法检测血清指标
治疗前及治疗2个疗程后,采集空腹晨起肘静脉血10 mL,将标本置于离心机上3 000 r/min离心5 min后分离血清,-80 ℃保存待检测。采用酶联免疫吸附法(ELISA)检测白细胞介素-6(interleukin-6,IL-6)、超敏C反应蛋白(high-sensitive C-reactive protein,hs-CRP)炎症因子水平变化。采用双抗夹心ELISA法检测肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平。
1.6 速率散射比浊法检测免疫球蛋白水平
治疗前及治疗2个疗程后,采用速率散射比浊法检测免疫球蛋白水平(IgA、IgG、IgM),检测仪器为迈瑞医疗BS-380全自动生物化学分析仪,试剂盒购于上海劲马生物科技有限公司,按照试剂盒说明操作。
1.7 流式细胞仪检测血小板活化功能指标
治疗前及治疗2个疗程后,采用FACSCalibur流式细胞仪(美国Becton Dickion公司)检测血小板活化功能指标P-选择素(P-selectin,CD62P)、溶酶体颗粒糖蛋白(lysosome intact membrane protein,CD63)、血小板激活复合物-1(platelet activated complex-1,PAC-1)。试剂为单抗CD62p-PE、CD63-PE及PAC-1-FITC,试剂盒购于美国Becton Dickion公司,严格按照试剂盒说明书进行操作。
1.8 不良反应观察及随访
治疗过程中观察比较两组患者不良反应发生情况(皮疹、腹泻、恶心呕吐、肝功能异常、血小板减少)。对所有患者进行随访,随访截至2020年8月,观察比较两组患者客观生存率和生存时间。
1.9 统计学方法

2 结 果
2.1 两组客观疗效和生存质量的比较
治疗后,联合STS组治疗总有效率和疾病控制率明显高于吉非替尼组(P<0.05;表1)。治疗后,联合STS组生存质量改善率明显高于吉非替尼组(P<0.05;表1)。
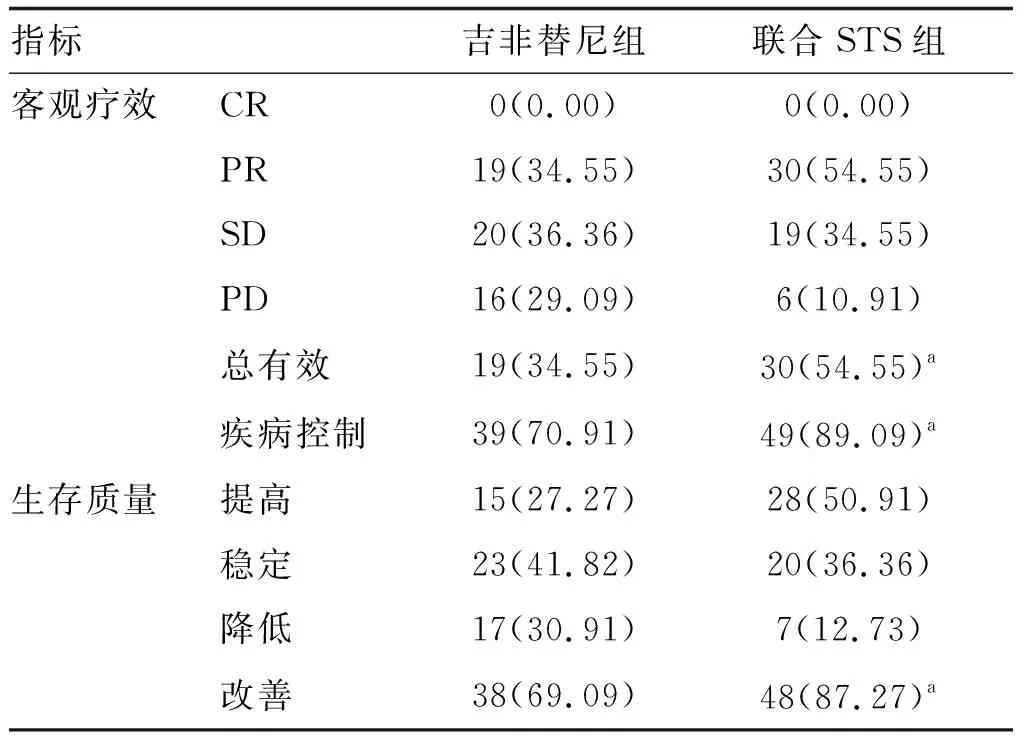
表1 两组NSCLC患者客观疗效和生存质量的比较(n=55) 单位:例(%)
2.2 两组治疗前后炎症因子水平的比较
治疗前,两组IL-6、TNF-α、hs-CRP水平差异均无显著性(P>0.05)。治疗后,两组IL-6、TNF-α、hs-CRP水平均较治疗前降低(P<0.05),且联合STS组低于吉非替尼组(P<0.05;图1)。
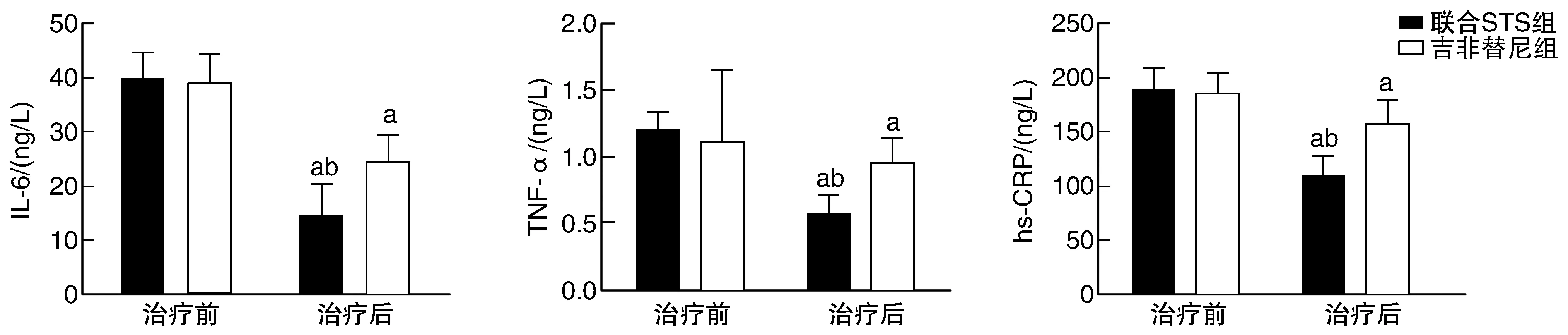
图1 两组NSCLC患者治疗前后IL-6、TNF-α和hs-CRP水平的比较a为P<0.05,与治疗前比较;b为P<0.05,与吉非替尼组比较。
2.3 两组治疗前后免疫球蛋白水平的比较
治疗前,两组IgA、IgG、IgM水平比较,差异均无显著性(P>0.05)。治疗后两组IgA、IgG、IgM水平较治疗前显著降低(P<0.05),联合STS组IgA、IgG、IgM水平明显高于吉非替尼组(P<0.05;图2)。

图2 两组NSCLC患者治疗前后IgA、IgG、IgM水平的比较a为P<0.05,与治疗前比较;b为P<0.05,与吉非替尼组比较。
2.4 两组治疗前后血小板活化功能指标的比较
治疗前,两组CD62p、CD63、PAC-1水平比较,差异均无显著性(P>0.05)。治疗后两组CD62p、CD63、PAC-1水平均较治疗前显著降低(P<0.05),且联合STS组CD62p、CD63、PAC-1水平显著低于吉非替尼组(P<0.05;图3)。
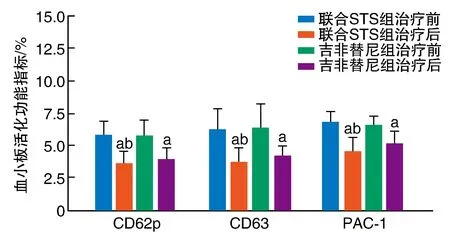
图3 两组NSCLC患者治疗前后CD62p、CD63和PAC-1水平的比较a为P<0.05,与治疗前比较;b为P<0.05,与吉非替尼组比较。
2.5 两组不良反应情况的比较
治疗期间两组患者均出现不良反应,其中皮疹、腹泻、恶心、呕吐两组间比较差异无显著性(P>0.05);联合STS组肝功能异常和血小板减少发生率明显低于吉非替尼组(P<0.05;表2)。

表2 两组NSCLC患者不良反应情况的比较(n=55) 单位:例(%)
2.6 两组客观生存率和生存时间的比较
随访截至2020年8月,联合STS组失访2例,吉非替尼组失访1例,联合STS组死亡18例,吉非替尼组死亡28例。两组客观生存率比较差异无显著性(P>0.05)。联合STS组生存时间明显长于吉非替尼组(P<0.05;表3)。

表3 两组NSCLC患者客观生存率和生存时间的比较
3 讨 论
以铂类药物为基础治疗晚期NSCLC的临床疗效已进入平台期,因此,靶向治疗成为治疗晚期NSCLC的研究热点。大部分局部晚期NSCLC患者化疗之后会采用吉非替尼来控制性治疗,已经取得确切疗效。马云飞等[9]对关于吉非替尼治疗NSCLC毒副作用的研究进行归纳和总结,认为吉非替尼治疗后大多数患者会出现肝肾功能异常、骨髓抑制、凝血功能异常、消化系统反应、皮疹等毒副反应;并提倡在常规西医治疗的基础上联合软坚散结、活血化瘀的中药治疗,以此增加西医治疗的疗效,并且改善患者的生存质量,减轻西医治疗过程中的不良反应。
丹参具有活血祛瘀止痛、凉血消痈功效。张良明等[10]采用丹参注射液联合顺铂治疗后发现,丹参注射液不仅可提高顺铂的治疗效果,而且还能改善患者的免疫功能及生存质量。STS是丹参酮ⅡA的衍生物,丹参的水溶性成分。王琳等[11]研究认为STS联合顺铂能调节小鼠lewis肺癌细胞E-cadherin表达并抑制其生长及侵袭转移。本研究中联合STS组临床总有效率和疾病控制率均高于吉非替尼组,提示STS可有效提高晚期NSCLC患者的治疗有效性,遏制肿瘤组织继续生长,其抗肿瘤的机制可能与抑制DNA合成、抑制端粒酶活性、影响凋亡相关基因、改变肿瘤细胞表面蛋白、干扰有丝分裂相关蛋白的表达等因素有关,但其具体机制仍需进一步研究。
IL-6可诱导急性炎症因子CRP产生,TNF-α可通过分子间协同作用和细胞间传导激活T细胞,引起机体特异性免疫应答,从而对机体的免疫功能进行调节。研究认为,炎症因子表达水平与与肿瘤细胞活性存在相关性[12]。受肿瘤细胞的影响,肺癌患者其机体应激反应较强,炎症因子水平较高,如果不能得到有效控制会逐渐形成慢性炎症的机体微环境。这样的机体微环境非常适合肿瘤生长,释放的活性氧簇等中间体极容易造成机体正常组织细胞基因突变,使抑癌基因低表达,癌基因高表达,促使肿瘤细胞快速生长[13]。本研究中联合STS组血清炎症因子IL-6、TNF-α、hs-CRP表达水平均显著低于吉非替尼组,表明在化疗基础上使用STS可改善患者体内肿瘤生长微环境,降低炎症因子水平。两组采用吉非替尼治疗后,吉非替尼组IgA、IgG、IgM水平显著下降,差异有显著性;联合STS组IgA、IgG、IgM水平有所下降,但差异无显著性;并且治疗后联合STS组IgA、IgG及IgM三项免疫指标水平高于吉非替尼组(P<0.05),表明吉非替尼治疗会损害NSCLC患者的免疫功能,而STS能调节NSCLC患者免疫功能,有利于患者康复,这可能与丹参酮成分有助于提高吞噬细胞的数目有关。
研究发现,肺癌的发生发展和治疗效果与血小板活化的生物过程密切相关[14]。NSCLC患者中血小板增多的发生率为5%~15%,且血小板功能异常的NSCLC患者的治疗效果及预后较差[15]。沈凯凯等[16]收集初治NSCLC患者探讨NSCLC患者的血小板水平与临床病理特征的关系,发现肺癌的发生发展与血小板增多有关,血小板增多往往伴有血小板形态、功能以及凝血等方面的异常并提示着预后差及病情进展,研究认为临床上可对这部分凝血功能异常的患者适当行抗血小板治疗。本研究中联合STS组CD62p、PAC-1、CD63水平均较吉非替尼组低,提示STS改善血液流变学及抑制血小板聚集和活化,这与张文婧等[17]研究结果相符。
本研究中联合STS组治疗后生存质量改善率明显高于吉非替尼组,表明STS能够增强患者体质,有效减少吉非替尼治疗带来对身体的伤害。研究进一步观察了患者不良反应发生情况,联合STS组治疗后肝功能异常、血小板减少等不良反应发生率显著低于吉非替尼组,这表明STS可缓解吉非替尼靶向治疗后的不良影响,具有明显减毒作用。两组客观生存率比较差异无显著性,联合STS组生存时间明显长于吉非替尼组,提示尽管STS联合方案能在一定程度上延长NSCLC患者的生存时间,但患者近期生存率仍不理想。
综上所述,STS能够提高吉非替尼治疗晚期NSCLC的临床疗效及生存质量,抑制血小板聚集和活化,降低炎症因子水平,改善免疫功能,降低不良反应发生率,值得临床推广使用。
