依达拉奉对烟雾吸入性损伤大鼠肺的保护作用
2021-10-22肖长栓刘娅平杨景哲
肖长栓,刘娅平,杨景哲
(承德医学院附属医院 1.烧伤整形科,2.妇二科,河北省承德市 067000)
吸入性损伤发病隐匿、症状多不典型,是一种呼吸道和肺实质共同损伤的烧伤危急重症。吸入性损伤后,肺部可发生严重失控性炎症反应,产生大量氧自由基,多表现为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)及多器官功能障碍综合征(multiple organ dysfunction syndrome,MODF)[1]。因此,为其寻找早期适当干预手段一直是国内外研究的热点问题。依达拉奉(edaravone,EDA)通过抑制脂质过氧化及抗氧化从而发挥神经系统保护作用、减轻多种原因所致的肺组织损伤[2-5]。EDA容易穿过细胞膜且雾化吸入可直接作用于靶器官[6]。本实验通过雾化吸入EDA干预烟雾吸入性肺损伤大鼠模型,研究其对该模型大鼠肺的保护作用。
1 材料和方法
1.1 试剂与仪器
依达拉奉(edaravone,EDA)购自双鹤药业有限责任公司(原料药,国药准字H20130053,纯度:99.7%)。大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-10(interleukin-10,IL-10)、半胱氨酸蛋白酶-3(cysteine protease 3,Caspase-3)酶联免疫吸附分析法(enzyme linked immunosorbent assay,ELISA)试剂盒购自美国R&D公司;大鼠肺髓过氧化物酶(myeloperoxidase,MPO)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、考马斯亮蓝蛋白检测试剂盒购自南京建成公司;原位末端标记(TdT-mediated dUTP nick end labeling,TUNEL)检测阳性对照制备试剂盒购自南京凯基生物科技发展有限公司;微量加样器购自德国Eppendorf公司;ELX800UV型酶标检测仪购自美国Bio Tek公司;CK40型光学显微镜购自日本Olympus公司;Centrifuge5702离心机购自德国Eppendorf公司;RM2235型石蜡切片机购自德国Leica公司;ABL-800型血气分析仪购自丹麦Radiometer公司;PARI Turbo BOY N系列雾化机购自德国PARI GmbH公司;KD-BM生物组织包埋机购自浙江科迪仪器设备公司。
1.2 实验动物及分组
清洁级雄性SD大鼠30只,60~70日龄,体质量约(200±20)g,由中国食品药品检定研究院提供,动物生产许可证号:SCXK(京)2017-0005。饲养温度22~25 ℃,自由饮食、饮水。并于实验前12 h禁食、自由饮水。将其随机分为对照组、模型组、EDA低剂量组、EDA高剂量组、EDA预防组,每组6只。本实验获承德医学院附属医院医学伦理委员会批准,动物处置方法符合动物伦理学标准。
1.3 动物造模及干预方法
参考文献[7],各组腹腔注射盐酸氯胺酮(0.1 mg/g)后行气管切开术:颈胸部剃毛消毒后铺无菌巾,行颈胸部正中切口,气管切开,置入气管导管。气管导管连接呼吸机螺纹管后以4601型小动物呼吸机行机械通气,呼吸频率为80次/min,潮气量为10 μL/g,吸呼比为1∶2,吸入30%的氧。螺纹管末端连接三通管后与压力转换接头相连,动态监测气道压(airway pressure,Paw)。Paw稳定20 min后,参照文献[5,8],除对照组外其他组大鼠制作烟雾吸入性损伤模型:烟雾发生器打开致伤室进气口阀门和风扇,内置入适量松木屑后发烟15 min,当烟雾报警器报警后打开排气口阀门、风扇,排气口用聚乙烯导管连接三通管一端,使各组大鼠均匀吸入烟雾5 min后关闭排气口阀门5 min,按上述步骤操作3次。
参照文献[9]设定各组大鼠药物干预时间和剂量:对照组不吸入任何药物;模型组、EDA低剂量及高剂量组分别在致伤后30 min雾化吸入生理盐水、1.8 g/L、3.6 g/L EDA,0.1 mL/min,10 min,间隔1 h重复1次,共4次;EDA预防组致伤前10 min(预处理)雾化吸入1.8 g/L EDA 0.1 mL/min,10 min,致伤后30 min雾化吸入1.8 mg/mL EDA 10 min,间隔1 h重复1次,共3次。
1.4 氧合指数、肺组织含水率及湿干比测定
致伤后6 h,留取各组大鼠颈动脉血1 mL 30 min内行血气分析,计算氧合指数(oxygenation index,OI);剖腹留取腹主动脉血5 mL后处死动物,迅速取出肺组织,选择右肺组织前叶及中叶标本,称湿重并记录,随后放入恒温电烤箱中80 ℃烘烤48 h,称干重并记录。含水率(%)=(湿重-干重)/湿重×100%,湿重与干重之间比值为湿干比(wet to dry ratio,W/D)。
1.5 血清TNF-α、IL-6、IL-10测定
采用双抗体夹心ELISA法。将腹主动脉血标本离心15 min后取上清液,-20 ℃冷冻保存。解冻血清标本,严格按照试剂盒说明书操作,酶标仪450 nm波长处读取光密度(optical density,OD)值,计算样品中TNF-α、IL-6、IL-10含量。
1.6 肺组织MDA、MPO、SOD测定
将取出的左肺组织保存于-70 ℃冰箱中。解冻左肺组织标本,滤纸吸干,电动研磨器充分研磨,制备组织匀浆。考马斯亮蓝蛋白测定法测定匀浆液中蛋白水平后严格按照试剂盒说明书,分别在460、532、550 nm波长处测定各管MDA、MPO、SOD的OD值,计算组织中MDA、MPO、SOD含量。
1.7 肺组织Caspase-3、细胞凋亡率测定
取肺组织匀浆液适量,按照试剂盒说明书操作,酶标仪在450 nm波长处读取各管OD值,计算组织中Caspase-3含量。采用TUNEL方法分析肺组织细胞凋亡情况。将取出的右肺后叶经4%的甲醛固定24 h,取适量固定好的右肺后叶组织脱水、包埋、切片、TUNEL染色。每只大鼠随机选取5个非重叠高倍镜视野(400×),计数凋亡细胞数和细胞总数,细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。
1.8 肺组织苏木精-伊红染色切片
取适量4%甲醛固定好的右肺后叶,依次进行脱水、包埋、切片、苏木精-伊红(hematoxylin eosin,HE)染色后光镜下观察。
1.9 统计学处理
2 结 果
2.1 各组OI、肺组织含水率及W/D的比较
与对照组比较,其余各组OI均明显降低,肺组织含水率、W/D均显著升高(P<0.05)。与模型组比较,EDA低剂量、高剂量及预防组OI明显升高(P<0.05),呈递增趋势;肺含水率、W/D显著降低,呈递减趋势(P<0.05;表1)。
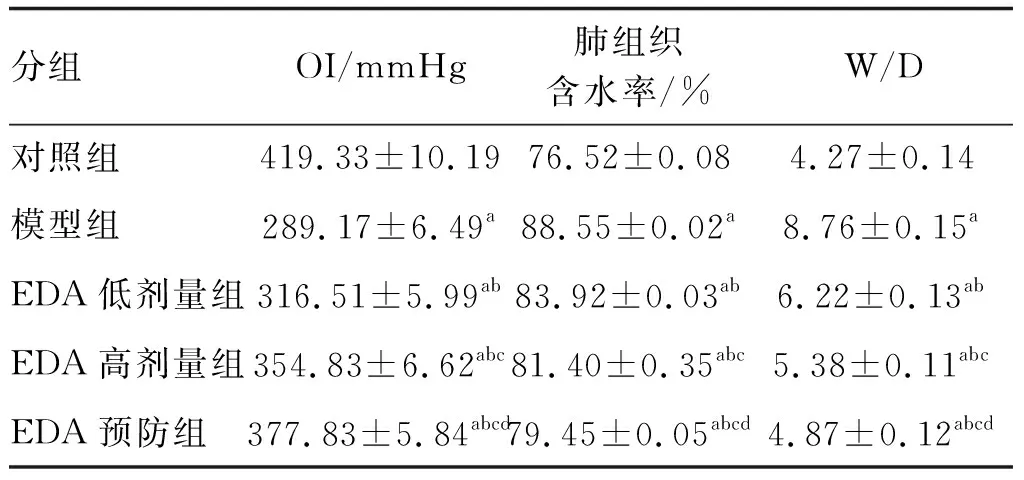
表1 各组OI、肺组织含水率及W/D的比较(n=6)
2.2 各组血清TNF-α、IL-6及IL-10水平的比较
与对照组比较,其余各组TNF-α、IL-6及IL-10水平均明显升高(P<0.05)。与模型组比较,EDA低剂量、高剂量及预防组TNF-α、IL-6水平均显著降低,呈递减趋势;IL-10水平均明显升高,呈递增趋势(P<0.05;表2)。

表2 各组血清TNF-α、IL-6、IL-10水平的比较(n=6) 单位:ng/L
2.3 各组肺组织MDA、MPO及SOD水平的比较
与对照组比较,其余各组MDA、MPO水平均明显升高,SOD水平均显著降低(P<0.05)。与模型组比较,EDA低剂量、高剂量及预防组MDA、MPO水平显著降低,呈递减趋势;SOD水平明显升高,呈递增趋势(P<0.05;表3)。
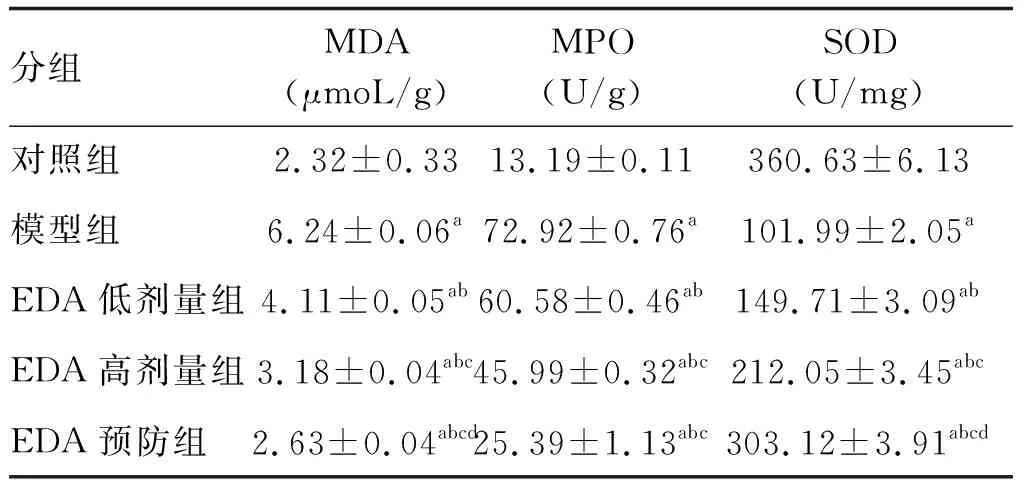
表3 各组肺组织MDA、MPO、SOD水平的比较(n=6)
2.4 各组肺组织Caspase-3含量及细胞凋亡率比较
与对照组比较,其余各组Caspase-3含量及细胞凋亡率均明显升高(P<0.05)。与模型组比较,EDA低剂量、高剂量及预防组Caspase-3含量及细胞凋亡率均显著降低,呈递减趋势(P<0.05;表4)。
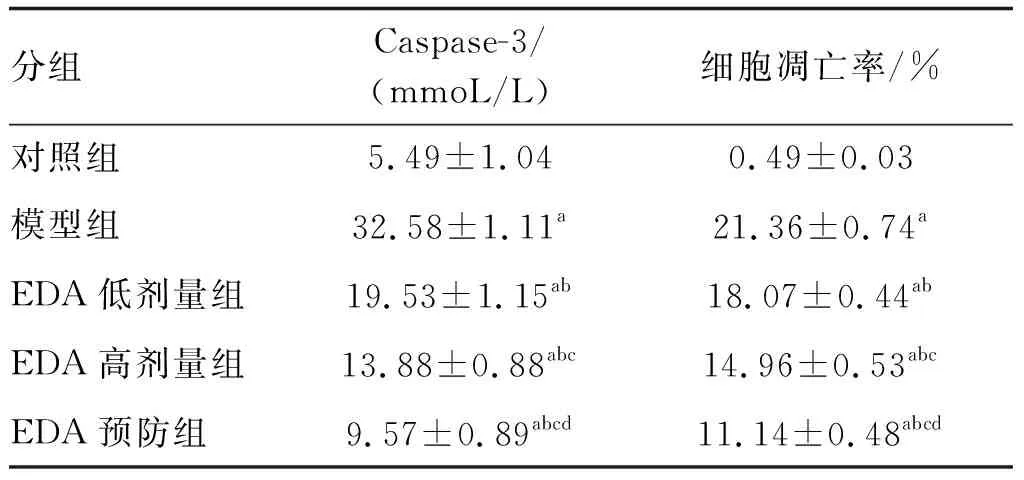
表4 各组肺组织Caspase-3含量及细胞凋亡率的比较(n=6)
2.5 肺组织病理切片检查
对照组肺泡腔内无炎性细胞浸润,且结构清晰、完整,壁光滑且均匀;模型组肺泡腔内有大量炎症细胞浸润及红细胞漏出,肺泡结构混乱,呈不同程度的扩张或萎缩,肺泡壁增厚明显且厚度不匀;EDA低剂量组肺泡腔内仍有一定数量的炎症细胞浸润及红细胞漏出,肺泡结构不清晰,仍有一定程度的扩张或萎缩;EDA高剂量组炎症细胞浸润及红细胞漏出程度较EDA低剂量组减轻,肺泡结构较清楚,大小及形态较一致;EDA预防组肺泡腔内炎症细胞浸润及红细胞漏出程度最轻,肺泡结构、大小及形态较EDA高剂量组进一步改善(图1)。
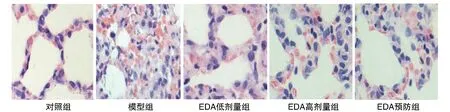
图1 各组大鼠肺组织病理切片(HE,400×)
3 讨 论
吸入性损伤后,机体释放大量炎症介质、细胞因子及氧自由基,启动凋亡信号通路,造成肺及其他多脏器的继发性损害[5,10]。肺损伤后形成肺水肿的原因可能是局部微循环障碍,微血管阻力升高,肺顺应性及氧合能力降低[11]。本实验通过检测氧合指数、肺组织含水率及W/D反映肺水肿及微血管损伤的程度。依达拉奉可通过降低炎症细胞因子水平及抑制细胞凋亡通路改善脑损伤所致的神经功能症状[12-13]。结果显示各组致伤大鼠肺泡腔内外可见炎症细胞浸润,提示烟雾吸入性肺损伤模型制作成功;模型组较对照组肺组织含水率及W/D显著升高、OI降低,EDA各组又较模型组肺含水率及W/D降低、OI升高,炎症细胞浸润减轻,且上述变化EDA预防组最明显,说明雾化吸入依达拉奉能减轻炎症细胞浸润及肺组织氧合情况,并具有剂量依赖性,且早期应用效果较好,但具体作用原理需深入研究。
近年来,对于合并吸入性损伤的患者仍缺乏有效的干预方法[11]。以往研究表明,对于肺损伤预防性应用依达拉奉,研究对象未出现任何药物不良反应,研究结论具有一定临床指导意义并得到普遍认可[14];吸入性损伤漏诊率较高,早期干预还可把握最佳的治疗时机,降低后期的治疗难度及死亡率。
吸入性损伤可促进多种炎症细胞产生及释放TNF-α,可增加骨髓白细胞释放、激活外周血管内皮细胞及促进血液中多形核白细胞趋化吞噬能力,提高IL-1、IL-6等细胞因子的水平[15]。高水平的IL-6可启动并延续局部及全身级联瀑布式炎症反应。TNF-α、IL-6是反映组织损伤程度的重要标志,可提示多脏器功能障碍,因此可作为观察肺损伤治疗效果的可靠指标[16]。IL-10可通过下调主要组织相容性复合物、抑制单核巨噬细胞合成分泌TNF-α、IL-6及IL-1β,对组织细胞起到显著的保护作用[17-18]。本实验通过测定IL-10的水平来间接反映机体抗炎能力。本文中EDA各组较模型组血清IL-6、TNF-α水平均降低,IL-10水平均升高,且此变化以EDA预防组最突出,说明对于烟雾吸入性损伤,雾化吸入依达拉奉具有良好的抗炎作用,并呈剂量依赖性,且预防用药效果更好。
SOD可通过抑制化学趋向性因子,切断炎症反应通路发挥抗氧化作用,是反映清除氧自由基能力的重要指标[12]。炎症细胞相互作用可使肺部MPO活性升高,反映了组织细胞中炎症细胞的浸润程度。MDA为脂质过氧化中产物,反映组织细胞受自由基的攻击程度[19]。模型组MDA及MPO水平较对照组升高,SOD降低,机体氧化/抗氧化平衡被破坏,EDA各组较模型组呈反向变化,且此变化EDA预防组最明显,表明高剂量雾化吸入依达拉奉对烟雾吸入性损伤具有更为显著的抗氧化作用,且预防性用药效果更好。
吸入性损伤发生后,细胞内线粒体膜通透性增加,细胞色素C等凋亡启动因子逸出,使凋亡执行因子Caspase-3活性增加,导致广泛的组织细胞凋亡,诱导并加重肺损伤[20]。Caspase-3的活化是细胞凋亡进入不可逆阶段的重要标志,本实验通过测定肺组织中Caspase-3含量及细胞凋亡率,来反映吸入性损伤过程中肺组织的凋亡情况。模型组肺组织Caspase-3及细胞凋亡率水平均较对照组升高,而EDA各组上述指标水平较模型组则明显降低,且EDA预防组降低程度最明显,说明雾化吸入依达拉奉可能通过Caspase-3信号通路使吸入性损伤后肺组织细胞凋亡程度减轻,并表现为剂量依赖性,预防用药的效果更好。
综上,雾化吸入依达拉奉可能通过减少炎症介质/细胞因子的产生及释放、降低过氧化损伤及抑制细胞凋亡对烟雾吸入性肺损伤起到保护作用,在一定范围内呈明显的剂量依赖性,且适当时机的预防性用药效果更佳。
