基于网络药理学和分子对接探讨葛根芩连汤治疗溃疡性结肠炎的作用机制*
2021-10-22贠张君王慧静孙梓宜刘鑫源姚树坤
贠张君,王慧静,孙梓宜,刘鑫源,姚树坤
(1.北京中医药大学,北京 100029;2.中日友好医院,北京 100029)
溃疡性结肠炎(ulcerative colitis,UC)是一种原因不明的弥漫性非特异性炎性疾病,持续影响直肠近端的结肠黏膜并经常形成糜烂和或溃疡[1],属炎症性肠病(IBD)的一种。据报道,在过去的20年中,由于生活方式及饮食结构的西方化,我国UC的发病率和患病率逐年攀升并呈现年轻化趋势[2]。UC的发病有显著的种族和地域差异,发病率和患病率最高区域主要集中于北欧,而在我国近20年来患病率有上升趋势[3]。有学者[4]通过统计1981—2000年国内报道的10 218例UC患者,发现近10年患病人数增加了3.08倍。因UC病程长、易复发、难治愈、大大降低患者生活质量等特点,世界卫生组织将其列为难治愈性疾病。虽然对其发病机理已有一定认识,但其病因尚不明确,目前大多认为与遗传、感染、环境因素和肠黏膜免疫有关[5]。常规治疗手段主要为水杨酸制剂、皮质类固醇和免疫抑制剂一类抑制促炎反应来缓解病情,但病情易反复,不良反应明显,如骨质疏松症、肥胖、胰岛素抵抗、癌症和结核病风险增加[6-7]。因此,寻找UC的替代性治疗药物已成为一种研究趋势。
以整体观念和辨证论治为特点的中医学在诊治慢性难治性疾病方面具有一定优势。根据其临床特点,中医学将 UC 归于“泄泻”“肠风”“脏毒”等范畴[8],病因主要为先天禀赋不足、素体脾虚、饮食不节、情志失调等。大肠湿热证、脾虚湿蕴证、寒热错杂证、肝郁脾虚证为主要证型[9]。近年来,随着国民生活水平的提高和饮食结构的西方化,进食过多的辛辣、油炸、烧烤等刺激性食物导致湿热体质盛行,现代疾病证候以实证、热证居多,虚证、寒证较少,病证常常虚实夹杂,寒热错杂。结合查找研究文献,发现大肠湿热证为UC的中医常见证候[10-11]。葛根芩连汤为治疗身热下利的经典名方,方中葛根既能解表退热,又可升脾胃清阳而止泻,辅以黄芩、黄连清热燥湿以厚肠止利。现多用于治疗以湿热蕴结大肠为基本病机的泄泻,而UC早期多表现为黏液性脓血便。此外,已有大量研究显示葛根芩连汤治疗UC效果显著,但对其作用机制研究较少或集中于单一通路,缺乏系统性分析。如秦凯健[12]等人通过系统性评价葛根芩连汤加减与柳氮磺吡啶治疗381例UC患者,显示联合葛根芩连汤加减可提高治疗总有效率;王浩、徐明[13]等人通过大鼠模型证明,葛根芩连汤可通过上调Bcl-2水平、下调Bax水平,保护结肠黏膜而治疗UC;还有学者[14]表明葛根芩连汤可降低NO、IL-18的水平,促进血浆SOD、IL-4的表达,从而发挥抗氧化损伤、抗炎等作用治疗UC。
网络药理学是对疾病、蛋白靶标、药物的相互作用网络系统分析,其系统生物学的理念与中医学的整体观念不谋而合[15-16]。其通过构建药物分子-靶点-疾病生物网络,分析三者在网络中的相互作用,探索作用机制[17]。本文将通过构建“药物-靶点-疾病”相互作用网络,并结合GO富集分析和KEGG通路分析探讨葛根芩连汤治疗UC的多成分-多靶点-多信号通路特点,分子对接验证其药物活性,为UC的新药研发及机制研究提供思路及方向。
1 材料与方法
1.1 葛根芩连汤有效成分及候选靶点筛选 葛根芩连汤组成中葛根、黄芩、黄连、甘草的有效化学成分通过中药系统药理学数据库与分析平台TCMSP(http://tcmspw.com/tcmsp.php)[18]检索。为了筛选出容易吸收、成药的化学成分,根据毒药物动力学ADME参数进行筛选,筛选条件为OB(口服生物利用度)≥30%和DL(类药性)≥0.18。其中OB是指药物吸收进入人体循环的速度和程度;DL指化合物与已知药物的相似性。将筛选出来的化学成分导入数据库PharmMapper sever(http://www.lilab-ecust.cn/pharmmapper/index.html)中,通过反向药效团匹配技术预测化合物的候选靶点,物种类限定为人类。最后将上述靶点在 UniProt数据库(https://www.uniprot.org/)中标准化为基因名。
1.2 UC疾病相关靶点的检索与筛选 通过药物靶标数据库 DrugBank[19](https://www.drugbank.ca/)、靶点数据库TTD[20](http://db.idrblab.net/ttd/)、基因疾病关联数据库 DisGeNET[21](https://www.disgenet.org/)检索UC相关靶点,删除重复基因后,获得UC疾病的相关靶点。
1.3 葛根芩连汤作用靶点的预测 应用R VeenDiagram程序包对上述疾病与药物靶标取交集,获得葛根芩连汤作用于UC的靶点蛋白。
1.4 蛋白互作(protein proteininteraction,PPI)网络的构建与拓扑分析 将药物-疾病交集靶点导入STRING (https://string-db.org/,Version11.0)[22]数据库,Organism 设定为“Homo sapiens”,为了保证数据的高可信度,在“Settings”中设置分数选择为0.9,隐藏网络中断开连接的节点,即可得到蛋白互作网络图,并将上述文件导入Cytoscape3.7.1软件中进行可视化网络拓扑分析。
1.5 构建“药物-有效成分-靶点”网络 将整理出的葛根芩连汤化学成分与UC相关的疾病靶点映射出共同靶点,导入Cytoscape3.7.1软件,构建“药物-有效成分-靶点”网络图。其中节点(node)分别代表药物、有效成分和潜在靶点,边(edg)表明三者之间的关系。
1.6 分子对接验证 PubChem(https://pubchem.ncbi.nlm.nih.gov)搜索药物小分子2D结构,应用ChemBioOffice Ultra 2014 Wizard软件优化为3D结构并统一保存为mol2格式。靶点蛋白的3D结构从PDB数据库中收集,使用PyMOL软件去除水分子和配体分子,应用AutoDockTools1.5.6对蛋白加氢、加电荷,使用命令提示符(CMD vina)进行分子对接,最后利用PyMOL可视化处理。
1.7 GO富集分析与KEGG通路分析 将上述葛根芩连汤与UC交集靶点导入DAVID数据库(DAVID 6.8,https://david.ncifcrf.gov/),物种限定为“人类”,进行GO富集分析及KEGG通路富集分析,筛选p<0.05的结果,导入R语言进行气泡图制作,并检索相关文献,对主要通路进行讨论。
2 结果
2.1 药物及疾病靶点获取 通过检索TCMSP数据库得到146个有效化学成分,240个药物靶点。其中,个别化学成分存在两种药物当中,如芒柄花黄素(formononetin)存在于葛根、甘草中,β-谷甾醇(betasitosterol)存在于葛根、黄芩中;黄连碱(coptisine)存在于黄芩、黄连中;表小檗碱(epiberberine)存在于黄芩、黄连中;槲皮素(quercetin)存在于黄连、甘草中,反应出葛根芩连汤多成分多靶点的网络效应。TTD、Drugbank、DisGeNET数据库共收集1 665个疾病靶点,标准化基因名并剔除重复值,最后得到1 382疾病靶点。
2.2 葛根芩连汤的潜在作用靶点 将获得的药物靶点与疾病靶点,通过R VeenDiagram程序包映射后,得到114个“药物-疾病”共同基因,因此,葛根芩连汤可能通过114个交集基因的协同作用治疗UC。详见图1。
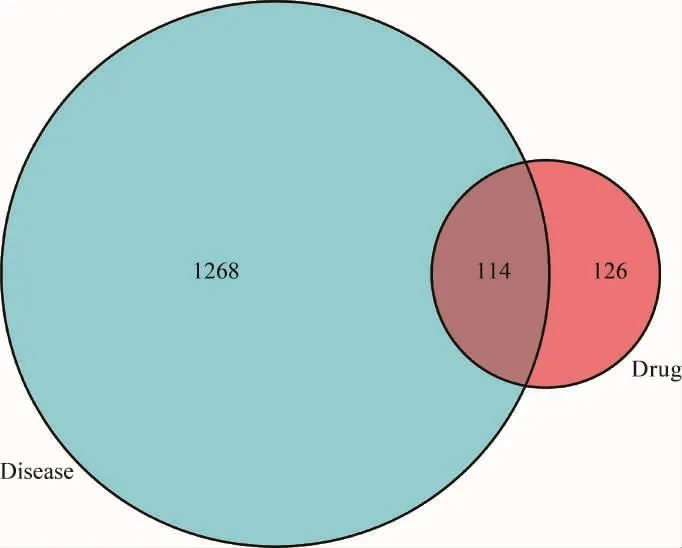
图1 药物-疾病交集基因Venny图
2.3 PPI核心网络构建与拓扑分析 将114个基因导入到STRING数据库中,显示114个节点(靶点蛋白)和354个边缘(蛋白相互作用),平均节点度6.21,节点为蛋白,线条为蛋白间的相互作用关系,详见图2。应用Cytoscape3.7.1软件中进行网络拓扑分析,计算 Degree、Betweenness、Closeness、Eigenvector、LAC值,筛选出高于每个条件中位值的基因,Degree值前10 的蛋白为 MAPK3、MAPK1、STAT3、FOS、MAPK14、ESR1、IL2、RELA、MYC、MAPK8,这些蛋白可能在葛根芩连汤治疗UC发中发挥重要作用,见图3。
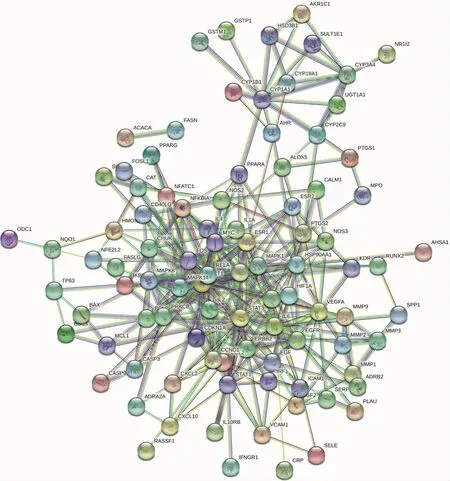
图2 葛根芩连汤治疗UC的PPI网络潜在靶点

图3 PPI网络核心蛋白
2.4 药物-有效成分-靶点网络构建分析 通过Cytoscape3.7.1软件建立药物-有效成分-靶点网络,如图4,一个有效成分可作用于多种靶点,如来源于甘草、黄连的橡黄素(Quercetin)与84个靶点相连;多种活性成分可共同作用于一个靶点,例如靶点PTGS2、CALM1、HSP90AA1、ESR1、NOS2、PTGS1、PPARG、ESR2与60个以上有效成分连接,反应出葛根芩连汤多成分、多靶点的协同作用。通过Cytoscape3.7.1分析后显示出关联强度较大的药物化学成分有橡黄素、山柰酚、汉黄芩素、柚皮素、黄芩素、甘草查尔酮A等,上述成分可能为葛根芩连汤治疗UC的重要活性成分。
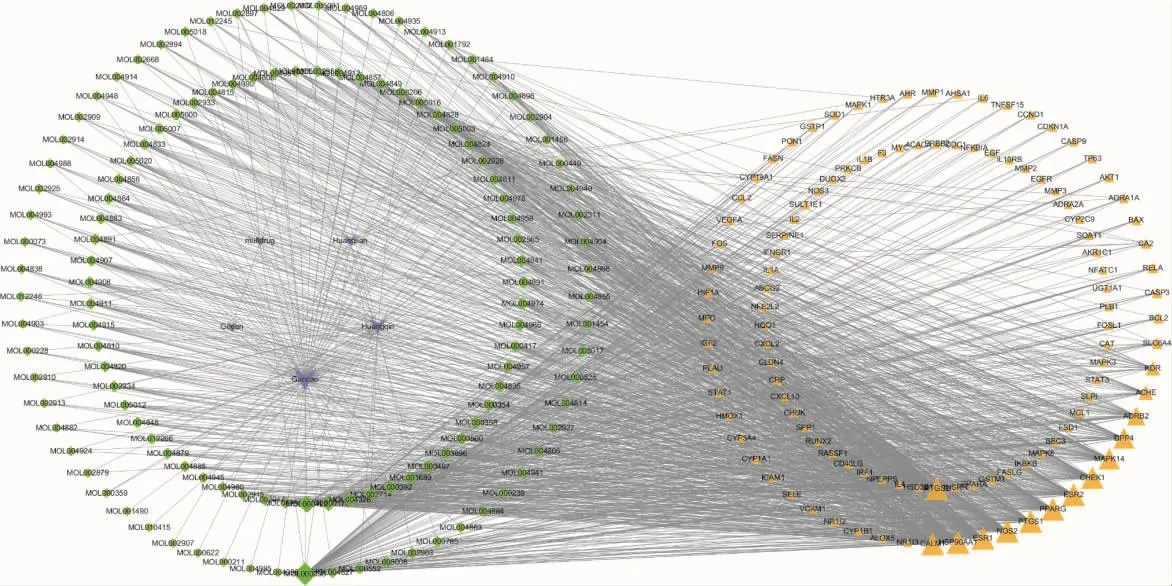
图4 药物-有效成分-靶点网络
2.5 分子对接模拟验证结果 将PPI核心网络中Degree值排名前12的靶点作为蛋白受体,药物-有效成分-靶点网络拓扑分析显示关联强度较大的前6的化学成分:甘草查尔酮A(MOL000497)、槲黄素(MOL000098)、汉黄芩素 (MOL000173)、柚皮素(MOL004328)、 黄 芩 素 (MOL002714)、 山 柰 酚(MOL000422)作为小分子配体,使用匹配原则算法来预测其结合模式及亲和力。以结合能作为筛选条件,配体与受体结合能量越低,代表相互作用关系越强烈,结合能≤-5.0 kcal/moL表示有较强亲和力[23-24]。共得到25个对接结果,如表1所示,强亲和力对接结果如图5所示,结果表明潜在靶点与有效成分有较强的结合力。
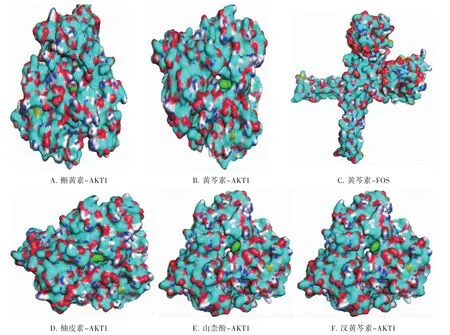
图5 核心靶点与活性成分对接模式

表1 核心靶点与活性成分结合能
2.6 GO功能富集分析 应用DAVID 6.8数据库对114个核心靶点进行GO富集分析,共得到599条结果,并以P值进行排序,筛选出P<0.05的生物学过程,运用R语言选取BP、CC、MF的前20绘制气泡图(图6-图8)。GO富集分析分为3类:生物过程(biological process,BP)、细胞组成(cellular component,CC)、分子功能(molecular function,MF)。其中以 BP条目最多,451个,主要涉及RNA聚合酶II启动子转录的正调控、凋亡过程负调控、炎症反应、细胞增殖的正调控、氧化还原反应、缺氧反应、免疫反应等方面;CC相关条目48条,主要分布于核、细胞质、细胞外空间等方面;MF相关条目100条,主要涉及蛋白结合、蛋白质同型二聚体活性等方面。综上,GO分析结果显示葛根芩连汤可涉及炎症、免疫、氧化还原反应、细胞增殖及凋亡、低氧反应等多个环节发挥治疗作用。2.7 KEGG通路富集分析 应用DAVID 6.8数据库对114个核心靶点进行KEGG通路富集分析,获得117条结果。应用R语言软件富集出前20个KEGG通路(见图9),如癌症通路、磷酸肌醇3-激酶/蛋白激酶 B(PI3K-Akt)信号通路、缺氧诱导因子-1(HIF-1)通路、丝裂原活化蛋白激酶(MAPK)通路、Toll受体(Toll-like receptor)及叉头转录因子(FoxO)信号通路、Ras信号通路等多个信号通路,表示葛根芩连汤通过多个信号通路协同发挥作用。

图6 生物过程的富集分析气泡图
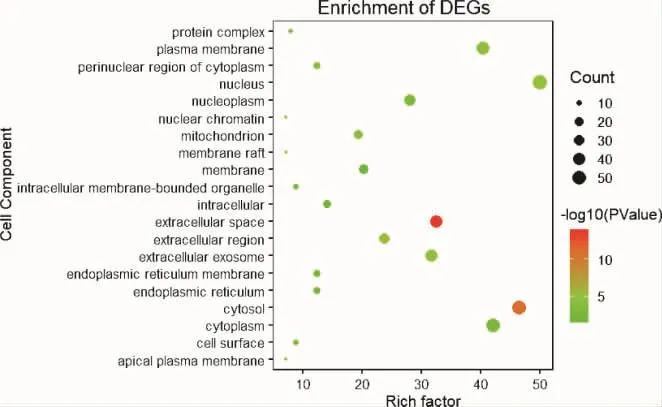
图7 细胞组成的富集分析气泡图
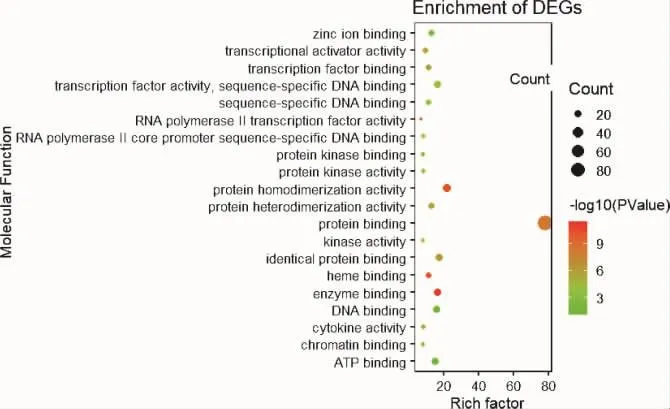
图8 分子功能的富集分析气泡图
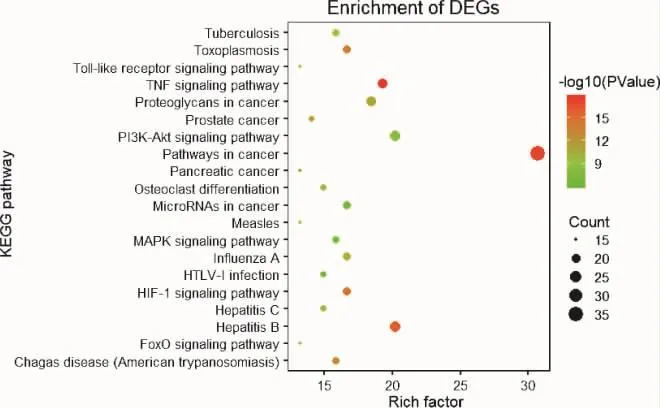
图9 KEGG通路的富集分析气泡图
3 讨论
本研究共筛选出葛根芩连汤146个有效化学成分,240个药物靶点,1 382疾病蛋白。首先,通过药物-有效成分-靶点网络构建,显示出关联强度较大的药物化学成分有橡黄素、山柰酚、汉黄芩素、柚皮素、黄芩素、甘草查尔酮A等,上述成分为葛根芩连汤治疗UC的重要活性成分。肠上皮细胞与免疫细胞构成了肠道屏障,共同维持肠道微环境的稳定。炎症反应和肠黏膜修复因子损伤介导了UC的发生发展。有文献显示橡黄素[25]可通过上调Arg-1同时抑制IL-17A,促进肠粘膜修复因子的表达而改善肠道炎症状态;而山柰酚具有抗炎、抗菌、抗肿瘤等多种药理作用,其可通过阻滞细胞周期于G2/M期、作用于PI3K-Akt发挥效用[26-27];柚皮素可下调总谷胱甘肽硫代肽(T-GSH)、非蛋白硫代肽(NP-SH),促进肠上皮黏液分泌从而产生对炎症性肠病的保护作用[28]。另有研究表明[29],黄芩素干预的大鼠模型中,NF-κB和MAPK表达水平显著降低,NF-κB与MAPK的激活可诱发严重的炎症瀑布;甘草查尔酮A[30]则可通过抑制NF-κB,提高Nrf2水平,降低氧化应激和炎症因子表达,从而缓解UC肠粘膜炎症。因此,推测葛根芩连汤可通过抑制炎症反应、促进粘膜修复因子的表达来缓解UC的发生发展。其次,通过网络拓扑分析显示 PTGS2、CALM1、HSP90AA1、ESR1、NOS2、PTGS1、PPARG、ESR2与60个以上有效成分连接,这些可能是葛根芩连汤治疗UC的关键靶点,其中ESR1[31]、PTGS2[32]、PPARG[32]、NOS2[33]已被学者证实是 UC 的重要靶点,但其他相关性极高的靶点CALM1、HSP90AA1等为本研究首次发现,这可为进一步研究UC的作用机制提供新的参考方向。
GO富集分析结果显示,葛根芩连汤活性成分主要富集在RNA聚合酶II、细胞增殖及凋亡、炎症反应、免疫反应、氧化还原反应、低氧反应等生物学过程,其中炎症及免疫反应介导UC发生发展与大多数既往学者观点一致。RNA聚合酶II与幽门螺旋杆菌感染诱导特异性基因的甲基化有关,而甲基化水平与黏膜癌变风险相关[34]。“生理性缺氧”是低氧水平的肠黏膜特征,是正常上皮细胞生理的原因和结果,而“病理性低氧”则是肠黏膜活动性炎症的标志[35],HIF[36]是低氧反应的主调节因子。正常微环境中,HIF-α可被蛋白酶降解,在缺氧状态,HIF可上调VEGF、iNOS、EPO等多种靶基因,使机体适应缺氧环境而缓解黏膜炎症[37]。体内重要的代谢途径都需要氧气的参与,组织病理性缺氧和局部炎症反应几乎是同时发生的[38]。携氧的炎症细胞聚集黏附可导致局部氧耗尽诱发炎症,而炎症反应致使微血管损伤,可进一步加重局部组织的灌注不足而造成炎症的恶性循环[39-41]。因此,葛根芩连汤可能通过改善肠黏膜局部氧供缓解肠粘膜炎症,作用于RNA聚合酶II而降低黏膜癌变风险。
KEGG通路富集分析显示,主要涉及通路包括Cancer、PI3K-AKT、HIF-1、MAPK、TOLL 受体等多个信号通路。UC患者癌变风险与病程呈正相关,这与结直肠黏膜的长期慢性炎症相关。癌变的发生源于“反复炎症—不典型增生—癌变”三部曲,反复的炎症和肠黏膜的损伤-修复,酿成了易于肿瘤生长的微环境[42]。研究表明,癌症通路涵盖了本文所提出的FoxO[43]、Ras-MAPK[43]、TOLL 受体[44]、HIF[45]等多个信号通路。研究表明,FoxO3可上调NF-κBp50损害肠黏膜屏障使炎症持续存在增高癌变风险[46]。Toll-like receptor 4通过调节ACA-T1抑制肠癌细胞的侵袭和扩散,下调MAPK-HIF-α-VEGF途径可抑制肿瘤血管生成,延缓肿瘤进展[45]。这表明葛根芩连汤可能在延缓UC向大肠癌进展过程中扮有重要角色。其次,TNF和TNFR超家族在介导细胞分化、生成、凋亡、炎症、免疫调节等方面发挥了重要作用[47]。其中,TNF-α是一种在肠黏膜固有层高度表达的促炎因子,在增加肠黏膜的通透性、造成局部的损伤和炎症反应、促进血栓形成等方面起有重要作用,并介导NF-κB、MAPK、Toll样受体4等多个信号通路[48-50]。目前,TNF单抗已经应用于临床治疗重度UC,并得到广泛认可,这与本文得到的TNF通路一致。另有学者表明,黄芩汤[51]通过抑制Ras-P13K-Akt-HIF-1α和NF-κB通路、调节TLR4和GPCR抑制Ras信号通路,从而下调炎症因子,缓解肠黏膜炎症。因此,我们推测,葛根芩连汤可能通过作用于Ras-P13K-Akt-HIF-1α、TLR4-Ras信号通路发挥抗炎、作用于MAPK-HIF-α-VEGF延缓肿瘤进展等作用。
本研究通过网络药理学和既往研究基础,揭示了葛根芩连汤治疗UC的多成分、多靶点、多通路的网络作用,主要与相关通路介导的抗炎、抗氧化损伤、低氧反应、阻滞细胞周期延缓肿瘤进展等效应有关。目前多项研究表明中医学的湿热证与现代医学的慢性炎症高度一致,中医学清热祛湿法相当于现代医学抗炎治疗,这与本研究显示葛根芩连汤作用于多个经典炎症通路相符。然而本研究不足之处在于,仅是对葛根芩连汤治疗UC机制的理论层面探讨,不能精确地阐述和证实上述通路在体内的具体代谢机制,未来还需通过动物实验进一步验证。
