绍兴鸭小群保种效果的分子生物学监测
2021-10-19刘莉君章晓炜马敏彪陆建定王珍珍卢立志刘雅丽
刘莉君, 章晓炜, 马敏彪, 陆建定, 王珍珍, 卢立志, 刘雅丽*
(1.浙江省畜牧技术推广总站,浙江 杭州 310021; 2.浙江省农业科学院 畜牧兽医研究所,浙江 杭州 310021)
绍兴鸭属蛋用型品种,中心产区为绍兴、上虞、诸暨、肖山、余姚等市(县),陆游的《稽山行》一诗中有“坡放万头鸭,园复千畦姜”之句,可见绍兴养鸭历史悠久。绍兴鸭具有体型小、产蛋多、耗料少、成熟早和适应性强等特点,是我国优良的蛋用型鸭种[1]。现阶段,多用微卫星手段辅助监测动物群体遗传结构稳定性及遗传物质多样性,从而对保种群体的稳定性做出判断。微卫星是由循环序列和两翼的保守序列构成,核心序列的循环次数不同形成了微卫星的高度多态性,具有分布广、特异性强、易检测等特点[2-4]。本研究利用微卫星标记分析采用各家系小群保种绍兴鸭的遗传多样性,旨在评价该方式的保种效果,以期找到最适的保种方式,为绍兴鸭资源的开发利用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 血样来源
随机采集绍兴咸亨绍鸭育种有限公司原种场的两个世代30个家系的绍兴鸭血液,每个世代60只个体,群体比例为1∶1,公鸭30只,母鸭30只,两个世代共计120只。
1.1.2 主要试剂及仪器
TaKaRa Blood Genome DNA Extraction Kit试剂盒购置于宝生物工程(大连)有限公司。
一次性人体静脉血样采集容器(含EDTA-K2)(江苏康捷医疗器械有限公司);ABI3730XL全自动DNA测序仪(ABI3730XL,美国应用生物系统公司)。
1.2 方法
1.2.1 血样采集
通过每只鸭的翅静脉采集0.5 mL血液,置于2 mL真空采血管,-20 ℃保存。
1.2.2 DNA提取
根据TaKaRa Blood Genome DNA Extraction Kit试剂盒的说明,提取DNA。
1.2.3 微卫星引物筛选
根据GenBank和文献[5-7]提供的鸭的微卫星序列设计引物,引物由上海捷瑞生物技术有限公司合成,并对合成的引物进行筛选,最终选择28对微卫星引物(表1)。
1.2.4 PCR扩增反应程序及反应体系
反应程序:94 ℃预变性处理5 min;随后按照94 ℃变性反应30 s、52~64 ℃退火35 s、72 ℃延伸40 s 3步进行35个扩增循环;最后在72 ℃继续延伸10 min。
反应体系:DNA 2 μL,l0×Taq Buffer 2 μL,TaqDNA聚合酶0.2 μL,0.2 mmol·L-1dNTP 0.2 μL,上下游引物(5 pmol·L-1)各1 μL,ddH2O补齐至20 μL。
1.2.5 PCR产物检测
利用ABI 3730XL测序仪通过毛细管电泳,检测PCR产物片段大小。总测序含量为10 μL,包括高质量去离子甲酞胺Hi-Di Formamide 7.5 μL,引物(表1)的PCR扩增产物2 μL和GS-500 SizeStandard(标准内参)0.5 μL。
1.3 统计分析
采用GeneMaker 2.6.0软件读出各座位各目标片段大小,判断纯合子或杂合子(单峰和双峰);采用Microsatellite-Toolkit软件对群体遗传多样性参数进行统计分析;采用Popgene 32软件对所检测座位的哈代-温伯格平衡、Nei氏遗传距离及相似性进行统计分析;两个世代的所有数据通过SPSS 17.0软件分析差异显著性。
2 结果与分析
2.1 微卫星座位检测分型
经ABI3730XL DNA Analyzer全自动测序仪对28个座位进行检测扫描,由GeneMaker 2.6.0自动生成图谱,图1为其中一个座位的基因型。
图1 某座位的基因分型
2.2 等位基因比较
经过一个世代的保种,等位基因数基本保持不变(表2),两个世代各微卫星基因座位的平均等位基因(P=0.965)和优势等位基因频率(P=0.538)差异均不显著。
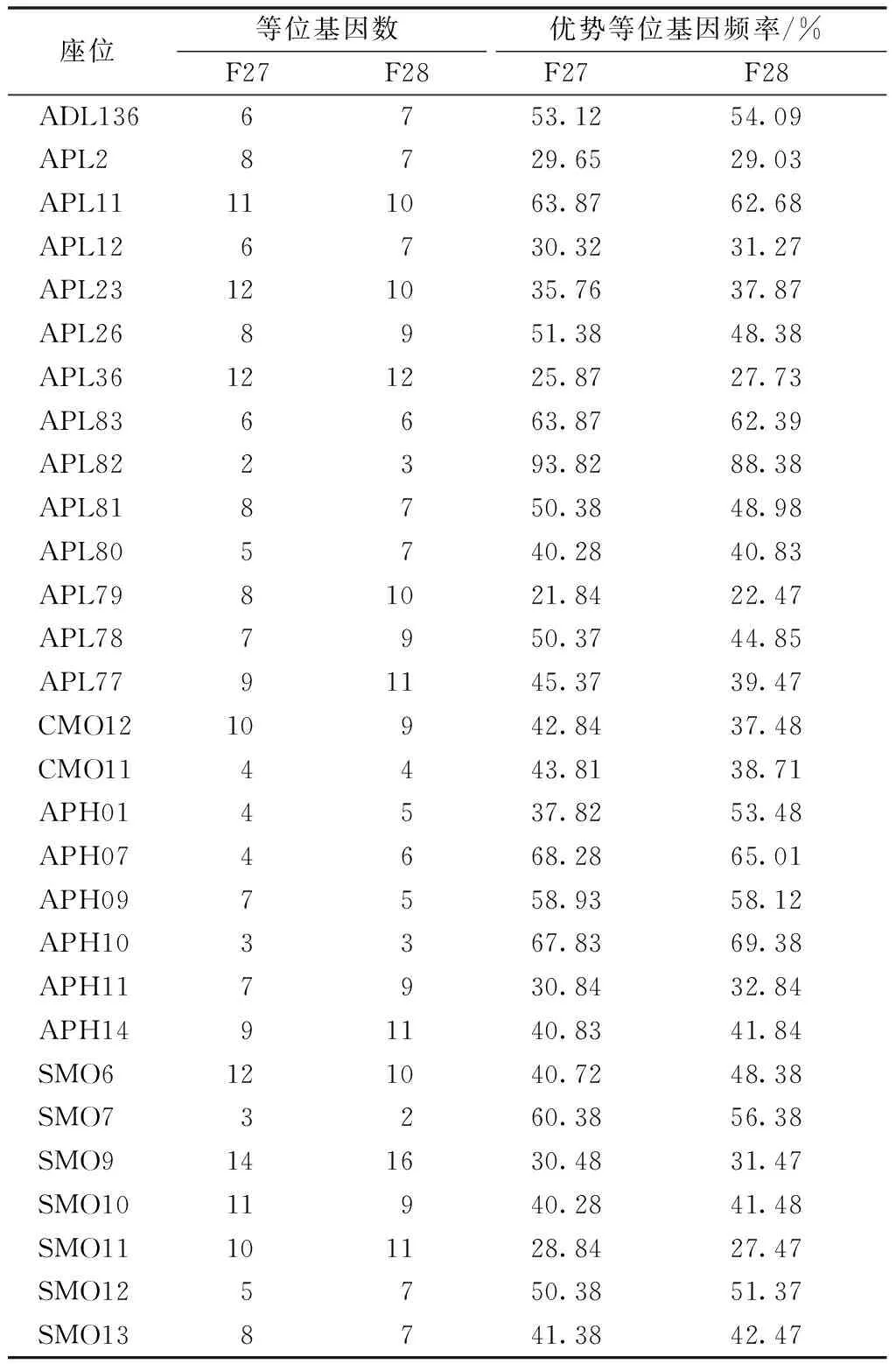
表2 两个世代群体等位基因数、优势基因片段大小及频率
2.3 基因座位遗传多态性比较
两个世代群体各微卫星座位遗传多态性见表3。两个世代的多态信息含量值(PIC)为0.184 2~0.846 2,其中APH14和CMO12两个座位为低度多态(PIC<0.25),其他座位为中高度多态(PIC>0.25);两个世代群体PIC平均值分别为0.483 2和0.479 3,差异不显著(P=0.703);He值(期望杂合度)在0.208 4~0.868 2,平均值分别为0.502 8和0.513 8,两个世代无显著差异(P=0.482);Ho值(表观杂合度)在0.172 9~0.964 8,两个世代平均值分别为0.650 0和0.639 3,差异不显著(P=0.903)。

表3 两个世代在28个基因座位遗传多态性
2.4 遗传变异检测
通过对两个世代每个座位的哈代-温伯格的检验(表4),结果发现,27世代有7个不平衡座位,28世代有8个不平衡座位。从表5可以看出,两个世代间Nei氏相似性系数为0.991 5,Nei氏遗传距离为0.008 5,Nei氏相似性系数极高且遗传距离极低,符合保种群世代间遗传规律。

表4 两世代28个基因座位的哈代-温伯格检验

表5 两个世代的Nei氏遗传距离及相似性系数
2.5 群体有效含量检测
该保种场采用小群体随机留种保种方法,保种群约550只(母鸭500只,公鸭50只),按照公式Ne=4 Ns·Nd/Ns﹢Nd计算得出该保种场群体有效数量(Ne)为182只,每代近交增量(ΔF)为0.27%,近交系数达到5%需要19个世代。
3 小结与讨论
有效等位基因、杂合度(H)、多态信息含量(PIC)均是反映品种内遗传变异大小的量度[8]。遗传多样性的杂合度指标可以反映各群体在多个座位上的遗传变异,Takezaki等[9]认为,用于测定遗传差异的标记在群体中的平均杂合度在0.3~0.8才有实际意义。多态信息含量是检测等位基因变异程度高低的主要指标之一,当PIC>0.5时,为高度多态性,当0.25 本研究利用28个微卫星座位分析了绍兴鸭小群保种的两个世代群体遗传多样性及保种效果,结果显示,在分子水平指标均无显著性变化。其中,两世代的He平均值分别为0.502 8和0.513 8,Ho平均值分别为0.650 0和0.639 3,均在0.3~0.8,两个世代的APH14和CMO12座位表现为低度多态,其余座位表现为中高度多态(PIC>0.25)。两世代PIC平均值分别为0.483 2和0.479 3,处于中度多态。通过一个世代更替,等位基因数略有上升,两世代平均等位基因和优势等位基因频率差异均不显著。 哈代-温伯格检验和群体有效数量也是反映群体遗传稳定性的重要指标。本研究的两个世代绍兴鸭28个微卫星座位中分别有7和8个座位处于不平衡状态,低于张静等[11]的18个微卫星基座中有14个座位处于不平衡状态,但依旧表明该保种群遗传结构逐渐趋于不平衡状态,主要原因可能是各家系小群保种采用轮配方式导致随机性变小而引起的遗传漂变,因此,保种场可以扩大各家系保种数量,同时增加群体保种的方式来提高群体遗传稳定性。该保种场目前的有效保种群体数量(Ne)为182只,世代的ΔF为0.27%,符合世代增量低于0.50%的原则,表明小群保种能够有效的保存绍兴鸭的品种特征,对水禽采用这种保种方法是可行的,可以作为监管部门保种监测的辅助手段。
