不依赖IPTG诱导产木糖醇大肠杆菌工程菌的构建
2021-10-18杨东成付声亮王金华王永泽
唐 梅,蔡 松,杨东成,付声亮,王金华,王永泽*
(湖北工业大学 生物工程与食品学院,湖北 武汉 430068)
木糖醇为五元醇,是木糖代谢的中间产物之一,与常见的糖醇如山梨醇、麦芽糖醇和甘露醇相比,具有明显的优越性[1],不仅防龋齿发生,也能作为糖尿病人的食品,广泛应用于化工、医药、食品等领域[2-3]。近年来,木糖醇市场需求不断扩大,国内木糖醇的年产值己超过13亿元,今后3年,国际市场上木糖醇总需求量将达10万t以上[4-5],因此,增加木糖醇的产量具有现实意义[6]。
以往的研究主要以酵母菌作为发酵菌株产木糖醇[7-9]。由于大肠杆菌(Escherichia coli)具有营养简单、生长迅速等特点,关于大肠杆菌发酵产木糖醇的报道日益增多。然而,基于大肠杆菌BL21(DE3)[10-12]和大肠杆菌W3110[13]产木糖醇的过程中均需要添加诱导剂异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)诱导。尽管其诱导条件简单,只需要极少量就能稳定地诱导乳糖操纵子的转录[14],但IPTG不仅具有潜在的毒性而且价格昂贵,只作为实验室用于少量蛋白表达时的诱导剂,而且在大规模发酵中不占优势,不被各国药典提倡使用。
为了避免大肠杆菌发酵或催化时添加IPTG,目前主要采用如下方式:以不同浓度的异乳糖和乳糖作为诱导剂,通过调节乳糖浓度,达到与IPTG诱导相当的效果[15-17]。但是乳糖可以被细胞代谢,不稳定,且诱导条件不易掌握;添加乳糖醇[14,18]或者对苯甲酸异丙酯[19-20]来降低成本和毒性,但使用范围不可预知;应用非化学添加剂的启动子,如组成型启动子,但它完全不受到阻遏蛋白调控,导致菌体生长过慢。此外,温敏型操纵子和厌氧型启动子,具有类似诱导型启动子启动的功能。lacI基因的温度敏感突变体可在30 ℃条件下抑制转录,42 ℃开始发挥作用,热诱导成本低,但在大型发酵罐中很难温度转换,其本身会导致大肠杆菌的热休克蛋白激活,一些蛋白酶会影响产物的稳定[21]。pflB-p6厌氧启动子可在厌氧条件下实现还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)的倍增,高还原力的产物有利于木糖醇的产生,但需要厌氧条件相关基因才能启动表达,这可能影响最终产量[22]。
在不添加IPTG的条件下,渗漏表达也可在一定程度上实现大肠杆菌发酵或者催化。张宏志等[23]通过控制lacI数量,研究了高渗漏条件下蛋白表达情况,虽然没有完全去除诱导剂IPTG,但为实现无添加IPTG产木糖醇提供了一条新的思路。本研究通过构建含有博伊丁假丝酵母(Candida boidinii)的编码醛糖还原酶xylI基因的重组质粒(pWYZ-1与pWYZ-2),研究启动子、质粒拷贝数、诱导剂IPTG的添加、基因xylA和xylB敲除、木糖浓度对工程菌发酵产木糖醇的影响,以期实现大肠杆菌产木糖醇时无需添加IPTG。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
本研究所用的菌株和质粒及其来源见表1。

表1 本研究所用菌株和质粒及其来源Table 1 Strains,plasmids and their origin used in this study
1.1.2 引物
本研究所用的引物序列见表2。

表2 本研究所用的引物和序列Table 2 Primers and sequences used in this study
1.1.3 试剂
木糖醇(纯度>99.9%):上海麦克林生物有限公司;Primer STAR Max Premix(2×):日本TaKaRa公司;IPTG(纯度>99.9%):美国Sigma公司;T5核酸外切酶(10 U/μL):中国新海基因检测有限公司;胶回收试剂盒:美国Omega Bio-Tek公司;胰蛋白胨、酵母粉、琼脂粉(均为生化试剂):英国OXOID公司。
1.1.4 培养基
LB培养基:酵母粉5 g/L、胰蛋白胨10 g/L、NaCl 5 g/L,pH 7。固体培养基中添加20 g/L琼脂粉。
种子培养基[22]:葡萄糖20 g/L、木糖10 g/L、酵母粉5 g/L、胰蛋白胨10g/L、NaCl5g/L,灭菌后添加终质量浓度为50mg/L的氨苄青霉素。
发酵培养基[22]:葡萄糖5 g/L、木糖20 g/L、酵母粉5 g/L、胰蛋白胨10 g/L、NaCl 5 g/L,灭菌后添加终质量浓度为100 mg/L的氨苄青霉素。
以上培养基均在121 ℃条件下高压蒸汽灭菌20 min。
1.2 仪器与设备
MicroPulserTM电穿孔仪、2 mm 1652082电击杯、HPX-87H色谱柱(300 mm×7.8 mm):美国Bio-Rad公司;Waters e2695高效液相色谱(high performance liquid chromatography,HPLC)仪(配有示差检测器):美国Waters公司;5417R高速冷冻离心机:德国Eppendorf公司;UV/VIS-2802PC可见光分光光度计:尤尼柯(上海)仪器有限公司。
1.3 方法
1.3.1 大肠杆菌AI05中xylA和xylB基因的敲除
为阻断木糖的代谢利用,敲除E.coliAI05菌株自身代谢木糖的木糖A异构酶基因xylA和木酮糖激酶基因xylB。具体步骤如下:
(1)xylA基因的敲除:以质粒pKD4为模板,ΔxylA P1和ΔxylA P2为引物聚合酶链式反应(polymerase chain reaction,PCR)扩增打靶片段。PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s,43 ℃退火30 s,72 ℃延伸2 min,30个循环;72℃再延伸5 min。xylB基因的敲除:以质粒pKD4为模版,ΔxylB P1和ΔxylB P2为引物PCR扩增打靶片段。PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s,45 ℃退火30 s,72 ℃延伸2 min,30个循环;72℃再延伸5min。所有打靶片段扩增后切胶回收。
(2)采用CaCl2法将质粒pKD46转入E.coliAI05感受态细胞中[24],得到E.coliAI05/pKD46。
(3)将打靶片段电转化到E.coliAI05/pKD46细胞中。挑选E.coliAI05/pKD46单菌落于LB液体培养基,在30 ℃、200 r/min条件下振荡培养至OD600nm值为0.2~0.3时添加1.6%的L-阿拉伯糖,继续培养至OD600nm值为0.6左右,于4 ℃条件下6 000 r/min离心5 min,收集细胞,用超纯水清洗菌体3~5次,最终菌体体积为200 μL,即得E.coliAI05/pKD46的感受态细胞。取80 μL感受态细胞加入8 μL打靶片段后,放入电击杯,采用EC2程序(2 500 V)进行电击。电击结束后迅速加入1 mL LB液体培养基进行复苏,30 ℃复苏培养2 h,再取100 μL涂布于含50 mg/L卡那霉素的LB固体培养基平板上,37℃培养24h,待平板上长出单菌落后,以L-xylA-P1、L-xylA-P2或者L-xylB-P1、L-xylB-P2为鉴定引物,进行菌落PCR,分别验证xylA和xylB基因敲除的结果。
(4)采用质粒pFT-A消除大肠杆菌染色体上的卡那抗性基因[24],将成功敲除xylA基因的菌株E.coliAI05命名为E.coliAI06;将成功敲除xylB基因的菌株E.coliAI06命名为E.coliAI07。
1.3.2 重组质粒的构建
在固定lacP启动子条件下,分别基于质粒pUC19(高拷贝质粒)和质粒pBR322(中拷贝质粒)构建新质粒pWYZ-1和pWYZ-2。
(1)以质粒pAGI02作为模板,使用引物pUC19-xylI P1和pUC19-xylI P2PCR扩增醛糖还原酶基因xylI;采用质粒pUC19作为模板,使用反向引物pUC19/lac P1和pUC19/lac P2PCR扩增得到序列长度为2 362 bp的线性化质粒pUC19,线性化质粒pUC19为去除lacZα基因序列、保留lacO基因序列的质粒;用T5外切酶将PCR扩增出的醛糖还原酶基因xylI与线性化质粒pUC19进行外切处理[25],取5 μL处理后的产物转化到100 μL大肠杆菌感受态细胞DH5α中,将其涂布于含50 mg/L氨苄青霉素的LB固体培养基平板,于30 ℃条件下培养20 h后,采用引物pUC19/lac P1和pUC19/lac P2对转化子进行菌落PCR,检验克隆结果。提取检验成功的菌落的重组质粒,委托昆泰锐(武汉)生物技术有限公司测序,测序正确的质粒命名为pWYZ-1。质粒pWYZ-1的图谱见图1。
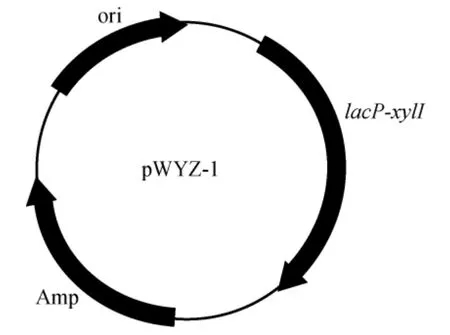
图1 质粒pWYZ-1的图谱Fig.1 Map of plasmid pWYZ-1
(2)以质粒pBR322为模板,采用反向引物pBR322-F-P1和pBR322-F-P2PCR线性化质粒pBR322,线性化质粒pBR322为除去tetP和Tcr基因的序列,理论长度为3 094 bp。以质粒pWYZ-1为模板,采用引物pBR322-lacP-xylI P1和pBR322-lacP-xylI P2PCR扩增lacO-xylI基因,碱基长度为1 168 bp。用T5外切酶处理lacO-xylI基因和线性化质粒pBR322载体,取5 μL处理后的产物转化到100 μLE.coliDH5α感受态细胞中,将其涂布于含50 mg/L氨苄青霉素的LB固体培养基平板,于30 ℃条件下培养20 h后,采用引物pBR322-lacP-xylI P1和pBR322-lacP-xylI P2对转化子进行菌落PCR,检验克隆结果。提取检验成功的菌落的重组质粒,委托昆泰锐(武汉)生物技术有限公司测序,将测序正确的质粒命名为pWYZ-2。质粒pWYZ-2图谱见图2。
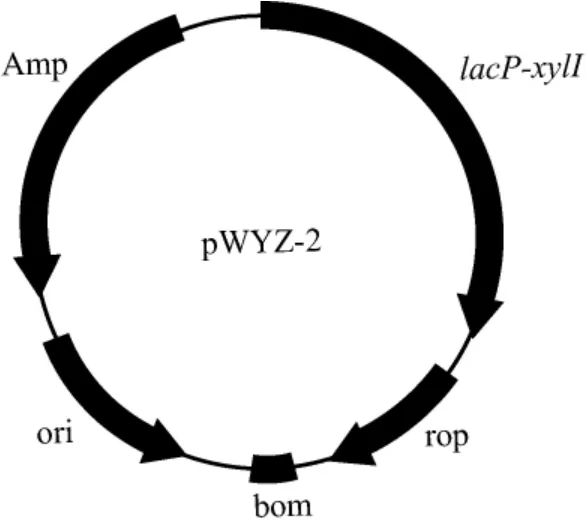
图2 质粒pWYZ-2的图谱Fig.2 Map of plasmid pWYZ-2
1.3.3 工程菌的构建
将重组质粒pWYZ-2转化到E.coliAI05中,得到基因工程菌E.coliAI05/pWYZ-2。将质粒pAGI02、重组质粒pWYZ-1和pWYZ-2分别化转到E.coliAI07中,得到基因工程菌E.coliAI07/pAGI02、E.coliAI07/pWYZ-1和E.coliAI07/pWYZ-2。
1.3.4 工程菌种子液的制备
将工程菌E.coliAI05/pWYZ-2、E.coliAI07/pAGI02、E.coliAI07/pWYZ-1和E.coliAI07/pWYZ-2分别接种到含50 mg/L氨苄青霉素的LB固体培养基平板上,30 ℃条件下活化3代;然后从平板上挑取3个单菌落转接至50 mL种子培养基中,30 ℃、200 r/min条件下振荡培养12 h,作为种子液备用。
1.3.5 转速对菌株E.coliAI07/pAGI02和E.coliAI07/pWYZ-1发酵产木糖醇的影响
按照2%(V/V)的接种量将E.coliAI07/pAGI02、E.coliAI07/pWYZ-1分别接种于含有100mg/L氨苄青霉素的100mL发酵培养基中。发酵温度设置为30 ℃,摇床转速分别设置为0、50 r/min、100 r/min、150 r/min和200 r/min,振荡培养96 h;每12 h向发酵摇瓶中补加100 μL氨苄青霉素(100 mg/L);每24 h取2 mL发酵液,检测菌株的OD600nm值、发酵液中的葡萄糖、木糖和木糖醇的含量。
1.3.6 质粒拷贝数对渗漏表达基因菌株产木糖醇的影响
除了启动子种类外,质粒拷贝数也是影响基因表达水平的重要因素。在固定lacP启动子条件下,考察了质粒拷贝数对木糖醇产量的影响。
按照2%(V/V)的接种量将E.coliAI07/pWYZ-1和E.coliAI07/pWYZ-2分别接种于含有100mg/L氨苄青霉素的100mL发酵培养基中,30 ℃、200 r/min条件下发酵96 h。每12 h向发酵摇瓶中补加100 μL氨苄青霉素(100 mg/L);每24 h取2 mL的发酵液,检测发酵液中的葡萄糖、木糖和木糖醇的含量。
1.3.7 IPTG添加对渗漏表达基因菌株产木糖醇含量的影响
当质粒上没有lacI基因表达阻遏蛋白时,lacP启动子仅靠大肠杆菌基因组表达少量阻遏蛋白来控制表达体系,因此,菌株E.coliAI07/pWYZ-2存在一定程度渗漏表达。加入IPTG后,这些少量的阻遏蛋白会进一步从操纵位点离去,从而可进一步提高xylI基因的转录水平。
为考察添加IPTG对木糖醇产量的影响,按照2%(V/V)的接种量将E.coliAI07/pWYZ-2接种于含有100 mg/L氨苄青霉素的100 mL发酵培养基中,30 ℃、200 r/min条件培养9.5 h,当摇瓶中菌液OD600nm达到0.8~1.0时添加100 μL 0.1 mmol/L的诱导剂IPTG开始诱导(以不添加IPTG的组别为对照组),诱导至发酵结束。每12 h向发酵摇瓶中补加100 μL氨苄青霉素(100 mg/L);每24 h取出2 mL的发酵液,检测发酵液中的木糖醇的含量。
1.3.8 基因xylA和xylB敲除对渗漏表达基因菌株产木糖醇含量的影响
按照2%(V/V)的接种量将E.coliAI07/pWYZ-2和E.coliAI05/pWYZ-2接种于含有100 mg/L氨苄青霉素的100 mL发酵培养基中,30 ℃、200 r/min条件下培养96 h,每12 h向发酵摇瓶中补加100 μL氨苄青霉素(100 mg/L)。每24 h从摇瓶取出2 mL发酵液,检测发酵液中木糖醇的含量。
1.3.9 木糖含量对渗漏表达基因菌株产木糖醇含量的影响
为探索E.coliAI07/pWYZ-2转化木糖的最大潜能,提高发酵原料即木糖的含量,同时维持木糖和葡萄糖质量浓度比为4∶1,考察不同质量浓度木糖下菌株产木糖醇的含量。按照2%(V/V)的接种量将E.coliAI07/pWYZ-2分别接种于含有100 mg/L氨苄青霉素和不同含量碳源(木糖20 g/L+葡萄糖5 g/L、木糖50 g/L+葡萄糖12.5 g/L、木糖80 g/L+葡萄糖20 g/L)的100 mL发酵培养基中,30 ℃、200 r/min条件下培养至木糖醇含量达到最大值时结束发酵,每12 h向发酵摇瓶中补加100 μL氨苄青霉素(100 mg/L)。每24 h从摇瓶取出2 mL发酵液,检测发酵液中木糖醇的含量,并记录整个发酵过程中木糖醇含量达到最大值时所需的发酵时间和木糖醇的最高含量,并计算木糖醇生产强度。
1.3.10 分析检测
OD600nm值的测定:采用可见分光光度计,在波长600 nm处测定吸光度值[26]。
葡萄糖、木糖和木糖醇质量浓度的测定:将发酵液于12 000 r/min离心5 min,用超纯水稀释上清液至合适倍数,用0.22 μm的滤膜过滤,采用高效液相色谱法检测滤液中的葡萄糖、木糖和木糖醇的含量[22]。
2 结果与分析
2.1 xylA和xylB基因的敲除结果
以内部验证引物(L-xylA-P1和L-xylA-P2,L-xylA-P1和L-xylA-P2)分别对菌株E.coliAI05中编码木糖A异构酶基因xylA和木酮糖激酶基因xylB敲除的结果进行验证,结果见图3。

图3 xylA和xylB基因敲除菌的菌落PCR鉴定结果Fig.3 Identification result of xylA and xylB gene knockout strain by colony PCR
由图3可知,拥有基因xylA和xylB的菌株经过菌落PCR扩增后,分别出现碱基长度为913 bp和960 bp的核酸片段,而敲除这两个基因后的菌株经PCR扩增后无该核酸片段,表明这两个基因已成功敲除。
2.2 转速对菌株E.coli AI07/pAGI02和E.coli AI07/pWYZ-1产木糖醇的影响
转速对菌株E.coliAI07/pAGI02和E.coliAI07/pWYZ-1发酵产木糖醇的影响见图4。
由图4可知,随着转速在0~200 r/min范围内的增加,两株菌的OD600nm值、葡萄糖、木糖及木糖醇含量变化趋势一致,其中OD600nm值与木糖醇产量呈升高的趋势,而葡萄糖与木糖含量呈下降趋势,表明生物量与木糖醇的产量存在着密切关系。当转速为0~100 r/min时,菌株E.coliAI07/pAGI02与E.coliAI07/pWYZ-1相比,木糖醇产量较高。分析原因可能是在低转速(0~100 r/min)的条件下,菌株处于无氧或者微氧环境,具有厌氧启动子pflB-p6基因的菌株E.coliAI07/pAGI02菌株能表达更多醛糖还原酶,且还原力更强[26],更有利于木糖醇的合成。而当转速为150~200 r/min时,菌株E.coliAI07/pAGI02与E.coliAI07/pWYZ-1相比,木糖醇产量较低且生物量和木糖都有显著的提升。这表明厌氧启动子pflB-p6与lacP启动子对菌株产木糖醇含量有明显影响。当转速为200 r/min时,E.coliAI07/pWYZ-1的木糖醇产量是E.coliAI07/pAGI02的1.8倍。
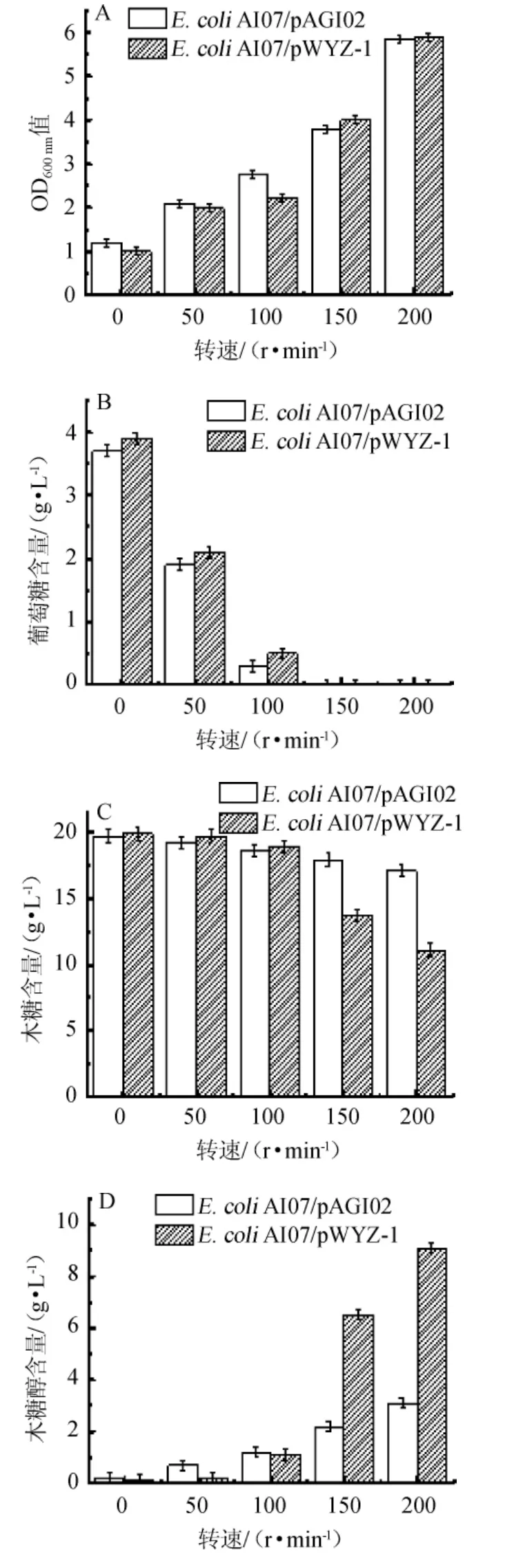
图4 转速对Escherichia coli AI07/pAGI02和Escherichia coli AI07/pWYZ-1发酵的影响Fig.4 Effect of rotation speed on Escherichia coli AI07/pAGI02 and Escherichia coli AI07/pWYZ-1 fermentation
2.3 质粒拷贝数对渗漏表达基因菌株产木糖醇的影响
质粒拷贝数对渗漏表达基因菌株E.coliAI07/pWYZ-1和E.coliAI07/pWYZ-2发酵产木糖醇的影响见图5。
由图5可知,菌株E.coliAI07/pWYZ-2发酵产木糖醇含量高于菌株E.coliAI07/pWYZ-1,发酵48 h时,木糖醇含量分别达到19.56 g/L、7.90 g/L。说明中拷贝质粒比高拷贝质粒对菌株产木糖醇更有优势。
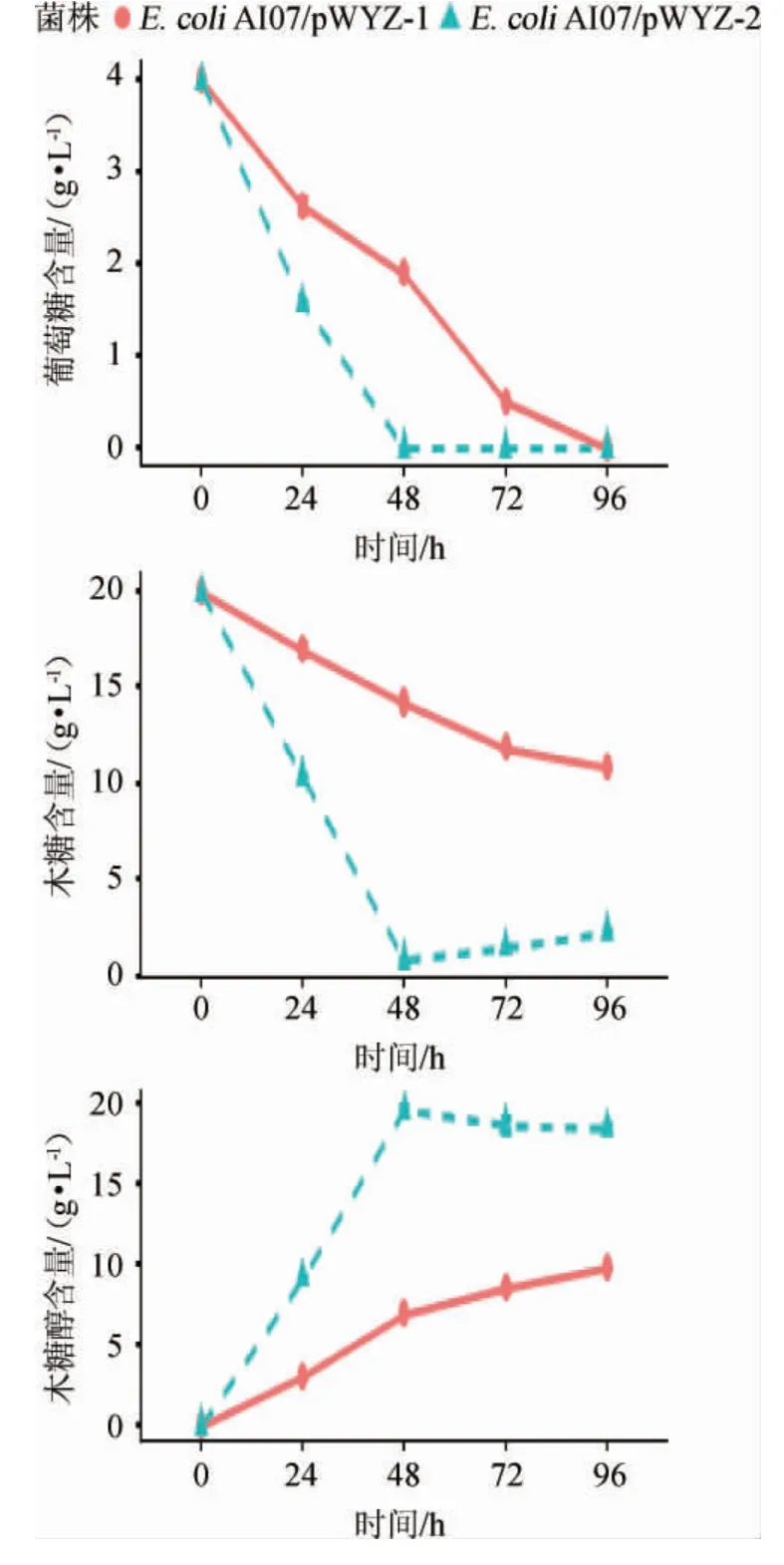
图5 质粒拷贝数对Escherichia coli AI07/ pWYZ-1和Escherichia coli AI07/pWYZ-2发酵的影响Fig.5 Effect of plasmid copy number on Escherichia coli AI07/pWYZ-1 and Escherichia coli AI07/pWYZ-2 fermentation
目前用于蛋白表达的载体多用中拷贝和高拷贝质粒,高拷贝质粒能提供更多的拷贝用于醛糖还原酶的表达,这更有利于提供木糖向木糖醇的转化,但有些情况下,中拷贝质粒在蛋白表达上更具有一定优势,有文献报道显示高拷贝质粒作为表达载体会给宿主菌带来沉重的生长压力,造成菌体内代谢失衡,这不仅增加菌株生长的延滞期,而且导致菌体最终生长密度远远低于中拷贝质粒和低拷贝质粒[27]。菌株E.coliAI05/pAGI02经长时间保藏和传代后,提取质粒pAGI02并测序发现,重组质粒pAGI02出现部分碱基丢失现象,由此证明基于高拷贝质粒pUC19改造的表达载体,在表达醛糖还原酶基因时具有一定的不稳定性,这可能会影响菌体的生长。因此中拷贝质粒pBR322比高拷贝质粒pUC19更适合用于构建醛糖还原酶基因xylI表达载体,用于菌株发酵产木糖醇。
2.4 IPTG添加对渗漏表达基因菌株发酵产木糖醇的影响
IPTG的添加对渗漏表达基因菌株E.coliAI07/WYZ-2发酵产木糖醇的影响见表3。由表3可知,IPTG添加后木糖醇的含量仅提高0.66g/L,表明IPTG添加对菌株E.coliAI07/WYZ-2发酵产木糖醇含量影响较小,菌株E.coliAI07/pWYZ-2发酵产木糖醇时,可不添加诱导剂IPTG。

表3 IPTG的添加对Escherichia coli AI07/WYZ-2发酵产木糖醇的影响Table 3 Effect of adding IPTG on xylitol production by Escherichia coli AI07/WYZ-2 fermentation
2.5 基因xylA和xylB敲除对菌株发酵产木糖醇含量的影响
基因xylA和xylB敲除对菌株产木糖醇的影响见图6。

图6 基因xylA和xylB敲除对Escherichia coli AI05/pWYZ-2、Escherichia coli AI07/pWYZ-2发酵产木糖醇的影响Fig.6 Effect of genes xylA and xylB knockout on xylitol production by Escherichia coli AI05/pWYZ-2 and Escherichia coli AI07/pWYZ-2 fermentation
由图6可知,发酵96 h时,菌株E.coliAI07/pWYZ-2产木糖醇的含量均显著高于E.coliAI05/pWYZ-2(P<0.01),说明敲除大肠杆菌进入磷酸戊糖途径的两个酶基因xylA和xylB,可以避免大肠杆菌体内其他代谢木糖的途径,有利于提高木糖醇的产量。
2.6 木糖含量对渗漏表达基因菌株发酵产木糖醇的影响
木糖含量对渗漏表达基因菌株发酵产木糖醇的影响见表4。由表4可知,随着木糖初始含量的增加,木糖醇产量呈升高的趋势,但生产强度呈先升高后下降的趋势。当木糖初始含量为80g/L时,木糖醇的生产强度下降至0.451g/(L·h),但木糖醇含量可达48.7 g/L。

表4 木糖含量对菌株Escherichia coli AI07/pWYZ-2发酵产木糖醇的影响Table 4 Effect of xylose concentrations on the xylitol production by Escherichia coli AI07/pWYZ-2
3 结论
本研究采用分子生物学技术成功构建不依赖异丙基-β-D-硫代半乳糖苷(IPTG)诱导产木糖醇的工程菌E.coliAI07/pWYZ-2。当转速为200 r/min时,E.coliAI07/pWYZ-1(启动子为lacP)的木糖醇产量是E.coliAI07/pAGI02(启动子为pflB-p6)的1.8倍;E.coliAI07/pWYZ-2(中拷贝质粒pBR322)发酵产木糖醇含量高于菌株E.coliAI07/pWYZ-1(高拷贝质粒pUC19),分别为19.56 g/L、7.90 g/L;是否添加诱导剂IPTG对E.coliAI07/pWYZ-2产木糖醇差异不大。发酵96 h时,木糖醇产量极显著高于E.coliAI05/pWYZ-2(P<0.01),其在不添加IPTG的条件下,当木糖初始质量浓度为80 g/L,发酵时间为108 h时,木糖醇产量达48.7 g/L。
