伊伐布雷定对心肌肥厚大鼠超极化激活环核苷酸门控非选择性阳离子通道和交感神经的影响*
2021-10-13刘应才
周 瑞,黄 河,刘应才
(西南医科大学附属医院心血管内科,四川泸州 646000)
超极化激活环核苷酸门控非选择性阳离子通道(hyperpolarization activated cyclic nucleotide gated channel,HCN)是编码起搏电流的通道基因,其中包括HCN1~4共4种亚型。目前哺乳动物心脏上4种亚型均有被检测到,其分布具有物种依赖的区域特异性,在正常大鼠心室肌中少量表达HCN2、HCN4[1-2]。一些基础实验表明,HCN表达的变化与心脏疾病的发生有关,例如HCN2-Tg小鼠的HCN2心脏过表达加重了低钾血症的促心律失常事件[3],HCN4变异与房颤有关[4],HCN的变异还可导致心肌疾病的发生等[5-6]。心肌肥厚是各种心血管疾病的代偿结果,常常发生室性心律失常,增加心源性猝死风险,从病理角度上,心室肥厚、心肌纤维化与心律失常发生有关[7]。在分子生物学上,相关研究显示,心肌肥厚时心室肌HCN2、HCN4的表达上调,因此,本课题组猜测HCN表达上调延迟了心室动作电位的复极时间,即QT间期延长导致心室肌兴奋性增强,从而产生心律失常[8-9]。伊伐布雷定是心脏窦房结起搏电流通道的高度选择性和特异性抑制剂,与β受体阻滞剂比较,伊伐布雷定的耐受性更好,不会影响心脏的传导、收缩和复极作用,所以也不会对血压造成明显影响,另外,伊伐布雷定在降低心率的同时并不影响交感神经对心率的控制[10-11]。目前,对心肌肥厚时心肌细胞HCN的变化及伊伐布雷定对交感神经的影响的数据尚不足,故本研究通过构建大鼠心肌肥厚模型,旨在探讨伊伐布雷定对心肌肥厚大鼠HCN及交感神经的影响,现报道如下。
1 材料与方法
1.1 材料
(1)实验动物:雄性SD大鼠18只,无特殊病原体(SPF)级,体重250~300 g,购自西南医科大学动物实验中心。(2)试剂:盐酸伊伐布雷定(上海阿拉丁生化科技股份有限公司),戊巴比妥钠(德国Sigma公司),注射用青霉素钠(山东鲁抗医药股份有限公司),ELISA试剂盒(上海侨杜生物有限公司),荧光定量PCR反应试剂盒(武汉科鹿生物科技有限责任公司)。(3)仪器:病理切片机(上海徕卡仪器有限公司),酶标仪(印度Diatek公司),荧光定量PCR仪(美国Life technologies公司)。
1.2 方法
1.2.1动物模型建立
将18只雄性SD大鼠分为假手术组(Sham组)、模型组和伊伐布雷定组(IVA组),每组各6只。模型组和IVA组术前常规禁食、禁饮12 h。将3%戊巴比妥钠在大鼠下腹部行腹腔注射(0.15 mL/100 g),固定头部和四肢。在剑突下1~2 cm处大小2 cm×3 cm~2 cm×4 cm的区域进行剃毛、聚维酮碘消毒。沿腹白线剪开腹部,暴露腹腔,将小肠轻柔移到腹腔右侧,充分暴露出左肾静脉和下腔静脉,沿左肾静脉和下腔静脉交叉点上方分离腹主动脉。结扎位置选在双肾动脉分叉处以上约0.5 cm处,在此位置平行放置钝化的8号针头,两者用4号手术线扎紧,缓慢退出针头,剪去线头,关闭腹腔,最后再次消毒皮肤。将青霉素用生理盐水配好后,按照剂量为5×104U/只向大鼠腹腔注射,疗程3 d以避免感染。同时提高环境温度,术后24 h只饮水,第2天开始正常饮食。Sham组只挂线标记不结扎,其余操作同另外两组。
1.2.2药物干预
术后12周,IVA组予以盐酸伊伐布雷定(10 mg·kg-1·d-1)灌胃,该剂量参照目前相关研究[12],其余两组予以等体积生理盐水灌胃,共5周。
1.2.3心肌质量指数
实验第17周末,所有大鼠处死前称量体重(body weight,BW),麻醉后迅速打开胸腔,抽取左心室血液约3 mL,室温静置30 min,3 000 r/min离心15 min,将血清标本移入1.5 mL EP管中,放入—80 ℃冰箱保存备用。将心脏分离后立即置入冰磷酸盐缓冲液(PBS)漂洗,轻轻挤压排出室腔内残留血液,然后将非心肌组织剪除,用滤纸吸干后称重即得全心质量(heart weight,HW)。剪取室间隔和左心室游离壁,用滤纸吸干后,称重即得左心室质量(left ventricular weight,LVW)。最后计算全心质量指数=HW/BW,左心室质量指数=LVW/BW。
1.2.4苏木素-伊红(HE)染色
3组大鼠心肌质量指数测定完毕后,剪取心尖部向上约0.5 cm处左心室心肌组织,固定于4%多聚甲醛,经脱水、包埋、切片、HE染色后在显微镜下观察心肌组织病理变化。
1.2.5免疫组织化学法测HCN2和HCN4分布情况
取大鼠室间隔心肌组织经石蜡包埋切片后,用免疫组织化学染色检测HCN2和HCN4的表达分布。
1.2.6Western blot检测HCN2和HCN4蛋白表达水平
取大鼠室间隔心肌组织,用预冷的PBS漂洗2~3次,匀浆,离心后取上清液,使用BCA蛋白质浓度测定试剂盒测定样品蛋白浓度。配制分离胶、浓缩胶,上样后转至聚偏氟乙烯(PVDF)膜并加入封闭液室温封闭1 h。除去封闭液,加入稀释好的一抗4 ℃过夜,回收一抗,用TBST洗3次,每次5 min。加入稀释好的二抗,室温孵育30 min,用TBST在室温下摇床上洗4次,每次5 min。滴加新鲜配制的电化学发光(ECL)混合溶液(A∶B=1∶1)到膜的蛋白面侧,暗室中曝光。用AlphaEaseFC软件处理系统分析目标带的吸光度值。
1.2.7实时荧光定量PCR法检测HCN2和HCN4 mRNA表达
施工项目往往不能像“公司”机构一样长期存在,所以大部分制度只是沿用或者干脆空缺,部分材料验收制度不完善。在材料验收过程中,大部分只是按照约定俗成的“规矩”进行验收,这就造成在发生特殊情况的时候,没有制度依据,缺乏相应的应急机制,管理混乱,降低工作效率。
取大鼠左心室室间隔组织约20 mg,用TRIpure提取总RNA。采用EntiLinkTM1st Strand cDNA Synthesis试剂盒合成第一链cDNA,反应条件37 ℃ 60 min,85 ℃ 5 min。在Life technologies公司的StepOneTMReal-Time PCR仪上完成实时荧光定量PCR,每个样品均作3个复孔,使用EnTurboTMSYBR Green PCR SuperMix试剂盒进行(ELK Biotechnology,EQ001),反应条件为95 ℃预变性3 min,94 ℃变性10 s,退火30 s,72 ℃延伸30 s,40个循环。
1.2.8免疫组织化学法检测交感神经的分布
酪氨酸羟化酶(tyrosine hydroxylase,TH)在交感神经纤维中呈阳性,故本实验通过免疫组织化学法检测TH的表达来分析检测心室肌中交感神经的分布。取大鼠左心室游离壁组织固定于4%多聚甲醛,石蜡包埋,切片,脱蜡,用PBS洗3次。切片置于乙二胺四乙酸(EDTA)缓冲液中微波修复,PBS清洗 3 次,置于3%过氧化氢溶液中,室温下避光孵育10 min。PBS洗3次,甩干后5% BSA封闭20 min。去除BSA液,每张切片加入约50 μL稀释的一抗,4 ℃过夜。PBS洗3次,去除PBS,每张切片加50~100 μL相应种属的二抗,37 ℃孵育50 min。PBS洗3次,去除PBS,每张切片加50~100 μL新鲜配制DAB溶液,显色完全后,蒸馏水或自来水冲洗,苏木素复染,1%盐酸乙醇分化(约1 s),自来水冲洗,氨水返蓝,流水冲洗。切片经过由低到高浓度梯度的乙醇,各10 min,脱水干燥,二甲苯透明,中性树胶封固。镜检。
1.2.9ELISA检测心肌组织去甲肾上腺素(noradrenalin,NA)和肾上腺素(epinephrine,EPI)水平
实验前将实验标本从冰箱取出,室温溶解;提前30 min从冰箱中取出ELISA试剂盒,平衡至室温。按照ELISA试剂盒说明书操作步骤分别检测心肌组织NA和EPI水平。
1.3 统计学处理
2 结 果
2.1 各组心肌质量指数比较
与Sham组比较,模型组、IVA组全心质量指数、左心室质量指数增加,差异有统计学意义(P<0.05),见表1。
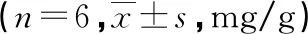
表1 各组心肌质量指数比较
2.2 各组心肌HE染色情况
Sham组心肌细胞规则紧密;模型组心肌细胞变长,细胞核体积增加,排列稀疏、不规则;IVA组心肌细胞排列基本整齐,见图1。

图1 各组心肌HE染色(×400)
2.3 各组HCN2、HCN4蛋白及mRNA表达情况
Sham组心肌细胞少量表达HCN2、HCN4;与Sham组比较,模型组HCN2和HCN4表达明显增加(P<0.05);与模型组比较,IVA组HCN2和HCN4表达减少(P<0.05),见图2~4、表2。

表2 各组HCN2、HCN4蛋白和mRNA的相对表达水平
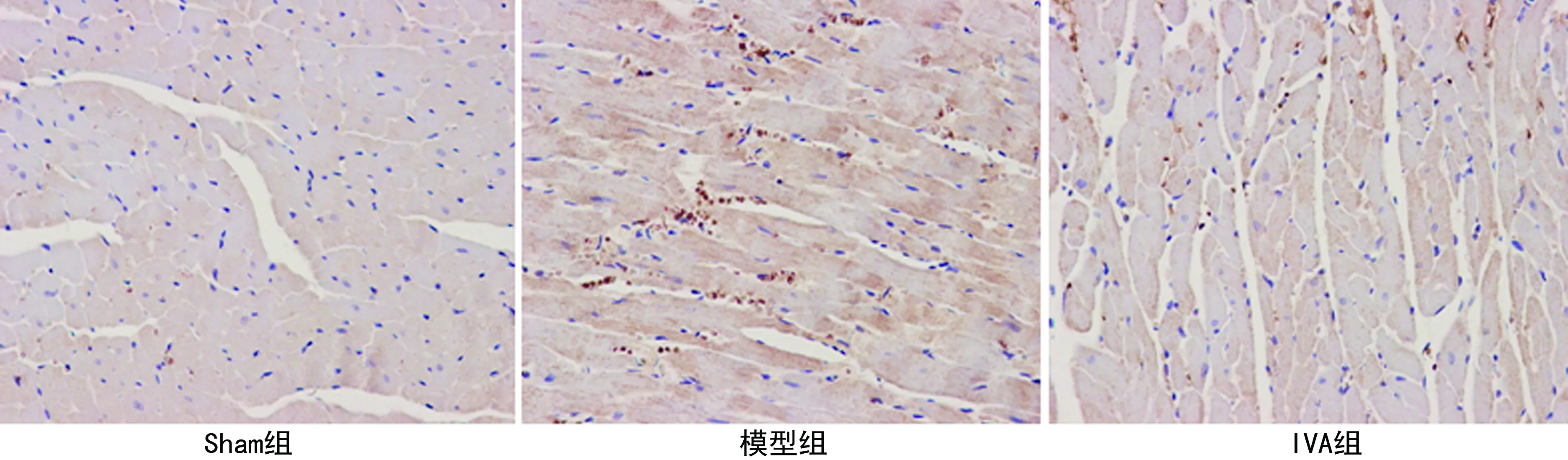
图2 HCN2的免疫组织化学染色(×400)

图3 HCN4的免疫组织化学染色(×400)

图4 Western blot检测HCN2、HCN4蛋白的表达情况
2.4 各组TH分布及NA、EPI表达情况
与Sham组比较,模型组TH分布及NA、EPI表达明显增加(P<0.05);与模型组比较,IVA组TH分布及NA、EPI表达减少(P<0.05),见图5、表3。

图5 TH的免疫组织化学染色(×400)
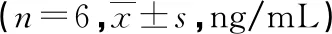
表3 各组NA和EPI的表达水平比较
3 讨 论
正常情况下,HCN在心脏起搏和传导系统外表达很弱,与起搏组织比较,小鼠心室心肌中总HCN转录物的数量要低几倍,但这种心室低表达的通道在心脏疾病期间会发生改变,例如心肌肥厚大鼠心肌细胞的电流密度和发生率增加,且这种增加与心肌肥厚的严重程度直接相关,因此,非起搏组织中“起搏电流”的上调可能改变心室肌的电稳定性,最终可能增加危及生命的心律失常的风险[8]。心肌肥厚是各种心脏疾病的病理改变,早期具有代偿意义,后期出现失代偿进而发展为心力衰竭,在此过程中常伴有交感神经的激活,并进一步促进心室重构及心律失常的发生。伊伐布雷定是HCN的特异性抑制剂,目前临床上只将伊伐布雷定用于慢性心力衰竭、冠心病稳定型心绞痛和一些快速性心律失常的心率控制中[13-14],对其除降低心率以外的心脏保护作用仍在研究中。
本研究通过缩窄大鼠腹主动脉方法成功构建心肌肥厚模型,通过Western blot、实时荧光定量PCR和ELISA技术检测伊伐布雷定对心肌肥厚大鼠心室肌HCN及交感神经的影响,证明了大鼠心肌肥厚时,心室肌细胞HCN2和HCN4表达上调,TH的分布增加、心肌组织的NA和EPI水平也增加,予以伊伐布雷定干预后,HCN2和HCN4表达明显下调,TH的分布减少、心肌组织的NA和EPI水平减少,说明伊伐布雷定可以抑制心肌肥厚大鼠心室肌HCN及交感神经的表达。由于伊伐布雷定作用时间较短,并未改善心肌肥厚,但其减少NA、EPI的表达可能会抑制交感神经对心脏的直接毒性作用。另外,心肌肥厚时HCN表达增加,且在交感活动增强时进一步促进心肌细胞舒张期自动除极,加重引起室性心律失常的发生,故减少HCN及交感神经的表达,有望降低心律失常发生率。区别于β受体阻滞剂对交感神经的作用机制,伊伐布雷定对交感神经的影响可能与其多效性有关,相关研究证明,伊伐布雷定可以减少缺血再灌注损伤时线粒体活性氧的产生,增加三磷酸腺苷的合成,从而减少心肌梗死面积,与比索洛尔比较更能改善冠状动脉血流储备,且还能抑制炎性反应,改善ApoE基因敲除小鼠的内皮功能,减少心肌纤维化,起到保护血管、抗动脉粥样硬化、抗纤维化作用[15-16]。伊伐布雷定还有积极的正性肌力作用[17],可改善缺血再灌注模型猪的心脏功能[18]。而这与伊伐布雷定降低心率作用无相关性。
伊伐布雷定可以抑制心肌肥厚大鼠HCN蛋白、mRNA水平和交感神经的表达,这为伊伐布雷定应用于临床心律失常及改善预后提供了理论依据,但伊伐布雷定作用于交感神经的直接作用仍不清楚,还需进一步研究。
