高产核黄素菌株中代谢途径酶基因表达与核黄素积累的关联分析
2021-10-13杨彬,刘川,张大伟,张春枝
杨 彬, 刘 川, 张 大 伟, 张 春 枝
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.中国科学院 天津工业生物技术研究所, 天津 300308 )
0 引 言
核黄素,又名维生素B2,是一种人体必需的维生素[1]。核黄素应用广泛,可以用作食品添加剂,饲料添加剂以及制作药品,具有广泛的应用前景[2]。核黄素的生产方法有3种,分别为化学合成法、半化学合成法和生物发酵法[3]。由于生物发酵法生产核黄素产量高且成本低,目前已成为核黄素大规模生产的方法[4]。用于核黄素生产的菌株有枯草芽孢杆菌(Bacillussubtilis)、阿舒假囊酵母(Eremotheciumashbyii)以及曾经用于生产的酵母念珠菌(C.famata)[5-7]。枯草芽孢杆菌作为一种安全高效的模式菌株是核黄素生产的主流菌株。
核黄素的代谢通路可以分为3个部分[8]:磷酸戊糖途径合成核黄素前体物质核酮糖-5-磷酸(Ru5P),嘌呤代谢途径合成黄素的另一前体物质鸟苷三磷酸(GTP),核黄素合成途径利用Ru5P与GTP合成核黄素[9]。核黄素的代谢通路已经研究清楚,通过分析高产菌株的核黄素代谢通路变化,可以为从头构建一株高产核黄素菌株提供思路。
本研究通过发酵测定一株高产核黄素的枯草芽孢杆菌SYL-1高产菌株的核黄素产量,使用实时荧光定量PCR系统分析其核黄素代谢通路基因表达量变化,探明这一高产核黄素菌株的核黄素代谢通路的变化,以期为枯草芽孢杆菌高产核黄素提供数据基础和改造思路。
1 材料与方法
1.1 材 料
菌种:高产核黄素菌株SYL-1,具有红霉素抗性基因,实验室保藏;低产核黄素菌株LY-05,实验室构建。
试剂:细菌总RNA提取试剂盒,天根生化科技(北京)有限公司;反转录试剂盒,赛默飞世尔科技公司;实时荧光定量试剂盒,近岸蛋白质科技有限公司;DNA聚合酶,胶回收试剂盒,Omega Bio-tek公司。
1.2 仪 器
ABI 7500 Fast快速实时荧光定量PCR仪;AR124CN精密天平,奥豪斯仪器(上海)有限公司;V-1600型可见分光光度计,上海美谱达仪器有限公司;Centrifuge 5418小型台式离心机,德国Eppendorf有限公司。
1.3 方 法
1.3.1 发酵方案
使用LB培养基进行菌株活化,利用玉米浆发酵培养基进行发酵。采用500 mL摇瓶进行培养,添加培养基80 mL。培养条件:37 ℃、180 r/min,调整发酵初始OD600为0.1,发酵中不补料。培养基组分:2%玉米浆干粉,4%蔗糖,0.05%硫酸镁,1%硫酸铵,1.5%酵母抽提物,0.3%磷酸氢二钾,0.1%磷酸二氢钾,调节pH至7.1。
1.3.2 核黄素产量测定
核黄素产量(g/L)测定根据发酵液经碱处理后在444 nm处吸光度计算。
ρ=A444/0.032 1
1.3.3 RNA提取及反转录
采用细菌总RNA提取试剂盒进行菌株RNA提取,采用反转录试剂盒进行RNA反转录操作,使用试剂盒中提供的随机引物进行反转录PCR。
1.3.4 RT-PCR方法
采用NovoStart©SYBR qPCR SuperMix Plus酶和ABI 7500 Fast实时荧光定量PCR系统进行RT-PCR,采用7500 Software V2.0.5软件进行数据分析。实验使用的内参基因为ATP合成酶基因atpA以及RNA聚合酶亚基基因rpoA。在反应体系中加入ROXII平衡各样品之间的荧光值,反应体系为20 μL,每个基因重复5次,引物见表1。
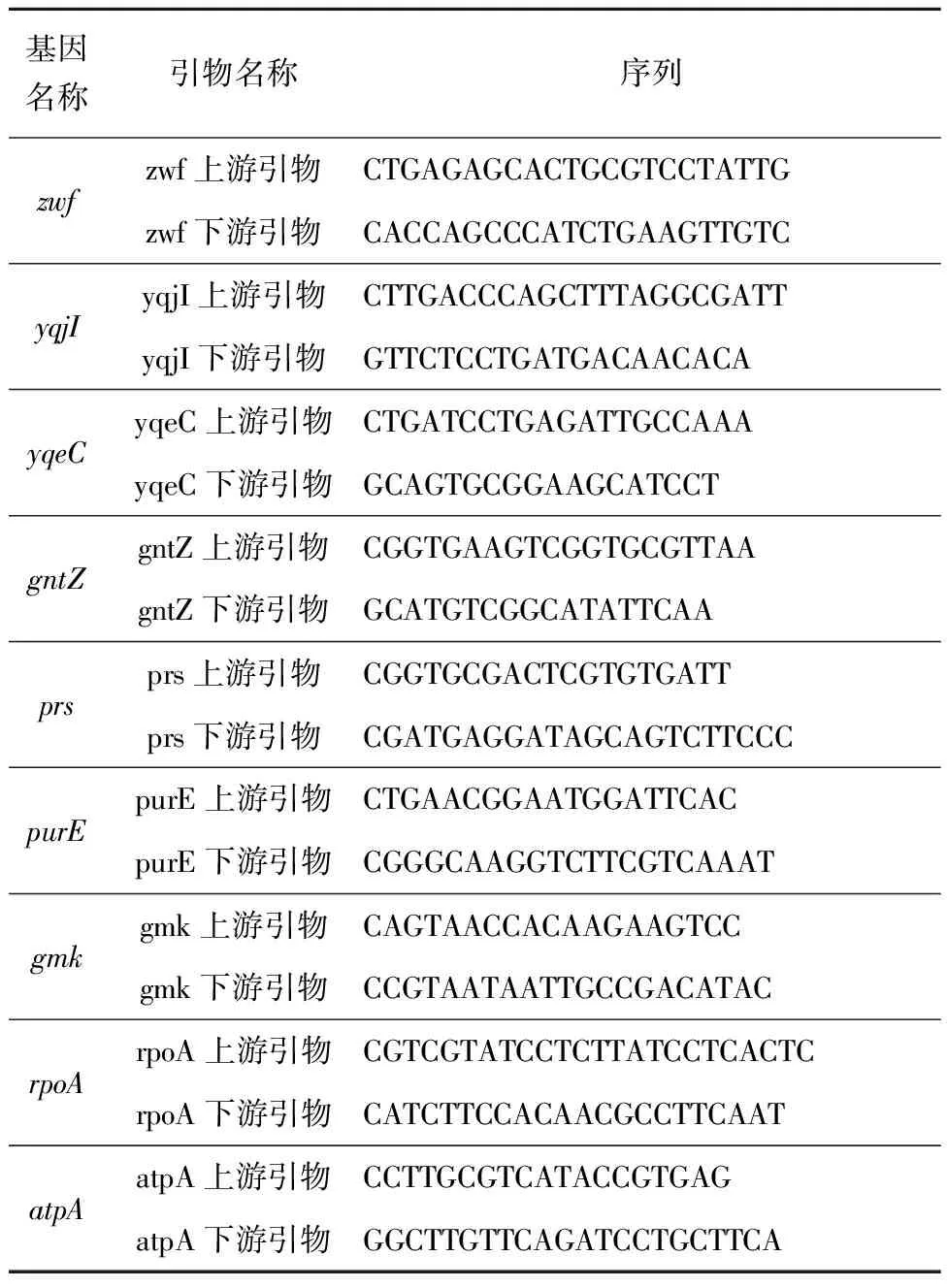
表1 实时荧光定量PCR所需引物Tab.1 Primes of RT-PCR
1.3.5 质粒构建
使用PrimeSTAR©Mix DNA Polymerase进行质粒和目的基因片段进行扩增,胶回收试剂盒进行片段回收,使用ClonExpress©Ⅱ连接试剂盒进行质粒与目的基因的组装,并进行测序,测序工作由金唯智公司完成。组装好的质粒导入DH5α菌株中进行保存和复制,使用细菌质粒小提试剂盒进行提取。
1.3.6 过表达菌株构建
采用spizzen转化的方式在LY-05菌株中导入过表达质粒,采用含有壮观霉素抗性的LB培养基进行筛选,构建的菌株及其携带质粒的基本信息如表2所示。

表2 LY-05中构建的过表达菌株基本信息Tab.2 Basic information of overexpression strainconstructed in LY-05
2 结果与讨论
2.1 核黄素生产能力检测
摇瓶发酵测定SYL-1与LY-05发酵48 h的核黄素产量。SYL-1菌株的核黄素产量在发酵48 h达到1.90 g/L(±0.02 g/L),对照菌株LY-05核黄素产量为320.52 mg/L(±10 mg/L),SYL-1核黄素产量比LY-05高4.9倍。表明SYL-1的核黄素代谢通路较LY-05有明显不同,在细胞中有更多的物质流向核黄素代谢通路。
2.2 代谢通路基因表达量变化
为了探究SYL-1菌株核黄素代谢通路上基因表达量的变化,对其基因gmk、gntZ、prs、purE、yqeC、yqjI、zwf表达量进行分析,如图1所示。将菌株培养至对数生长期,提取总RNA后进行反转录,并利用cDNA进行RT-PCR分析。从图1可以看出,在SYL-1菌株中基因gmk、gntZ、prs、purE、yqeC、yqjI、zwf表达量相较于LY-05有提高,可能通过过表达这些基因或相关基因提高LY-05核黄素产量。
2.3 过表达发酵
在LY-05中使用质粒过表达基因prs、gntZ、zwf以及核黄素操纵子基因ribA发酵结果如图2所示。从图2可以看出,过表达基因prs、gntZ、zwf均可以提高LY-05的核黄素产量,其中过表达基因ribA核黄素产量最高,在发酵48 h达到469.23 mg/L。证明在LY-05中过表达prs、gntZ、zwf基因可以提高核黄素产量。
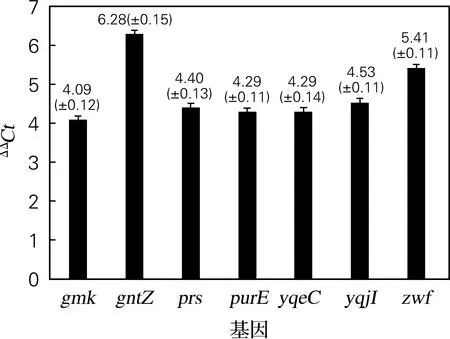
图1 SYL-1菌株相较于LY-05基因表达量的变化Fig.1 Changes in gene expression of SYL-1 comparedwith LY-05
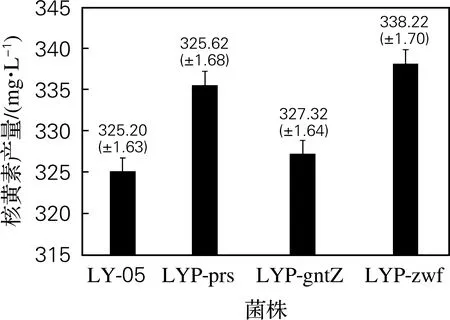
图2 质粒过表达基因核黄素产量Fig.2 Riboflavin production of strain with plasmidoverexpression gene
2.4 代谢通路变化与核黄素产量
对核黄素代谢通路上的基因进行RT-PCR检测,以探索核黄素代谢通路在基因水平上的变化,结果如图3所示。yfkN、prs、tkt以及ywlF基因的表达量提高,证明rpe基因突变会使核黄素代谢通路上的基因表达量发生变化,从而使SYL-1改造菌株的核黄素产量提高。在实验室保藏的构建菌株LY-05中使用pHP13质粒过表达核黄素代谢通路上的基因prs、gntZ、zwf,核黄素产量均有提高,表明在LY-05中提高核黄素代谢通路流量可以提高核黄素产量。
3 结 论
采用摇瓶发酵法测定SYL-1菌株核黄素产量,通过RT-PCR分析其核黄素代谢通路上基因表达量。对比SYL-1与LY-05核黄素代谢通路基因表达量的变化,发现磷酸戊糖途径和嘌呤代谢途径基因表达量提高,SYL-1中核黄素代谢通路流量增加。通过在LY-05中过表达基因prs、gntZ、zwf提高了核黄素产量。

图3 与LY-01相比基因yfkN、prs、tkt、ywlF表达量的变化Fig.3 Changes of gene yfkN, prs, tkt, ywlFexpression compared with LY-01
通过分析高产核黄素菌株的核黄素代谢通路上基因表达量的变化,可以找到有利于代谢改造的基因位点,通过在构建菌种中导入这些位点,可以提高核黄素的产量,为以后核黄素高产菌株构建提供了基础。
