氧化还原反应五规律
2021-10-09侯晨鹞
■侯晨鹞
一、性质强弱规律

具有较强氧化性的氧化剂跟具有较强还原性的还原剂反应,生成具有较弱还原性的还原产物和具有较弱氧化性的氧化产物。氧化性的强弱顺序:氧化剂>氧化产物。还原性的强弱顺序:还原剂>还原产物。
该规律常用于:①判断物质氧化性或还原性的相对强弱;②判断某氧化还原反应能否正常发生。
例1根据反应式:①2Fe3++2I-2Fe2++I2,②Br2+2Fe2+2Br-+2Fe3+,可判断出离子的还原性从强到弱的顺序是( )。
A.Br-、Fe2+、I-B.I-、Fe2+、Br-
C.Br-、I-、Fe2+D.Fe2+、I-、Br-
解析
反应①中还原剂是I-,还原产物是Fe2+,故还原性I->Fe2+;反应②中还原剂是Fe2+,还原产物是Br-,故还原性Fe2+>Br-。综合起来可知还原性I->Fe2+>Br-。
答案:B
二、电子守恒规律
氧化还原反应中得电子总数与失电子总数相等(即电子转移守恒)。表现在氧化还原反应中,氧化剂元素化合价降低总数与还原剂元素化合价升高总数相等。
该规律常用于:①氧化还原反应方程式的配平;②氧化还原反应的相关计算。
例2足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,将这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·L-1NaOH 溶液至Cu2+恰好完全沉淀,则消耗NaOH 溶液的体积是( )。
A.60mL B.45mL
C.30mL D.15mL
解析
由题意可知,Cu 足量则HNO3完全反应,反应中Cu 失去的电子给了 HNO3,生成了还原产物(NO2、N2O4、NO),但最终这些还原产物(NO2、N2O4、NO)又被氧化为HNO3,即相当于Cu失去的电子最终给了O2,且Cu失去的电子数与O2得到的电子数相等。故n(Cu)=2(O2)=2 ×=0.15mol。又根据NaOH 和Cu(NO3)2的反应可得关系式n(NaOH)=2n[Cu(NO3)2]=2n(Cu)=0.3mol,则V(NaOH)==0.06L=60mL。
答案:A
三、价态性质规律
根据元素的价态可以判断物质的氧化性、还原性。例如N 元素:在中只有还原性,在中只有氧化性,在中既有氧化性又有还原性。同种元素具有多种价态时,处于最低价时只有还原性,处于最高价时只有氧化性,处于中间可变价时既有氧化性又有还原性,总结为“高价氧化,低价还,中间价态两边转”。另外注意元素处于最低价时只有还原性,但还原性不一定强,如F-的还原性极弱;元素处于最高价时只有氧化性,但氧化性不一定强,如Na+的氧化性极弱。
该规律常用于判断所给微粒的性质及其在氧化还原反应中所对应的可能产物。
例3下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )。
A.F2、K、HCl B.Cl2、Al、H2
C.NO2、Na、Br2D.O2、SO2、H2O
解析
F 元素没有正价,所以F2只有氧化性,金属元素没有负价,所以金属单质(K、Al)只有还原性;HCl中只有氧化性,只有还原性,所以HCl既有氧化性又有还原性;H2O 中只有氧化性,只有还原性,所以H2O 既有氧化性又有还原性;NO2中和SO2中处于中间价态,既可以得到电子表现氧化性,又可以失去电子表现还原性;H2中、Cl2中和Br2中均处于中间价态,既可以得到电子表现氧化性,又可以失去电子表现还原性。
答案:A
四、价态转化规律
含同种元素不同价态的物质间发生氧化还原反应时,该元素价态的变化基本都遵循“高价+低价→中间价”的规律。这里的中间价可以相同(谓之“靠拢”),也可以不同——但此时必是高价转变成较高中间价,低价转变成较低中间价(谓之“不交叉”),总结为“价态相邻能共存,价态相间能归中;归中价态不交错,低升高降只靠拢”。另外注意同种元素相邻价态间不发生氧化还原反应。
该规律常用于:①判断同种元素不同价态的物质间发生氧化还原反应的可能性;②根据化合价及性质判断某反应体系中的氧化剂、还原剂、氧化产物及还原产物。
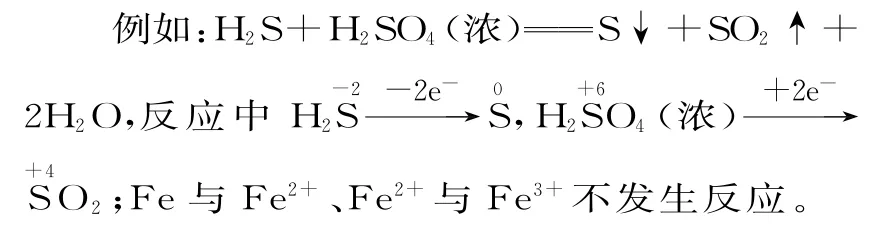
例4下列关于反应HCl+KClO3KCl+Cl2↑+H2O(未配平)的说法正确的是( )。
A.反应中每生成1 molCl2转移电子6mol
B.Cl2是氧化产物,KCl是还原产物
C.氧化剂和还原剂的物质的量之比为1∶5
D.方程式配平的系数分别为5、1、1、3、3
解析
解本题的关键是找准氧化剂和还原剂、氧化产物和还原产物,根据价态转化规律可知KClO3是氧化剂,HCl是还原剂,Cl2既是氧化产物又是还原产物,KCl不是还原产物,B 项错;每生成3molCl2转移电子5mol,A 项错;方程式配平的系数分别为6、1、1、3、3,D 项错。由,根据得失电子守恒可知氧化剂和还原剂的物质的量之比为1∶5,C项正确。
答案:C
五、强先弱后规律
在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它优先与溶液中还原性最强的还原剂作用,如Cl2与FeBr2溶液的反应先考虑Cl2氧化Fe2+,再考虑Cl2氧化Br-;Cl2与FeI2溶液的反应先考虑Cl2氧化I-,再考虑Cl2氧化Fe2+;同理,同时含有几种氧化剂时,若加入还原剂,则它优先与溶液中氧化性最强的氧化剂作用,如在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后依次与Cu2+、H+反应。
该规律常用于判断微粒发生氧化还原反应的先后顺序和判断离子方程式书写的正误。
例5向含有FeBr2、FeI2的溶液中缓缓通入一定量的氯气后,再向溶液中滴加KSCN 溶液,溶液变为红色,若只从反应顺序角度考虑反应情况,则下列叙述不正确的是( )。
A.通入氯气后的溶液中一定不存在I
B.通入氯气之后原溶液中的Fe2+全部被氧化
C.原溶液中的Br-可能被氧化
D.若取少量所得溶液,再加入CCl4溶液充分振荡、静置、分液,下层溶液呈紫红色
解析
溶液中离子的还原性强弱顺序为I->Fe2+>Br-。溶液变为红色说明Fe2+被氧化成Fe3+,则I-全部被氧化,故溶液中一定不存在I-,A 项正确;Fe2+可能全部被氧化,也可能是部分氧化,B项错误;溶液变为红色只能说明Fe2+被氧化成Fe3+,而Br-可能被氧化,C 项正确;根据题意知有I2生成,I2易溶于有机溶剂,则下层溶液呈紫红色,D 项正确。
答案:B
感悟与提高
1.已知SO2、I-、Fe2+、H2O2、Cl-在酸性溶液中均有还原性,且它们的还原性依次减弱,则下列反应不能发生的是( )。
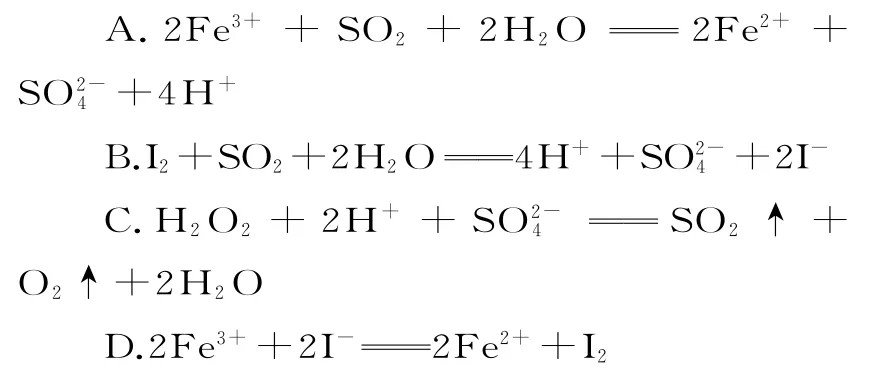
2.硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是( )。
A.1∶3 B.2∶3
C.1∶1 D.4∶3
3.工业废水中的NaNO2可用铝粉除去,已知此体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为____。
4.已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):

这五种化合物中Cl元素化合价由低到高的顺序是( )。
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
5.今有下列三个氧化还原反应:
①2FeCl3+2KI2FeCl2+2KCl+I2
②2FeCl2+Cl22FeCl3
③2KMnO4+16HCl2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而又不除去Fe2+和Cl-,可加入的试剂是( )。
A.Cl2B.KMnO4
C.FeCl3D.HCl
参考答案
1.C 提示:C 项反应中氧元素的化合价升高,硫元素的化合价降低,则H2O2为还原剂,还原性强弱为H2O2>SO2,与已知的还原性强弱不一致,反应不能发生。

3.2 Al+NaNO2+NaOH+2H2O2NaAlO2+NH3·H2O 提示:分析该体系可知,只有Al和N 元素化合价发生变化,金属铝只有还原性,在NH3中只有还原性,且还原性Al>N,而亚硝酸钠具有较强的氧化性,所以发生的反应是亚硝酸钠和金属铝之间的反应,即2Al+NaNO2+NaOH+2H2O2NaAlO2+NH3·H2O。
4.A 提示:由①得出价态Q 高于G,因为G 必介于Q 和-1价的Cl之间,-1价为氯元素的最低价。将该结论引用到③,Y介于Q与G之间,故有价态Q高于Y,价态Y高于G。分析②:H2O中的H化合价降低,则Q 中的氯元素转变为X 中的氯元素,化合价必升高,则得出价态X 高于Q。最后分析④:Z介于Q、X 之间,则价态X 高于Z,价态Z高于Q。
