HPLC法测定太子参药材中多糖水解产物单糖的含量
2021-10-08王慧娟彭礼军
王慧娟 乔 杨 张 敏 彭礼军
1.西南药食两用资源开发利用技术国家地方联合工程研究中心,贵州 贵阳 550025;2.黔西南民族职业技术学院,贵州 兴义 562400
太子参为石竹科植物孩儿参Pseudostellariaheterophylla(Miq.) Pax ex Pax et Hoffm. 的干燥块根,中医临床常用补益药[1]。近年来,人们对太子参化学成分进行了比较系统的研究[2]。研究[3-6]表明,多糖是太子参的重要活性成份,具有抗应激、抗氧化和调节机体免疫的作用,对脂多糖(LPS)诱导的大鼠心肌细胞损伤和大鼠急性心肌梗死诱发的心肺损伤有一定的保护作用。
太子参多糖主要由葡萄糖、半乳糖、木糖、鼠李糖等组成[7]。本研究在此基础上,建立柱前衍生化-HPLC法测定太子参多糖中鼠李糖、葡萄糖、半乳糖和木糖的含量,为太子参药材质控标准的完善提供基础。
1 材料
Agilent 1260高效液相色谱仪(美国安捷伦公司),FA2004型分析天平(上海良平仪器仪表有限公司),GZX-9146MBE数显鼓风干燥箱(上海博迅实业有限公司医疗设备厂),恒温水浴锅(金坛市大地自动化仪器厂)。
太子参药材(贵州百灵制药有限公司);1-苯基-3-甲基-5-吡唑啉酮(PMP)(天津科密欧化学试剂有限公司);葡萄糖(成都植标化纯生物技术有限公司,含量≥98.0%);半乳糖(solarbio公司,含量≥99.0%);鼠李糖(上海源叶生物科技有限公司,含量≥98.0%)、木糖(上海源叶生物科技有限公司,含量≥99.0%);醋酸铵、氯仿、氢氧化钠、甲醇、浓盐酸、三氟乙酸均为分析纯,乙腈为色谱纯。
2 方法与结果
2.1 液相色谱条件优化
2.1.1 混合单糖对照品衍生化供试液制备 对照品溶液的制备:精密称取葡萄糖、木糖、鼠李糖、半乳糖各100mg,加水溶解,定容至100 mL。
取对照品溶液1 mL,依次加入PMP甲醇溶液(0.5 moL·L-1)和NaOH溶液(0.2 moL·L-1)各0.5 mL,混匀,70 ℃水浴100 min,冷却,加入盐酸溶液(0.2 mol·L-1)中和,混匀,三氯甲烷洗涤3次,每次2 mL,取水层,离心后上清液用微孔滤膜过滤,取续滤液,即得。
2.1.2 色谱柱选择 分别采用waters C18(4.6 mm×250 mm,5 μm),Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm)和Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm)三种色谱柱,考察色谱柱对混合对照品衍生化供试液色谱峰的影响。结果表明,Agilent Eclipse XDB-C18色谱柱能对各衍生化组分进行很好地分离。具体如图1所示。

1.waters C18 2.Agilent ZORBAX SB-C18 3.Agilent Eclipse XDB-C18
2.1.3 柱温筛选 采用Agilent Eclipse XDB-C18色谱柱,设定柱温为25 ℃,30 ℃和35 ℃。结果发现,柱温越高,保留时间越短,出峰越快。为节约时间,选取柱温为35 ℃。
2.1.4 流动相考察 采用Agilent Eclipse XDB-C18色谱柱,设定流动相为乙腈-水、乙腈-乙酸铵溶液(0.01 moL·L-1)、乙腈-乙酸铵溶液(0.02 moL·L-1)和乙腈-乙酸铵溶液(0.05 moL·L-1)。结果发现,乙酸铵对峰形及分离度有改善作用,浓度越高,峰形对称性越好,但对设备损伤较大。综合考虑,流动相选取乙腈-乙酸铵溶液(0.02 moL·L-1)。
2.2 太子参多糖水解方法筛选
2.2.1 水解用酸的考察 取6份太子参多糖(自制)各10 mg,加水1.0 mL溶解,分别加入3、5、7 moL·L-1盐酸和1、3、5 moL·L-1三氟乙酸溶液各1.0 mL,混匀,110 ℃水解1 h,放冷,NaOH溶液中和,得太子参多糖水解液。
取上述6份多糖水解液各1.0 mL,照“2.1.1”项下处理后测定,其结果见表1。

表1 多糖酸水解后各单糖衍生物的峰面积
实验表明,不同水解条件下4种单糖峰面积变化趋势并不相同。综合考虑,水解用酸选择3 moL·L-1盐酸溶液。
2.2.3 水解温度考察 取3份太子参多糖各10 mg,加水1.0 mL溶解,分别加入盐酸(3 mol·L-1)1.0 mL,混匀,分别在100 ℃、110 ℃、120 ℃水解1 h,放冷, NaOH溶液中和,得太子参多糖水解液。
取上述多糖水解液各1.0 mL,照“2.1.1”项下处理后测定,根据实验测定结果,水解温度确定为110 ℃,其结果见表2。

表2 不同温度水解多糖后各单糖衍生物的峰面积
2.2.4 水解时间考察 取3份太子参多糖各10 mg,加水1.0 mL溶解,加入盐酸(3 moL·L-1)1.0 mL,混匀,于110 ℃分别水解30,60 和90 min,放冷, NaOH溶液中和,得太子参多糖水解液。
取上述多糖水解液各1.0 mL,照“2.1.1”项下处理后测定,根据实验测定结果,水解时间确定为30 min,具体见表3。

表3 不同水解时间对单糖衍生物峰面积的影响
2.3 衍生化方法的筛选
2.3.1 衍生化温度的筛选 取太子参多糖水解液3份,每份1.0 mL,置10 mL具塞试管中,依次加入PMP甲醇溶液(0.5 moL·L-1)和NaOH溶液(0.2 moL·L-1)各0.5 mL,混匀,分别于40 ℃,70 ℃,95 ℃水浴100 min,处理后进样测定。综合考虑各单糖峰面积,将衍生化温度确定为70 ℃,具体见表4。

表4 衍生化反应温度对单糖峰面积的影响
2.3.2 衍生化时间的筛选 取太子参多糖水解液3份,每份各1.0 mL,依次加入PMP甲醇溶液(0.5 moL·L-1)和NaOH溶液(0.2 moL·L-1)各0.5 mL,混匀,于70 ℃水浴分别加热30,60和100 min,处理后进样测定。根据各单糖峰面积的大小确定衍生化时间为100 min,具体见表5。

表5 衍生化时间对单糖峰面积的影响
2.4 太子参药材中多糖水解产物单糖的含量测定
2.4.1 色谱条件 色谱柱:Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相:乙腈-0.02 moL·L-1的乙酸铵溶液(19∶81);检测波长:250 nm;流速:1.0 mL·min-1;柱温:35℃;进样量:10 μL。
2.4.2 供试品溶液的制备及测定 供试品溶液的制备 精密称取太子参粉末0.2 g,置索氏提取器中,用80 mL乙醇回流提取1 h。过滤,滤渣挥干乙醇后,加水40 mL回流提取4 h,趁热抽滤,再加水30 mL回流提取2 h,抽滤,合并滤液,定容至100 mL。精密吸取1 mL定容至10 mL,作为供试品溶液。
测定法:取太子参供试品溶液1 mL,加盐酸溶液(3.0 moL·L-1)1 mL,混匀,110 ℃水解30 min,放冷,NaOH溶液调pH值至中性。取1 mL,依次加入PMP甲醇溶液(0.5 mol·L-1)和NaOH溶液(0.2 moL·L-1)各0.5 mL,混匀,70 ℃水浴加热100 min,冷却,盐酸溶液(0.2 moL·L-1)中和后定容至5 mL,混匀,三氯甲烷洗涤3次,每次2 mL,取水层,离心后将上清液过滤,取续滤液,测定,即得。
2.4.3 系统适用性试验 分别吸取混合对照品液、供试品溶液进行测定,记录色谱图(见图2)。从图中可见,供试品溶液和对照品溶液中鼠李糖、葡萄糖、半乳糖、木糖的保留时间一致,且供试品溶液中各待测峰的分离度符合要求。

A.混合单糖对照品溶液;B.供试品溶液
2.4.4 线性关系考察 取四种单糖浓度均为1 mg·mL-1的混合单糖对照品溶液,衍生化处理后测定,记录色谱图。以进样量x(μg)为横坐标,峰面积A为纵坐标,计算回归得到四种单糖的标准曲线,见表6。

表6 四种单糖衍生物的标准曲线
2.4.5 精密度试验 取太子参药材(1号)0.2 g,按“2.4.2”项下制备供试液,连续进样6次,测定各单糖的峰面积,结果见表7。RSD均小于2%,表明仪器精密度良好。
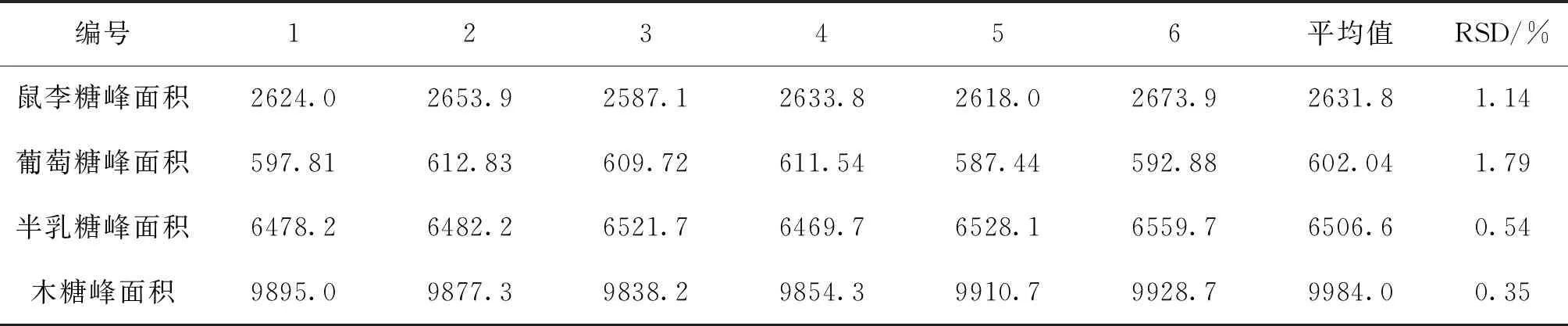
表7 精密度试验结果
2.4.6 重复性试验 取太子参药材(1号)0.2 g,按“2.4.2”项下方法制备供试品溶液6份,分别进样,测定峰面积,结果见表8。

表8 重复性试验
2.4.7 稳定性试验 取太子参药材(1号)0.2 g,按“2.4.2”项下制备供试品溶液,分别于衍生化后0、2、4、8、12、24、48 h进样测定,结果列入表9。RSD均小于2%,说明供试液衍生化后在48 h内稳定性良好。

表9 稳定性试验
2.4.8 加样回收率试验 精密称取6份已测定含量的样品(样品编号1号)各0.1g,置索氏提取器中,加乙醇回流提取1 h,滤渣挥干乙醇,再精密加入适量的鼠李糖、葡萄糖、半乳糖、木糖对照品,按照 “2.4.2”项下处理后测定,计算回收率,结果见表10~13。

表10 加样回收率试验(鼠李糖)
2.4.9 样品测定 取不同产地的太子参药材样品,分别制备供试品溶液后测定,结果见表14。

表11 加样回收率试验(葡萄糖)

表12 加样回收率试验(半乳糖)

表13 加样回收率试验(木糖)

表14 太子参药材中各单糖含量测定结果
结果表明:各批次太子参的单糖含量悬殊不是很大,且皆呈现出同样趋势:其含量木糖﹥半乳糖﹥鼠李糖﹥葡萄糖。各批次药材中木糖和半乳糖含量均在10%以上,葡萄糖含量较低,大多在5%以下。
3 讨论
本文采用柱前衍生化-HPLC法对太子参药材中的鼠李糖、葡萄糖、半乳糖以及木糖进行测定,分别对液相色谱条件、多糖水解和衍生化条件进行了优化,比较了不同条件下单糖衍生物的峰形、分离度、峰面积大小变化等,最终确定了太子参药材中多糖水解产物单糖的含量测定方法。
对所建方法进行方法学验证,结果发现4种单糖标准曲线的线性均较好(回归系数0.9999),精密度、重复性及稳定性试验的RSD均小于3%。在加样回收率试验中,鼠李糖、半乳糖和木糖的平均回收率在95%~105%之间,且RSD﹤3%,符合要求。但葡萄糖的回收率偏低,平均值为86.04%,这可能与太子参药材中葡萄糖含量较低且样品前处理过程比较复杂有关。因此,在后续的太子参质量标准研究工作中,可优先考虑将含量较高的鼠李糖、半乳糖和木糖纳入质控标准。
本文的研究工作,可为今后太子参药材质量标准的补充完善提供研究基础及数据支撑,对太子参的质量控制具有一定的价值和意义。
