北五味子褐斑病内生生防真菌筛选及防治效果研究
2021-10-05张誉荠任跃英文湘穗王雨濛方平李宝全冷世和
张誉荠,任跃英,文湘穗,王雨濛,方平,李宝全,冷世和
(1.吉林农业大学 中药材学院,吉林 长春 130118;2.集安帝王谷北五味子种植专业合作社,吉林 通化 134200;3.白山市嘉和特产有限公司,吉林 白山 134300)
北五味子[Schisandra chinensis(Tuecz.) Baill.]为木兰科多年生落叶木质藤本植物,主产区为东北三省,是东北地区的道地药材[1],其干燥果实入药,具有收敛固涩、益气生津、补肾宁心的功效[2]。北五味子不仅是医药珍品,而且还可加工成保健类食品,具有很高的经济价值。北五味子植株的病害种类较多[3],近年来随着市场需求量的增大,其种植面积日益增加,病害问题也随之增多,对北五味子的生产种植及产品质量产生了严重影响。北五味子褐斑病为叶部病害,其病原菌为球状茎点霉[Phoma glomerate(corad)Wollena ex Hoehapf][4],叶片在发病初期表面出现黄褐色病斑,随着发病时间的增加,病斑面积增大,最终导致叶色发黄,严重时植株死亡。目前,国内外对于北五味子褐斑病的报道较少[5-7],关于北五味子内生真菌对褐斑病生防作用的研究未见报道。鉴于此,以北五味子褐斑病病原菌为供试菌株,北五味子根茎为试验材料,筛选出对其生防效果较好的内生真菌,旨在对北五味子药材种植及其褐斑病防治提供科学理论依据,也为进一步研究北五味子内生真菌生物学功能及药用植物内生真菌资源提供理论基础。
1 材料和方法
1.1 材料
供试植株材料及病原菌菌株:3 年生北五味子植株根茎材料采自吉林农业大学药园内;北五味子褐斑病病原菌Phoma glomerate(corad)Wollena ex Hoehapf 为吉林农业大学药用植物育种实验室保藏菌种。
培养基:马铃薯葡萄糖琼脂(PDA)培养基(马铃 薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL)、查氏培养基[硝酸钠3 g,磷酸氢二钾1 g,硫酸镁(MgSO4·7H2O)0.5 g,氯化钾0.5 g,硫酸亚铁0.1 g,蔗糖30 g,琼脂20 g,蒸馏水1 000 mL]、马铃薯葡萄糖液体(PDB)培养基(马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL)。
试剂及仪器:Biofiux 真菌DNA 提取试剂盒,北京博迈斯生物科技有限公司;PCR 引物、dNTP、TaqDNA 酶,华大基因(武汉)有限公司。DY-6C型电泳仪,北京六一仪器厂;Geneamp 9700型PCR 仪,美国Applied Biosystems 公司;BIS-910 凝胶成像仪,北京东胜生物科技公司;LRH-250 生化培养箱,上海一恒科学仪器有限公司;DM 1000 光学显微镜,德国Leica 公司;HC-2518R 高速冷冻离心机,杭州华创仪器有限公司;KYC-100B空气恒温振荡器,上海新苗器械公司。
1.2 方法
1.2.1 病原菌形态学观察 将病原菌接种到PDA培养基及查氏培养基上,28 ℃恒温培养5 d 后观察其形态,并挑取部分菌丝于10 mL无菌水中,振荡摇匀后吸取适量菌液滴加到载玻片上,于光学显微镜下观察分生孢子及菌丝形态。
1.2.2 内生真菌的分离及纯化 采用组织分离法[8],选取健康无病害的北五味子根茎材料,将其剪成5 cm 长度大小,按照文献[9]的方法进行表面消毒,将表面消毒结束的组织材料在无菌工作台中剪成1~2 mm 的组织块,将其接种于PDA 培养基上,每个培养基接种3 个组织块,设置3 组重复,置于28 ℃恒温培养箱中培养,待培养基中根茎组织块边缘长出菌苔后挑取菌丝进行分离纯化,3~4 次纯化后可得到较纯菌株;另外,设置对照组用以检查组织表面消毒是否彻底,即将最后一次漂洗组织的无菌水均匀涂布于培养基上,观察是否有菌落长出。
1.2.3 内生生防真菌筛选 采用平板对峙法[10-12]对分离出的内生真菌进行生防效果筛选。在无菌工作台中,用直径7 mm 的打孔器将病原菌与内生真菌制成菌饼,并接种至PDA 培养基中,两菌饼间隔2 cm,每株内生真菌设置3 个重复,并设置1 组只接种病原菌的培养基作为对照组,置于25 ℃恒温培养箱中培养5 d 后,用十字交叉法测量对照组病原菌的半径(Rc)和被内生真菌抑制生长的病原菌的趋势半径(Rp),计算拮抗率。
拮抗率=(Rc-Rp)/Rc×100%。
参照周春元等[13]的方法,将初筛生防效果较好(拮抗率60%以上)的内生真菌菌株接种到300 mL PDB 培养基中,于25 ℃、120 r/min 条件下振荡发酵培养,7 d 后于4 ℃、12 000 r/min 条件下离心10 min取上清液,经0.22 μm 无菌滤膜过滤后得到发酵液,将冷却至45 ℃的PDA 培养基与发酵液以2∶1(V∶V)比例混合,配制成含有内生生防真菌发酵液的培养基,将病原菌接种于培养基中,并设置不含发酵液的培养基作为对照,置于25 ℃恒温培养箱中培养5 d 后,用十字交叉法测量含有发酵液的培养基(Rp)及对照培养基(Rc)中病原菌的菌落半径大小,计算拮抗率。
1.2.4 内生生防真菌对北五味子褐斑病的防治机制研究 细胞膜透性测定:用无菌蒸馏水将1.2.3筛选的生防效果最好的菌株发酵液配制成25、50、100、200、300 mL/L 的发酵液溶液,收集恒温振荡培养箱中培养5 d 的褐斑病菌菌丝并清洗干净,分别精确称取1 g 菌丝放入到不同含量发酵液溶液中,测定初始电导率(R1)后将发酵液溶液置于25 ℃恒温振荡培养箱中120 r/min 培养30、60、90、120、150、180 min后测定电导率(R2),然后沸水浴15 min,冷却后测定电导率(R3),计算相对电导率。
相对电导率=(R2-R1)/(R3-R1)×100%[14]。
可溶性蛋白含量测定:分别将5、10、20、40、60 mL 发酵液加入至200 mL PDB 培养基中混匀,制成含发酵液25、50、100、200、300 mL/L 的培养基,用该培养基培养褐斑病菌菌丝并收集。精确称取1 g菌丝,加入石英砂及5 mL磷酸缓冲液,用液氮迅速研磨成浆,4 ℃、8 000 r/min离心10 min后取上清液1 mL,采用考马斯亮蓝常量法在595 nm 处进行吸光度测定,利用标准曲线计算相应的可溶性蛋白含量[14]。
可溶性蛋白含量=(C×V/a)/w。
式中,C为标准曲线对应蛋白质含量;V为提取液总体积;a为所取上清液体积;w为菌丝取样量。
麦角甾醇含量测定:参照可溶性蛋白含量测定方法,配制不同含量WG9 发酵液的培养基,用该培养基培养褐斑病菌菌丝3 d 并收集。称取5 g 菌丝于玻璃培养皿内,放入到80 ℃干燥箱中,将菌丝水分烘干达到恒质量后将其研磨成粉末状,精确称取1 g干粉于锥形瓶中,按照1∶10(m∶V)的比例加入无水乙醇,将其充分混匀后,3 500 r/min 离心10 min,吸取上清液,经0.22 μm 微孔滤膜过滤得滤液。在292 nm 波长处使用分光光度计测定滤液的吸光值,根据标准曲线计算麦角甾醇含量[15]。
几丁质含量测定:参照可溶性蛋白含量测定方法,配制不同含量WG9 发酵液的培养基,用该培养基培养褐斑病菌菌丝1、2、3 d。收集培养的菌丝并冷冻干燥24 h后,加入2%NaOH溶液,90 ℃水浴2 h去除蛋白质,3 500 r/min离心15 min后弃去液体,将剩下的固体物质按顺序用蒸馏水、乙醇和丙酮洗涤,洗涤后将用于洗涤的有机试剂挥发干,剩下的固体物质即为几丁质,称质量并记录[16]。
褐斑病病原菌的微观形态变化:取可溶性蛋白含量测定试验中经不同含量发酵液培养基培养后的菌丝,使用光学显微镜观察微观形态的变化。
1.2.5 内生生防真菌防治效果测定 参照王壮[17]的方法进行离体叶片预防及治疗试验。预防试验:选取健康无病害的五味子离体叶片,用无菌脱脂棉吸适量水包裹在叶柄位置用以保湿,选取叶片表面对称位置处用无菌牙签扎4 个缺口,在缺口处滴加内生生防真菌无菌发酵液50 μL,24 h 后用直径7 mm的打孔器将病原菌制成菌饼并将菌饼扣置于缺口上,另外设置1 组由无菌蒸馏水代替内生生防真菌无菌发酵液的对照,将叶片置于25 ℃光照培养箱中,光照保湿培养3 d 后根据表1 评定病害等级,计算病情指数及防治效果。
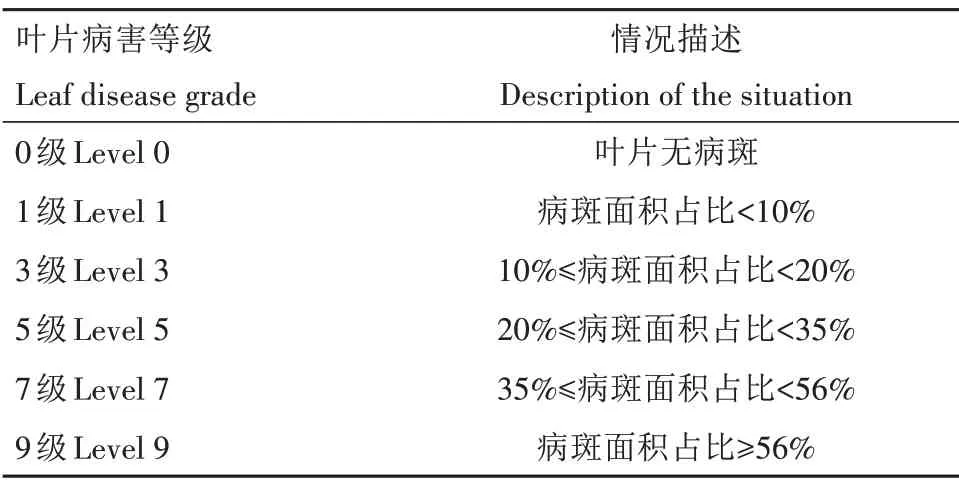
表1 北五味子褐斑病病害等级Tab.1 Disease level of Schisandra chinensis brown spot
治疗试验:选取健康无病害的五味子离体叶片,用无菌脱脂棉吸适量水包裹在叶柄位置用以保湿,选取叶片表面对称位置处用无菌牙签扎4 个缺口,用直径7 mm 的打孔器将病原菌制成菌饼并将菌饼扣置于缺口上,24 h 后在缺口菌饼处滴加内生生防真菌无菌发酵液50 μL,另外设置1组由无菌蒸馏水代替内生生防真菌无菌发酵液的对照,将叶片置于25 ℃光照培养箱中,光照保湿培养3 d 后根据表1评定病害等级,计算病情指数及防治效果。
病情指数=∑(病害等级×本级病害叶片数)/(病害最高等级数×调查总叶片数)×100,
防治效果=(对照组叶片病情指数-处理组叶片病情指数)/对照组叶片病情指数×100%。
1.2.6 内生生防真菌的鉴定 形态学观察:将1.2.3筛选的生防效果最好的内生真菌接种于PDA 培养基中,置于28 ℃恒温培养箱中培养5 d后,观察菌落外观特征,并挑取菌株制成装片,利用光学显微镜观察其菌丝颜色、菌丝形态、孢子形态等微观特征,参照《真菌鉴定手册》[18]对分离出的内生真菌进行初步鉴定。
分子生物学鉴定:内生生防真菌的DNA 提取参照试剂盒说明进行,提取后进行ITS 鉴定,引物序列分别为ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′。扩增采用30 μL体系:1 μL 内生菌DNA模板、17.8 μL ddH2O、3 μL Buffer、2 μL dNTP、3 μL Primer 1(5′-TCCGTAGGTGAACCTGCGG-3′)、3 μL Primer 2(5′-TCCTCCGCTTATTGATATGC-3′)、0.2 μLTaq酶。PCR 反应过程:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,重复35 个循环后72 ℃反应10 min。取3 μL 样品上样,进行1%琼脂糖凝胶电泳(150 V、100 mA、20 min),观察电泳结果。PCR 产物及内生生防真菌的ITS 序列由华大基因(武汉)有限公司进行纯化和测序。将测序结果登 录NCBI网站(http://www.ncbi.nlm.gov),进行BLAST 比对分析,搜索相似性最高的序列,并利用MEGA 6.0软件制作系统发育树,鉴定内生生防真菌。
2 结果与分析
2.1 北五味子褐斑病病原菌形态学观察
如图1A、C 所示,在PDA 培养基上,病原菌菌落呈现黑褐色,周围有一圈白色菌丝,培养5 d 时其菌落直径为63.6 mm;如图1B、D 所示,在查氏培养基上,病原菌菌落外观形态与PDA 培养基上的菌落差异明显,呈现粉白色,培养5 d 时菌落直径为58.2 mm,略小于PDA 培养基上的菌落。病原菌微观形态如图1E所示,其菌丝细长有分枝,尖端弯曲,分生孢子呈无色椭圆形状,无隔膜,选取20 个测量其大小,平均值为3.92 μm×1.43 μm。
2.2 北五味子褐斑病内生生防真菌的筛选
如表2所示,平板对峙试验结果表明,从北五味子根茎中分离得到的16 株内生真菌中,有7 株内生真菌对褐斑病病原菌有较为明显的抑菌作用,将其中1 株生防效果最好(拮抗率为64.73%)的内生生防真菌(图2A)标记为WG9,病原菌与生防真菌WG9 中间有抑菌带,与对照(图2B)相比,其产孢量及菌落半径减少。
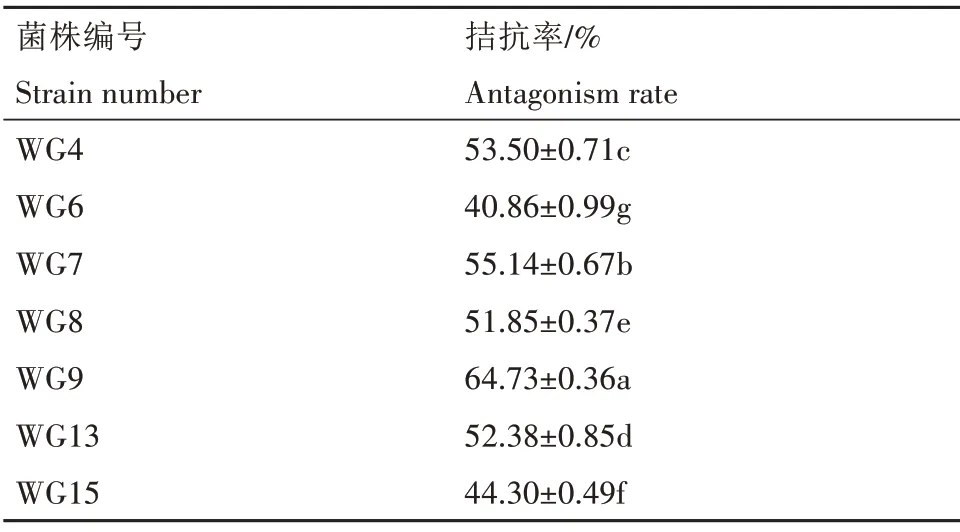
表2 内生真菌对五味子褐斑病病原菌拮抗率Tab.2 Antagonistic rate of endophytic fungus to brown spot pathogen
WG9 的发酵液生防试验如图3 所示,北五味子褐斑病病原菌在含有WG9 发酵液的PDA 培养基上(图3A)生长缓慢,菌落大小明显小于在不含WG9 发酵液的PDA 培养基上生长的病原菌菌落(图3B),测量菌落半径并计算后,其拮抗率为48.21%。
2.3 内生生防真菌WG9对北五味子褐斑病的杀菌机制
由图4 可知,随WG9 发酵液含量增大和培养时间增加,添加褐斑病病原菌的WG9发酵液溶液相对电导率呈升高趋势。培养180 min 时,25、50、100、200、300 mL/L WG9 发酵液溶液的相对电导率均达到最大值,分别为16.51%、22.95%、26.67%、27.19%、29.90%、36.05%,说明WG9 发酵液可使褐斑病病原菌的细胞膜遭到破坏,胞内物质渗出量随WG9 发酵液含量增大而增加,造成相对电导率上升。
可溶性蛋白是生物体内重要的渗透调节物质,对维持其体内水分平衡具有重要意义,在外界环境胁迫下对细胞起到保护作用[19]。由表3 可知,随WG9发酵液含量的增大,褐斑病病原菌的可溶性蛋白含量呈上升趋势,说明病原菌在受到WG9发酵液的刺激下,合成大量可溶性蛋白抵御外界胁迫,且随发酵液含量增大,其合成的可溶性蛋白含量增加。
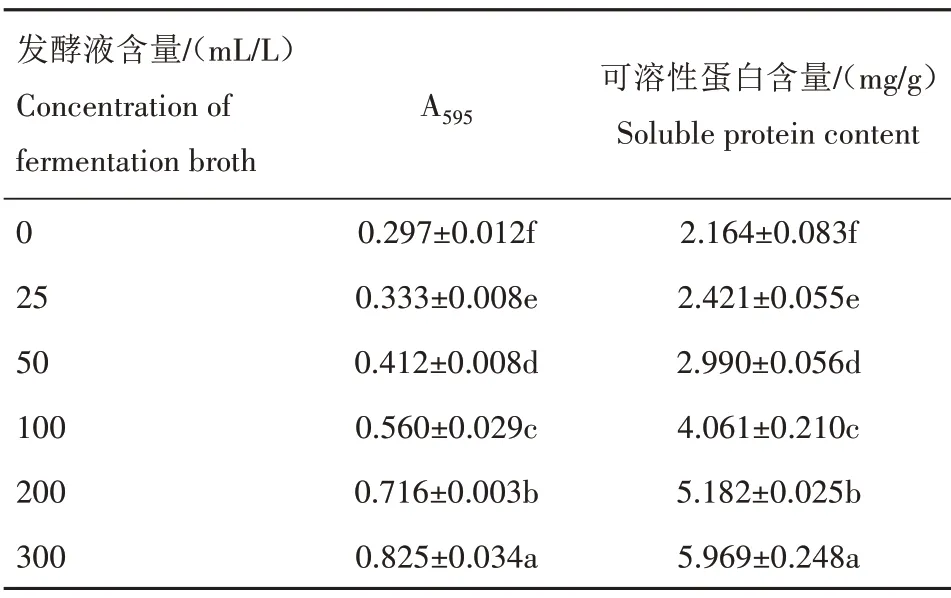
表3 不同含量WG9发酵液溶液培养3 d后褐斑病病原菌可溶性蛋白含量Tab.3 Soluble protein content of brown spot pathogen after 3 d treatment with different concentration of WG9 fermentation broth
麦角甾醇又称麦角固醇,是真菌微生物细胞膜的重要组成部分,对细胞膜的流动性、细胞膜结构的完整性、膜上酶活性及细胞活力等细胞生理功能具有重要作用[20]。由表4 可知,随WG9 发酵液含量的增大,褐斑病病原菌的麦角甾醇含量呈减少趋势,发酵液含量从0 mL/L 增大至300 mL/L,褐斑病病原菌麦角甾醇含量从8.356 mg/g 降至5.869 mg/g,表明WG9 发酵液可使褐斑病病原菌细胞膜麦角甾醇含量降低,从而致使其细胞膜生理功能受损。
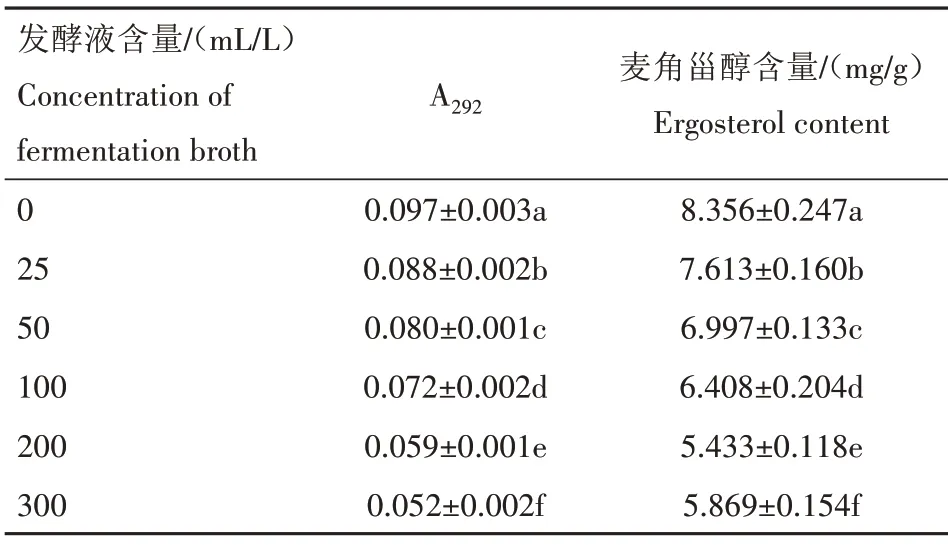
表4 不同含量WG9发酵液溶液处理3 d后褐斑病病原菌麦角甾醇含量Tab.4 Ergosterol content of brown spot pathogen after 3 d treatment with different concentration of WG9 fermentation broth
几丁质是真菌细胞的重要组成部分,位于真菌细胞壁的内层,对维持其基本结构和生理功能起着非常重要作用,几丁质占真菌干质量的比例很高,在某些菌株中可达45%[21-22]。由图5 可知,随WG9发酵液含量的增大,褐斑病病原菌的几丁质含量呈减少趋势,并且培养时间越久,几丁质含量越低,当发酵液含量为300 mL/L 时,培养1、2、3 d 的几丁质含量均降至最低值,分别从0.283 g/g降至0.250 g/g,0.269 g/g 降至0.246 g/g,0.264 g/g 降至0.238 g/g。表明WG9 发酵液可使褐斑病病原菌细胞膜的几丁质含量降低,推测发酵液中某些物质可催化病原菌细胞壁几丁质的水解,抑制真菌菌丝生长。
如图6 所示,正常的病原菌(A)菌丝完整,细胞壁较厚,菌丝内部无横隔;用300 mL/L 发酵液溶液培养3 d 后的病原菌(B)菌丝内部有横隔出现,与正常病原菌菌丝相比,细胞壁变薄呈透明状,且不光滑。
2.4 内生生防真菌WG9的防治效果测定
内生生防真菌WG9 对离体叶片北五味子褐斑病的预防试验如图7 所示,经过预防处理的叶片病斑面积明显小于无菌水处理对照,其防治效果为63.28%;内生生防真菌WG9 对离体叶片北五味子褐斑病的治疗试验如图8 所示,经过治疗处理的叶片病斑面积明显也小于无菌水处理对照的叶片,其防治效果为55.49%。
2.5 内生生防真菌WG9的鉴定
2.5.1 形态学观察 分离出的优良内生生防真菌WG9 其外观形态及微观形态如图9 所示,培养5 d后菌落为直径50.2 mm 的椭圆形,呈粉紫色,菌落外圈有少量的白色菌丝,分生孢子较多,不易形成单菌落。在微观形态下观察,其菌丝无色,较细,菌丝 顶端有指状分枝;孢子无色,较小,呈圆形。
2.5.2 分子生物学鉴定 通过对内生生防真菌WG9 的ITS 序列分析,其序列长度为585 bp,在NCBI 中进行BLAST 比对,从中选择了10 株ITS 相似度较高的菌株进行比较,发现内生生防真菌WG9与 NCBI 登录号 MT 420635.1(Purpureocillium lilacinum)、MT 279298.1(Purpureocillium lilacinum)、KC 478538.1(Purpureocillium lilacinum)的序列相似性为99%,基于Neighbour-joining 算法(Bootstrap 值为500)构建的系统进化树如图10所示,内生生防真菌WG9 与NCBI 登录号MT 420635.1、MT 279298.1、KC 478538.1 处于同一分支上,结合形态学观察,将其鉴定为淡紫拟青霉(Purpureocillium lilacinum)。
3 结论与讨论
目前,国内外对于北五味子病害的研究报道较少,北五味子褐斑病于2012年才第一次被报道[4],与北五味子其他病害相比,属于一种新发现的病害,故对于该病害没有较为完整的研究。该病原菌喜光照,并且温度较高时有利于其生长及产孢,病原菌孢子萌发的最低相对湿度为90%,在相对湿度为100%的条件下经4 h 就可以萌发[5],因此该病害在降雨量较大、光照充足的夏季发病较为严重。北五味子作为东北地区的道地药材,给当地种植农户带来了可观的经济收益,但随着种植面积的增大,其病害问题也日趋加重,有关该病的流行规律和防治技术还需进一步研究。
本研究从北五味子根茎中分离出的1株优良生防真菌WG9为淡紫拟青霉,该菌种首次从北五味子植株中被分离出来[23-24]。淡紫拟青霉在防治植物线虫方面有着不可取代的地位,SASSER[25]研究发现,淡紫拟青霉可应用在30 多种寄主植物上并且防治线虫成功率达68.0%,同时淡紫拟青霉对玉米小斑病菌、小麦赤星病菌、棉花枯萎病菌、水稻恶苗病菌等植物病原菌也具有显著的拮抗作用。GESELL等[26]在早期的试验中发现,淡紫拟青霉菌可以高效转化杀菌剂联苯,并且可以与其他杀菌剂混合使用同时不影响自身效果。目前,国内外对于淡紫拟青霉的研究主要集中于防治线虫,对于其在植物病害方面的研究报道较少[27],本研究发现,淡紫拟青霉WG9对北五味子褐斑病菌具有较强的拮抗作用,在对WG9发酵液的抑菌机制研究时发现,该发酵液对病原菌的可溶性蛋白、麦角甾醇、几丁质含量及细胞膜透性都有一定的影响,并且通过显微镜观察到经过发酵液处理的菌丝形态发生了一定的变化。几丁质作为真菌细胞壁的重要组成部分,参与了其外骨架结构的构建,在维持细胞形态及帮助细胞抵抗外界胁迫过程中发挥重要作用[28],同时也在真菌生长发育、入侵新生态域、启动宿主免疫反应中起重要作用[29],故许多抗真菌药物的开发都以几丁质作为理想靶标[30]。本研究发现,随着WG9 发酵液含量的上升,病原菌菌丝的细胞膜透性和可溶性蛋白含量升高,麦角甾醇和几丁质含量降低,说明WG9发酵液对病原菌的细胞壁有一定的损伤作用,但发酵液损伤细胞壁的作用机制是否是通过抑制几丁质的合成来实现的,还有待深入研究。
长期使用传统化学农药会使植物病原菌产生耐药性,故可将WG9开发成防治植物病原菌的生防制剂,而且淡紫拟青霉的生长对于营养条件要求很低,在农副产品的废料、废渣中都能够生长[31],所以其制剂成本很低,可工业化量产,但是植株类型、土壤理化性质以及土壤微生态等外界因素会使其生防效果受到影响,故后期还应对其生防效应进行大田试验研究。
