苦木主要生物碱成分的分离及肠道微生物的转化研究
2021-09-28陈封政孙国峰李书华
陈封政,龙 洁,孙国峰,田 冲,李书华※
(1.乐山师范学院 a.化学与资源环境学院 b.乐山特色农产品药用成分研发工程中心,四川 乐山 614000;2.固态发酵资源利用四川省重点实验室,四川 宜宾 644000)
0 引言
苦木Picrasmaquassioides(D.Don)Benn.为苦木科苦木属植物苦木的干燥枝和叶,是我国民间的常用中草药,具有消炎、抗菌、解毒等功效[1],其主要功效成分为三萜、生物碱和苦木内酯等[2]。苦木是消炎利胆片的主要原料药材,单方药苦木注射液收载于《中华人民共和国卫生部药品标准》,主治感冒、上呼吸道感染、肠炎和细菌性痢疾等[3]。目前,研究人员已经从苦木中分离鉴定出18个生物碱成分[4],其主要成分为苦木酮(4-甲氧基-5-羟基铁屎米酮)[5-6],含量约为干药材的千分之三[7-8],该生物碱具有抗炎和治疗肠炎的作用[9-10],与药材的主治功能一致,是该药材的特征成分,但是尚无苦木酮在体外或体内的代谢研究。药物在肠道菌群的作用下发生生物转化,直接对药物在体内的生物利用度以及药物对疾病的治疗产生重要影响[11-12]。为了研究苦木特征成分在胃肠道内的变化,我们对苦木的生物碱成分进行了分离鉴定,对药材中主要特征生物碱成分的含量进行了测定,并研究了特征成分在仿生胃液、肠液中的稳定性与变化情况,为药材苦木的深入研发奠定基础。
1 材料与仪器
1.1 材料
苦木(Picrasmaquassioides(D.Don)Benn.),购买于安徽亳州中药材市场,经乐山师范学院成英副教授鉴定为苦木科植物苦木的干燥枝和叶,标本保存于乐山师范学院乐山特色农产品药用成分研发工程中心(20170901)。
1.2 仪器
旋转蒸发仪(上海亚荣生化仪器厂,RE-2000A),高速多功能粉碎机(上海塞耐机械有限公司,JY-1000A),循环水式真空泵(巩义市予华仪器有限公司,SHZ-D(Ⅲ)),电子天平(上海越平科学仪器有限公司,FA2004),烘箱(上海朗轩实验设备有限公司),核磁共振谱仪(Bruker,AV 400)。
2 方法与结果
2.1 苦木生物碱成分的提取
称取苦木药材10 kg,粉碎,置于塑料桶中,加入95%乙醇,室温浸泡4天,过滤,得到第一次浸泡液;再次将药渣用95%乙醇室温浸泡4天,过滤除去残渣,合并两次滤液,减压浓缩,回收乙醇溶液,得到苦木的乙醇流动状浸膏。
将上述浸膏用2 L pH 1~2的盐酸水充分分散,过滤,得到酸水溶液,用浓氨水将酸水的pH调至9~10,然后用等体积的乙酸乙酯萃取4次,合并4次乙酸乙酯萃取液,减压浓缩,得到17 g总生物碱。
2.2 苦木生物碱成分的分离
用总生物碱17 g,拌样上样。以二氯甲烷∶甲醇(30∶1,20∶1,10∶1,5∶1,v/v)为洗脱剂,每个梯度洗脱液为柱体积的两倍,以50 mL为一个收集流份,共收集得到23个组分。以薄层层析为检测依据,将斑点清晰具有相同Rf值的合并为一组。其中1-8组分合并成一瓶,9-14组分合并成一瓶,15-23组分合并成一瓶。将1-8组分再次进行硅胶柱层析,以二氯甲烷∶甲醇(50∶1,40∶1,30∶1,25∶1,20∶1,甲醇v/v)为洗脱液,西林瓶收集,以薄层层析为检测依据,合并相同组分,浓缩后丙酮重结晶,得到化合物1。
2.3 苦木生物碱成分的鉴定
化合物1:黄色针状结晶,易溶于氯仿,mp.(224-225)℃。1H NMR(400MHz,CDCl3)δ:8.09(1H,d,J=8Hz),8.87(1H,d,J=4.0Hz),8.57(1H,d,J=8.0Hz),8.09(1H,d,J=8.0Hz),7.71(1H,td,J=8.0,8.0 Hz),7.54(1H,td,J=4.0,8.0 Hz),4.49(3H,s,C4-OCH3);13C NMR(100MHz,CDCl3)δ:116.77(C-1),114.68(C-2),145.96(C-4),142.74(C-5),158.08(C-6),116.77(C-8),130.75(C-9),125.82(C-10),122.77(C-11),125.52(C-12),138.75(C-13),130.28(C-14),126.07(C-15),138.75(C-16),61.07(C4-OCH3)。该化合物的核磁数据与文献[13]报道的苦木酮(4-甲氧基-5-羟基铁屎米酮)一致,故该化合物被鉴定为苦木酮(4-甲氧基-5-羟基铁屎米酮),其结构如图1。

图1 苦木酮结构Fig.1 Structure of 4-methoxy-5-hydroxycanthin-6-dione
2.4 苦木主要生物碱成分的含量测定
2015版《中国药典》在苦木药材的质量控制方面仅有理化鉴别、显微鉴别和薄层鉴别,且薄层鉴别中没有特征成分的鉴别,仅仅要求与对照药材显相同斑点,缺乏特征成分的含量测定,难以有效地控制药材质量。我们以自制的苦木酮为对照品,对药材中的特征生物碱进行了含量测定。色谱条件:Innoval ODS-2(4.6 mm×250 mm,5 μm);流动相:乙腈(B)-0.1%磷酸水溶液(A),0-10 min 10% B - 33% B,10 min-20 min 33% B-40% B,20 min-25 min 40% B-10% B;紫外检测波长:254 nm;流速:1.0 mL/min;进样量:20 μL;柱温:25 ℃。在此色谱条件下,得到苦木酮和苦木乙醇提物的色谱图(见图2)。
配制浓度为8 μg·mL-1、16 μg·mL-1、32 μg·mL-1、48 μg·mL-1、64 μg·mL-1、80 μg·mL-1的苦木酮对照品溶液。在上述色谱条件下,进样20 μL,测定峰面积值,以对照品峰面积值以及进样浓度X(μg·mL-1)制作线性曲线,结果在浓度范围(8~80)μg·mL-1内,苦木酮回归方程为:Y=6.190×104X+7.831×104,R2=0.9994。
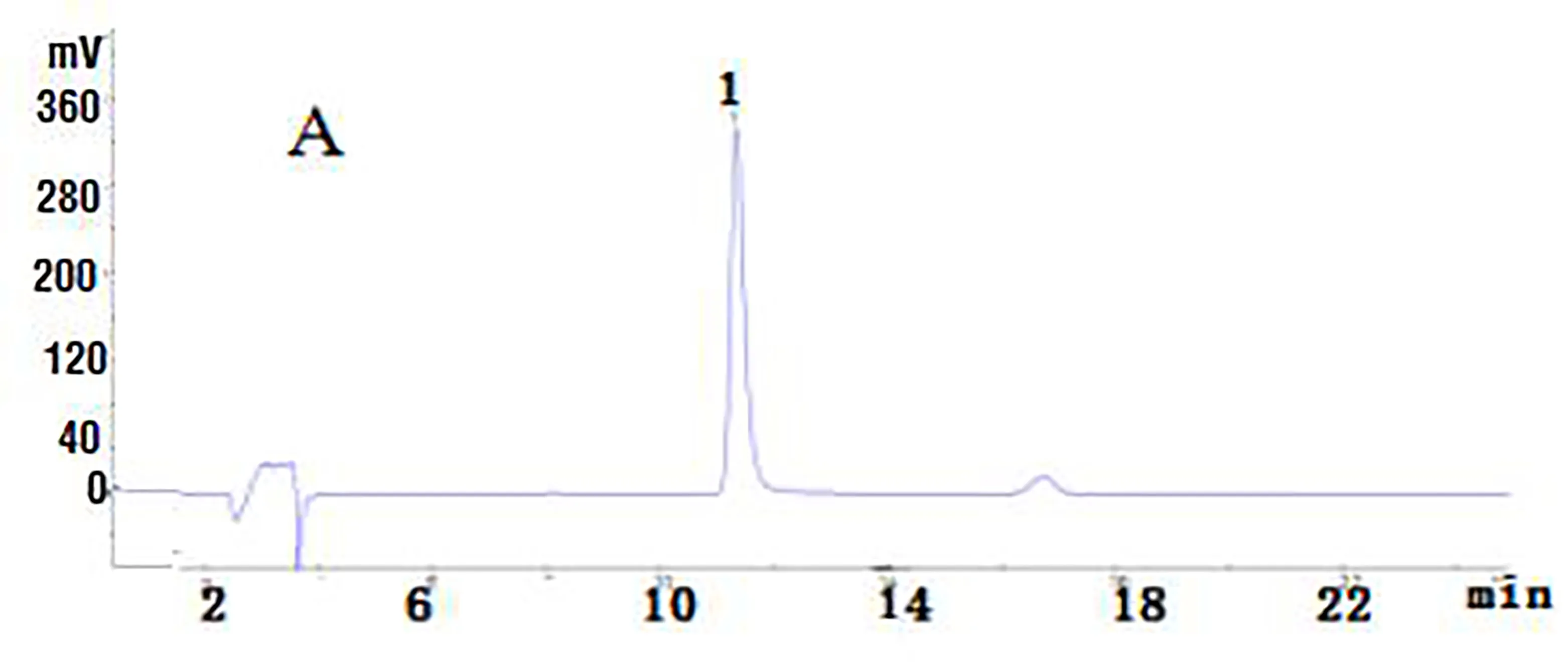
图2 苦木酮(A)和苦木乙醇提物(B)的HPLC色谱
从图2可以看出:苦木乙醇提取物的液相色谱图中苦木酮的峰高及峰面积均是最大的,苦木酮是苦木的主要成分。我们测定了三批相同产地不同批次苦木的苦木酮,结果如表1。从表1我们可以看出,本次试验所用三批药材中苦木酮的含量约为万分之七,为吴冲[7]等研究报道苦木中苦木酮含量的20%左右。
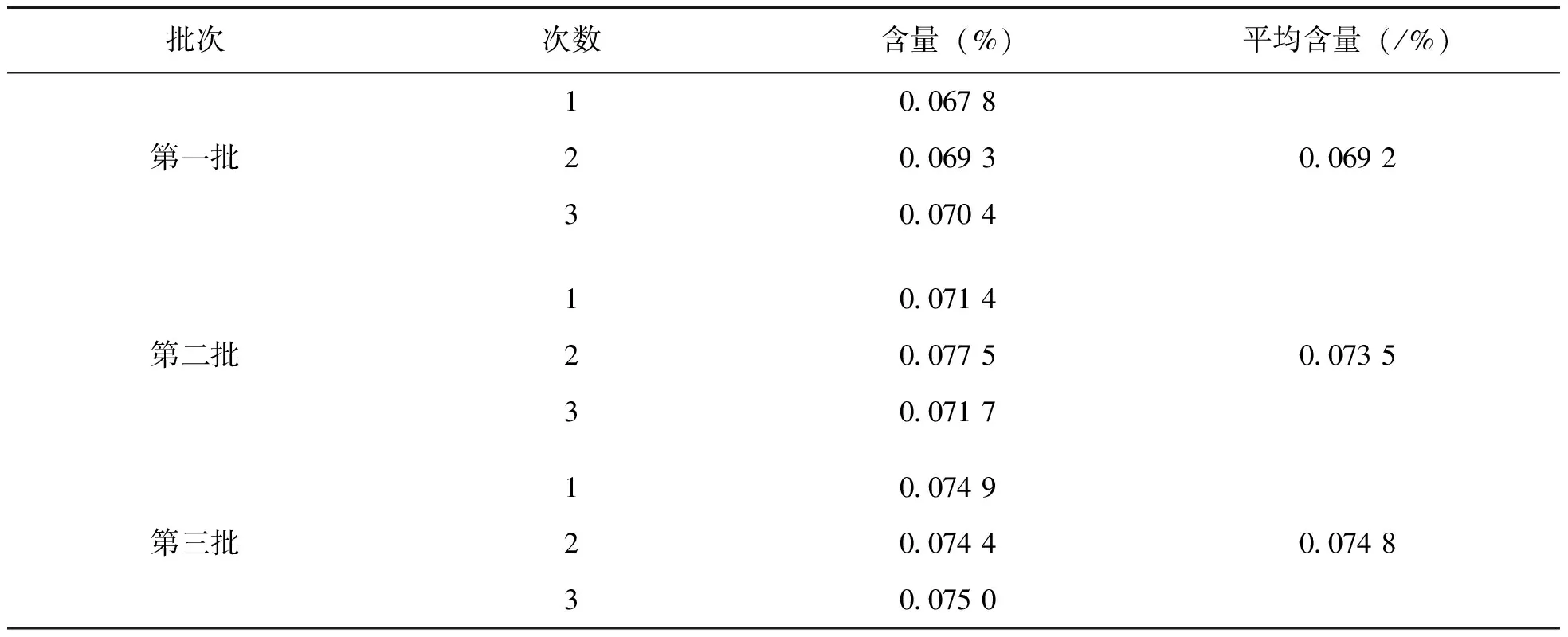
表1 苦木中苦木酮的含量测定
2.5 苦木主要生物碱成分的人源肠内菌的转化研究
2.5.1 仿生人工胃液中稳定性研究
参照文献[14]配置人工胃液:0.1 M稀盐酸16.4 mL,加水约800 mL与胃蛋白酶10 g,摇匀后,加水衡释至1000 mL,即可。将苦木酮置于人工胃液中于37 ℃的环境中震荡温孵。按照2.4中的色谱条件分析,苦木酮在4 h内,在人工胃液中稳定。
2.5.2 人源肠内菌的转化研究
参照文献[14-15]配置厌氧培养液:L-半胱氨酸0.5 g,2 mL 25% L-抗坏血酸,牛肉膏1 g,蛋白胨1 g,营养琼脂1 g,37.5 mL A液(0.78% K2HPO4),37.5 mL B液 [0.47% KH2PO4,1.2% (NH4)2SO4,1.8% NaCl,0.12% CaCl2,0.25% MgSO4],50 mL 8% Na2CO3,加纯化水至1 L,稀盐酸调节pH至7.5~8.0。
肠内菌培养液的制备:按健康青年的新鲜粪便与灭菌生理盐水1∶4 (g:m L)混合均匀,用无菌4层纱布过滤,再与厌氧培养液按照1∶9的比例混合,得到肠菌培养液。
以10 mL空白肠内菌培养液为空白对照(标记为A),10 mL厌氧培养液加苦木酮为阴性对照(标记为B),以10 mL肠内菌培养液加入苦木酮(体系中苦木酮质量浓度为12.5 μg/mL)为肠内菌转化组(标记为C)。
将上述样品置于37 ℃的厌氧培养箱中振荡培养。分别于培养0 h,24 h,48 h和72 h时取样,乙酸乙酯萃取后进行HPLC分析,分别得到0 h,24 h,48 h和72 h的液相分析图,见图3、图4、图5和图6。

注:A为空白对照 ;B为阴性对照; C为转化组; 1为苦木酮。图3 苦木酮0 h人源肠内菌的转化HPLCFig.3 HPLC of 4-methoxy-5-hydroxycanthin-6- dion Biotransformation by Human Intestinal Flora in 0 h
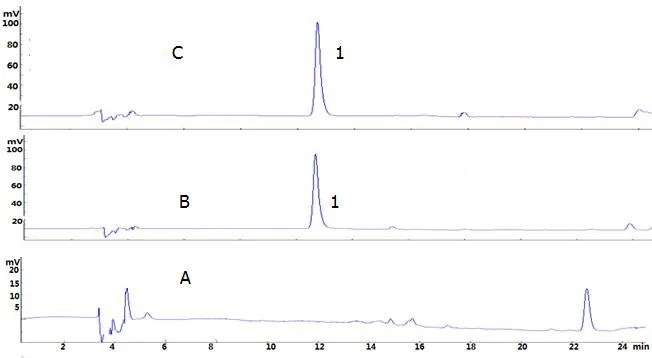
注:A为空白对照 ;B为阴性对照; C为转化组; 1为苦木酮。图4 苦木酮24 h人源肠内菌的转化的HPLCFig.4 HPLC of 4-methoxy-5-hydroxycanthin-6- dion Biotransformation by Human Intestinal Flora in 24 h

注:A为 空白对照 ;B为阴性对照; C为转化组; 1为苦木酮,2为转化产物图5 苦木酮48h人源肠内菌的转化的HPLC Fig.5 HPLC of 4-methoxy-5-hydroxycanthin-6- dion Biotransformation by Human Intestinal Flora in 48 h
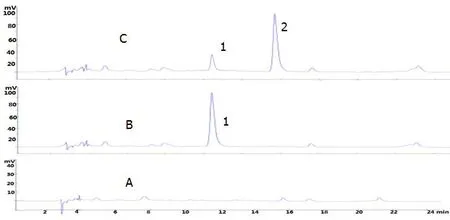
注:A为 空白对照 ;B为阴性对照; C为转化组; 1为苦木酮,2为转化产物。图6 苦木酮72 h人源肠内菌的转化的HPLCFig.6 HPLC of 4-methoxy-5-hydroxycanthin-6- dion Biotransformation by Human Intestinal Flora in 72 h
2.5.3 苦木酮的人源肠内菌的转化放大试验
配置肠菌培养液1 L,按上述操作方法加入50 mg 苦木酮,混匀。置于37 ℃厌氧培养箱中振荡培养,72 h后,取出加等体积乙酸乙酯萃取2次,减压浓缩乙酸乙酯,得到转化产物。
将转化产物通过硅胶柱层析分离纯化,得到转化产物的纯品,即化合物2。
化合物2:黄色针状结晶,易溶于氯仿,mp(145-146)℃。将化合物2的与化合物1的核磁谱图仔细比较,发现多了一个甲氧基信号(δH4.07,δC61.17),故猜测化合物2是化合物1的5位的羟基变成甲氧基。1H NMR(400MHz,CDCl3)δ:8.04(1H,d,J=4.0 Hz),8.78(1H,d,J=4.0Hz),8.57(1H,d,J=8.0 Hz),7.72(1H,td,J=8.0,8.0 Hz),7.54(1H,td,J=8.0,8.0 Hz),8.15(1H,d,J=8.0Hz),4.45(3H,s,C4-OCH3),4.07(3H,s,C5-OCH3);13C NMR(100MHz,CDCl3)δ:116.13(C-1),145.19(C-2),140.22(C-4),139.18(C-5),158.71(C-6),116.72(C-8),130.72(C-9),125.64(C-10),122.88(C-11),124.75(C-12),133.02(C-13),128.44(C-14),125.64(C-15),130.98(C-16),61.15(C4-OCH3),61.17(C5-OCH3)。该化合物的核磁数据与文献[13]报道的苦木碱丁(4,5-二甲氧基铁屎米酮)一致,故该化合物鉴定为苦木碱丁(4,5-二甲氧基铁屎米酮),其结构及变化如图7。

图7 苦木酮在人源肠内菌作用下转化成苦木碱丁Fig.7 4-methoxy-5-hydroxycanthin-6-dione was Transformed into 4,5-dimethoxycanthin-6-one by Human Intestinal Flora
3 讨论与结论
a)通过苦木乙醇提取物的HPLC色谱图发现苦木酮是苦木的主要生物碱成分,是苦木的主要特征成分之一。
b)通过研究表明苦木酮在人工胃液中稳定,表明口服含苦木的制剂,苦木酮大部分以原型的形式进入肠道。苦木酮在人体肠道微生物及微生物分泌的酶的作用下发生变化,由于微生物酶的作用,苦木酮上的羟基变成甲氧基,转化成极性较低的苦木碱丁,增强了化合物的脂溶性,有利于药物分子透过肠系膜进而被吸收,增大了药物的生物利用度。
c)刘军峰[16]等研究表明苦木酮和苦木碱丁对磷酸二酯酶4有抑制活性,但苦木碱丁表现出更强的抑制作用;同时苦木碱丁相对于苦木酮而言,对肺炎球菌的抑菌更显著[2]。由此可见,苦木酮在人体肠道微生物及微生物分泌的酶的作用下药效增强了。
