人脐血间充质干细胞(hUCMSCs)复合PHAs生物材料诱导软骨再生的研究
2021-09-27张翠何珊周林
张翠 何珊 周林

[摘要]目的:研究人臍血间充质干细胞(Human umbilical cord mesenchymal stem cells,hUCMSCs)经基因诱导成软骨后复合支架材料,构建组织工程软骨,探究软骨再生过程中,移植物在宿主体内的营养代谢及宿主免疫反应。方法:从人脐带血中分离、扩增、培养人脐血间充质干细胞并鉴定;在倒置相差显微镜观察细胞的形态,成软骨诱导后复合支架载体,体外共培养1周,植入SD大鼠体内,分时段取材(7d,14d,28d)后,进行大体形态学观察,组织化学染色、软骨特异性基质成分蛋白多糖及Ⅱ型胶原纤维的表达变化检测;对照组SD大鼠移植同种异体胸骨剑突软骨;空白对照组SD大鼠不做任何处理。结果:HE染色结果显示:实验组和对照组炎症反应未见明显差异。大体形态学观察及组织学染色结果均显示,实验组28d左右可见成熟软骨形成。糖蛋白多糖检测结果显示新生软骨组织在实验组和对照组无显著差异。宿主表现为局部的纤维囊壁包裹弱炎症反应。结论:hUCMSCs构建的组织工程软骨,软骨再生情况良好,支架材料按时吸收,宿主弱免疫反应,在干细胞治疗软骨缺损方面显示出了一定的临床潜力。
[关键词]人脐血间充质干细胞;组织工程;软骨再生;免疫反应;体内;软骨形成
[中图分类号]R318 [文献标志码]A [文章编号]1008-6455(2021)08-0103-04
Cartilage Regeneration Induced by Human Umbilical Cord Mesenchymal Stem Cells (hUCMSCs) Combined with PHAs Biomaterials
ZHANG Cui1,HE Shan1,ZHOU Lin2
(1.Department of Stomatology,the Second Affiliated Hospital of Xian Jiaotong University,Xian 710065,Shaanxi,China;
2.Department of Plastic Surgery,the First Affiliated Hospital of Xian Jiaotong University,Xian 710061,Shaanxi,China)
Abstract: Objective To study the cartilage regeneration of human umbilical cord mesenchymal stem cells (hUCMSC) after gene induction into cartilage and composite scaffold materials to construct tissue engineered cartilage in vitro and transplant it into SD rats. Methods Human umbilical cord blood mesenchymal stem cells were isolated, expanded, cultured, and identified. The cell morphology was observed by inverted phase-contrast microscope. co-cultured for 1 week and implanted into SD rats,collected materials regularly (7d, 14d, 28d), and observation, histological staining, and expression of cartilage-specific matrix component proteoglycan. Observe the nutrient metabolism and host immune response in the process of graft cartilage regeneration. SD rats in the control group were transplanted with allogeneic sternal xiphoid cartilage; SD rats in the blank control group do nothing. Results The HE results of the graft showed that there was no significant difference in the postoperative inflammation between the experimental group and the control group. Gross morphological observation and histological staining results confirmed that mature cartilage formed in the experimental group around 28 days. Glycoproteoglycan test results showed that the experimental group and the control group were similar. The host showed weak local inflammation. Conclusion The tissue engineered cartilage constructed by hUCMSCs has good cartilage regeneration and weak host immune response. It shows a certain clinical potential in the treatment of cartilage defects with stem cells.
Key words: human umbilical cord mesenchymal stem cells (hUCMSC); tissue engineering; cartilage regeneration; immune response; in vivo; chondrogenesis
头颈颌面部是人体软骨较多的区域,由于不同原因造成软骨缺损后,因其自身无血管、神经等特性,自我修复困难[1]。目前临床上软骨缺损主要依靠移植人工材料进行缺损部位的修复重建[2-3],但是受到异物反应、宿主免疫排斥反应以及感染等问题的影响,临床使用受限。因此仍在不断研究和探索新的软骨缺损的修复重建方法。
组织工程学方法和干细胞研究在软骨缺损方面显示出了巨大的临床潜力[4-5]。结合基因治疗,种子细胞生长条件优化,生长因子促進软骨再生,支架材料的基因蛋白修饰等是目前国内外软骨组织工程研究的热点[6]。但是真正再生软骨应用于临床,新软骨形成的质量及支架材料的吸收速率是最受关注的问题之一[7-8],这也是目前干细胞应用于软骨组织工程研究的难点及亟待解决的问题[9-11]。如何更好地将干细胞结合在具有一定促进软骨再生的生长因子覆盖的支架材料上,在低免疫反应的辅助下,实现颌面软骨缺损处的再生修复是一直思考的问题。本实验拟通过将Sox9基因转染人脐血间充质干细胞后诱导软骨细胞形成作为种子细胞,复合PHAs支架材料以构建组织工程软骨,并移植到动物体内,研究其软骨再生能力和程度,为其安全应用于实际临床,提供一定的理论依据和临床思路。
1 材料和方法
1.1 实验动物、脐带血:实验用脐带血,采集于西安交通大学第二附属医院院产科,经家属同意。实验用雌雄各半SD大鼠共120只,体重(150±20)g。由西安交通大学医学部无菌动物实验中心提供,SPF级饲养。
1.2 主要试剂与仪器:透明质酸酶、Ⅱ型胶原酶(Sigma,美国);胎牛血清(fetal bovine serum,FBS)(Invitrogen,美国);Ⅱ型胶原一抗(鼠抗;Neomarker,美国);Aggrecan单克隆抗体(羊抗;Santa Cruz, 美国),CO2孵育箱(Thermo,日本);荧光显微镜(Nikon,日本)。高糖培养液(Dulbeccos modified Eagles medium,DMEM)、胰蛋白酶(GIBCO,美国)。
1.3 方法
1.3.1 干细胞诱导和鉴定:分离hUCMSC,并倒置显微镜观察,传代稳定后,Sox9基因转染诱导成软骨细胞并鉴定[12-13]。课题组前期已在实验中验证[14]。
1.3.2 支架材料准备:本实验所用PHAs为西安交通大学转化医学实验室馈赠。将PHAs三维支架制备成0.5cm×0.5cm×0.5cm大小立方体,酒精浸泡24h,紫外照射30min,备用[15]。超微投射电子扫描显微镜观察支架材料结构。
1.3.3 人脐带血干细胞复合支架材料构建干细胞组织工程软骨:将制成1×107ml的人脐血间充质干细细胞悬液,向48孔培养板中放置的PHAs支架材料上滴加,每块支架滴加40μl,细胞悬液充分浸入PHAs的各个孔隙内。添加DMEM-F 12 500μl。将培养板静置于体积分数5% CO2、37℃培养箱内培养。体外培养1周,观察hUCMSC在三维支架材料中的形态和分布[14]。
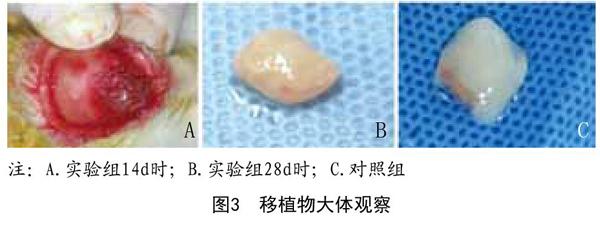
1.3.4 移植动物模型的建立:实验分组:实验组、对照组、空白组(n=8)。将SD大鼠用1%戊巴比妥溶液腹腔注射麻醉(300g/ml);待麻醉起效后,大鼠俯卧位固定;备皮(大鼠脊柱处脱毛),术区常规消毒,铺巾;实验组将构建的组织工程软骨植入SD大鼠背部皮下腔隙;对照组同样方法移植同种异体SD大鼠胸骨剑突软骨;空白组不移植;间断缝合创口。待大鼠清醒后随机放入笼中常规饲养。体内培养7d、14d、28d后取材。
1.3.5 组织学观察:组织块按时间取材后,肉眼大体形态观察,同时每块组织4%多聚甲醛溶液4℃固定过夜,常规梯度酒精脱水,石蜡包埋,切片10μm,脱蜡;行苏木精-伊红(HE)染色,观察其病理结构;Masson染色检测Ⅱ型胶原纤维,甲苯胺蓝(TB)染色、番红〇染色检测糖胺多糖(Glycosaminoglycan,GAG)。Ⅱ型胶原免疫组化染色检测Ⅱ型胶原纤维的表达情况。
1.3.6 超微透射电子扫描显微镜观察:将取材组织固定,4%多聚甲醛溶液4℃固定后,西安交通大学行扫描电子显微镜观察再生软骨的增殖情况。
2 结果
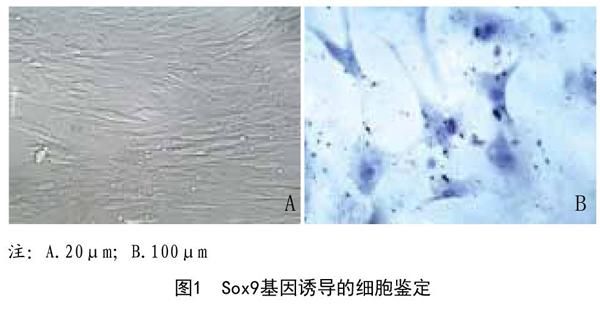
2.1 hUCMSCs基因诱导后细胞观察:体外培养14d,hUCMSCs贴壁生长,细胞形态为梭形成纤维样、透光性强,后逐渐融合,呈旋涡状,见图1A。hUCMSCs经Sox9基因过表达定向诱导分化为软骨细胞,细胞形态呈三角形、多边形,甲苯胺蓝染色细胞核蓝染、浆蓝紫染,见图1B。由此可见,人脐血间充干细胞定向分化为软骨细胞,且分化结果良好。
2.2 PHAs支架扫描超微透射电子显微镜观察:PHAs超微结构呈多孔状纤维纵横交错,胶原包被形成天然密集的微孔网状三维结构,表面粗糙分布均匀的孔隙。见图2。
2.4 HE染色、TB染色、番红〇染色及Masson染色结果:图4中HE染色、TB染色、番红〇染色结果显示:14d时细胞分化为圆形,细胞增殖,密集,细胞间隙小,基质少;28d时新生软骨形成并逐渐成熟,细胞分泌大量基质,典型透明软骨样组织形成,细胞间隙大,基质丰富,蛋白多糖分泌旺盛,呈片状分布;软骨细胞排列更加规则有序,软骨陷窝及软骨囊规则典型。Masson染色结果示:14d可检测到Ⅱ型胶原的表达。
2.5 扫描超微透射电子显微镜结果:14d时,细胞变为圆形,支架材料空隙内有大量的球形软骨细胞,周围包绕红细胞以及淋巴细胞。28d时细胞越来越多,细胞间隙减少,分布排列更加规则。越来越接近于对照组。见图5。
2.6 Ⅱ型胶原免疫组化结果:细胞形态从细长的成纤维样表型,变为球形到多边形,14d时可检测到Ⅱ型胶原的表达,与Masson染色,结果吻合,28d时Ⅱ型胶原增多,接近于对照组。见图6。
2.7 实验组移植物周围纤维包裹组织形态观察:7d时可见移植物周围纤维包膜形成,淋巴细胞、嗜酸性粒细胞、中性粒细胞、吞噬细胞及红细胞聚集可见大量成纤维细胞及新生毛细血管,炎细胞浸润,随时间延长,包膜逐渐增厚,分叶状的中性粒细胞、嗜酸性粒细胞及淋巴细胞大量聚集;14d时可见包膜胶原纤维增厚变粗,毛细血管丰富,炎性细胞密集排列;28d时包膜成熟,基质分泌多,纤维结缔组织样包膜形成。见图7。
2.8 实验组软骨形成过程中支架材料的吸收情况:7d时支架部分开始松解,周围大量吞噬细胞包绕已分解的支架块;14d时支架处于快速降解期;28d时大部分支架降解。PHAs支架的降解是通过炎细胞的包裹吞噬方式降解,其降解速率与软骨再生速率在SD大鼠体内基本吻合。见图8。
3 讨论
人脐血间充质干细胞(hUCMSCs)具有免疫原性低、道德伦理争议少等优点,被认为是良好的种子细胞。PHAs是一种无毒、可降解,具有良好生物相容性的支架材料,本实验将基因诱导过的hUCMSCs复合PHAs支架材料,移植入SD大鼠体内背部皮下培养。实验表明:28d可再生出透明软骨,性状接近对照组正常软骨。PHAs支架材料在28d左右降解,其方式通过炎细胞的包裹吞噬,降解速率和再生软骨速率吻合,移植周围仅表现为局部炎细胞浸润(淋巴细胞、单核细胞、中性粒细胞及嗜酸性细胞),移植物周围纤维结缔样组织包裹,包膜随时间增长逐渐包裹完全,28d左右包膜周围形成丰富的新生毛细血管网为其软骨再生以及支架材料的降解提供营养支持。
尽管如此,干细胞构建的组织工程软骨,在应用于临床之前,移植物组织及细胞在宿主体内的最终转归机制,仍需要进一步深入的研究和探讨。其中包括:生长因子在干细胞定向软骨细胞分化过程中,以及软骨形成的各个阶段,多个步骤中如何作用,特别是转化生长因子-β(TGF-β)超家族成员TGF-β,骨形态发生蛋白(BMP)和成纤维细胞生长因子(FGF)的作用[16];干细胞构建的组织工程软骨,在细胞分化过程中,分子机制如何调控,引导其更有效的形成软骨[2];干细胞治疗过程的归巢性,即在体内微环境作用下主动迁移至软骨缺血或受损部位进行修复受损细胞与细胞重建等。
下一步研究计划中hUCMSCs复合支架治疗构建组织工程软骨应用于体内软骨再生研究过程中,干细胞作用机制,细胞旁分泌、自分泌的影響、Notch信号通路的影响,以及干细胞应用于临床其营养供给和新陈代谢的途径,需要进一步明确组织工程软骨移植于受体体内其血管化再生,以及宿主的免疫抑制机制等方面可作为新的研究思路,继续深入研究。同时,随着3D打印技术的发展,计算机模型也可能在再生医学研究中发挥重要作用[17]。随着组织工程软骨工程研究的深入,以及干细胞治疗学科的进一步发展,生命基础科学与临床科学的结合交互研究,为干细胞构建的人工软骨应用于临床,提供更多理论及实践依据。
总之,本实验证明Sox9基因诱导的hUCMSCs分化所得软骨细胞复合PHAs支架材料,构建的组织工程软骨,在动物体内的软骨再生情况良好,支架材料有一定的生物机械强度并能按时降解,同时移植物在宿主体内主要表现为宿主局部纤维囊壁包裹的炎症反应。因此,认为该实验方法构建的组织工程软骨,在软骨缺损修复和功能重建方面显示出了一定的临床潜力,为其进一步应用于临床提供了必要的依据。
[参考文献]
[1]Chung C,Burdick JA.Engineering cartilage tissue[J].Adv Drug Deliv Rev,2008,60(2):243-262.
[2]Suh JKF,Matthew HWT.Application of chitosan-based polysaccharide biomaterials in cartilage tissue engineering: review[J].Biomaterials,
2000,21(24):2589-2598.
[3]Kenneth Zaslav,Brian Cole,Robert Brewster,et al.A prospective study of autologous chondrocyte implantation in patients with failed prior treatment for articular cartilage defect of the knee: results of the Study of the Treatment of Articular Repair (STAR) clinical trial[J].Am J Sports Med,2009,37(1):42-55.
[4]JS Boo,Y Yamada,Y Okazaki,et al.Tissue-engineered bone using mesenchymal stem cells and a biodegradable scaffold[J].J Craniofac Surg,2002,13(2):231-239,discussion 240-243.
[5]Hutmacher DW.Scaffolds in tissue engineering bone and cartilage[J].Biomaterials,2000,21(24):2529-2543.
[6]Evans CH,Ghivizzani SC,Smith P,et al.Using gene therapy to protect and restore cartilage[J].Clin Orthop Relat Res,2000,(379 Suppl):S214-S219.
[7]Olivia S Beane,Eric M Darling.Isolation, characterization, and differentiation of stem cells for cartilage regeneration[J].Ann Biomed Eng,2012,40(10):2079-2097.
[8]LIU Feng,JIANG Xiangling,LIU Mingming.Different culture methods for human umbilical cord mesenchymal stem cells[J].China Tissue Engineering Research,2016,20(28):4136-4141.
[9]Suh JK,Aroen A,Muzzonigro TS,et al.Injury and repair of articular cartilage: related scientific issues[J].Oper Tech Orthop,2007,7:270-278.
[10]Athanasiou K,Korvick D,Schenck R.Biodegradable implants for the treatment of osteochondral defects in a goat model[J].Tissue Eng,2009,3(4):363-373.
[11]Buckwalter JA,Mankin HJ.Articular cartilage: degeneration and osteoarthrosis, repair, regeneration, and transplantation[J].Instr Course Lect,1998,47:487-504.
[12]張军,张耀明,王正辉,等.Sox9诱导人脐血干细胞向软骨细胞分化的实验研究[J].组织工程与重建外科,2015,15(6):45-51.
[13]张军,徐辉,温绣蔺,等.Sox9基因转染的人脐带血干细胞复合骨基质明胶/生物蛋白胶构建组织工程软骨的实验研究[J].生物医学工程与临床,2018,22(1):13-19.
[14]高天喜,常会敏,范敏杰,等.聚羟基脂肪酸酯的生物修饰及其生物相容性研究[J].中国修复重建外科杂志,2014,28(8):1023-1029.
[15]Liao CJ,Lin YJ,Chiang H,et al.injecting partially digested cartilage fragments into a biphasic scaffold to generate osteochondral composites in a nude mice model[J].J Biomed Mater Res A,2006,81(3):567-577.
[16]Augustyniak E,Trzeciak T,Richter M,et al.The role of growth factors in stem cell-directed chondrogenesis: a real hope for damaged cartilage regeneration[J].Int Orthop,2015,39(5):995-1003.
[17]Geris L.Regenerative orthopaedics: in vitro, in vivo … in silico[J].Int Orthop,2014,38(9):1771-1778.
[收稿日期]2021-01-18
本文引用格式:张翠,何珊,周林.人脐血间充质干细胞(hUCMSCs)复合PHAs生物材料诱导软骨再生的研究[J].中国美容医学,2021,30(8):103-106.
