BCG诱导RAW264.7细胞脂肪酸氧化对细胞自噬和促炎因子表达的调控作用
2021-09-27徐金瑞王玉炯
骆 佳,徐金瑞,李 武,王玉炯*
(1.西部特色资源保护与利用教育部重点实验室,银川 750021;2.宁夏大学生命科学学院,银川 750021)
结核病(tuberculosis, TB)是由结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)感染引起的慢性呼吸道传染病,所造成的死亡是全球十大致死原因之一。巨噬细胞作为Mtb的主要宿主细胞和免疫细胞,通过调节自身死亡方式(凋亡、坏死、焦亡和自噬)决定Mtb感染的最终转归[1]。细胞凋亡促进胞内菌的清除,细胞坏死则加速胞内滞留菌的扩散,而自噬决定着胞内菌的命运(清除或滞留)[2]。
Mtb感染导致巨噬细胞代谢进程变化,致使脂滴和细胞器脂质聚集在胞质中而形成泡沫巨噬细胞(foamy macrophage)[3]。三酰甘油、胆固醇和脂肪酸是泡沫巨噬细胞中的主要脂质成分,Mtb通过利用这些脂质为其自身提供能源物质从而维持在巨噬细胞中的复制和存活[4-5]。Mtb感染促进肺泡巨噬细胞脂肪酸氧化(fatty acid oxidation, FAO),干预巨噬细胞脂肪酸氧化,抑制Mtb在巨噬细胞中繁殖[6]。此外,炎性介质的产生也与脂肪酸代谢有着密切的联系[7]。然而,Mtb感染过程中,FAO对巨噬细胞自噬以及促炎因子表达的调控作用还尚不明确。本研究采用牛分枝杆菌疫苗株卡介苗(bacillus Calmette-guérin, BCG)感染小鼠巨噬细胞RAW264.7,用乙莫克舍[8](etomoxir, Eto)抑制FAO,通过检测自噬相关蛋白表达、自噬小体聚集、自噬流以及促炎因子IL-1β、IL-6和TNF-α的表达情况,揭示BCG感染巨噬细胞过程中,FAO途径对巨噬细胞自噬和炎性反应的调控作用,为基于代谢途径的结核病免疫机制研究提供新的思路。
1 材料与方法
1.1 材料
小鼠巨噬细胞RAW264.7购自中国科学院细胞库;胎牛血清、DMEM-High Glucose购自Gibco公司;细胞总RNA提取试剂盒购自OMEGA公司;TransSciptAll-in One SuperMix for qPCR、PerfectStartGreen q-PCR SuperMix试剂盒购自全式金公司;兔抗LC3、Beclin1、CPT-1A和GAPDH抗体购自Cell Signal Technology(CST);兔抗Rab7抗体和游离脂肪酸定量试剂盒(free fatty acid quantification assay kit)购自Abcam公司;荧光素偶联山羊抗兔IgG和BODIPY-488购自Invitrogen 公司;乙莫克舍(Etomoxir, Eto)购自MedChemExpress公司;mRFP-GFP-LC3荧光双标腺病毒购自汉恒生物科技有限公司;小鼠IL-1β、IL-6 和TNF-α ELISA试剂盒购自博士德生物工程有限公司;相关引物由生工生物工程有限公司合成。
1.2 细胞培养
用含10%胎牛血清的DMEM高糖培养基,于37 ℃、5% CO2培养箱中培养RAW264.7细胞。培养细胞至对数生长期,用于后继试验。
1.3 BCG培养
牛结核分枝杆菌疫苗株BCG培养于添加Tween-80(0.5%)和增菌剂(OADC)的Middlebrook 7H9培养基中,37 ℃ 5% CO2培养至菌液OD600 nm=1.5后进行传代培养。
1.4 试验分组设计
试验共分3组,分别为对照组(Ctrl)、BCG感染组和Eto与BCG共处理组(Eto+BCG)。Ctrl组为不经任何处理正常状态下的RAW264.7细胞;BCG组用感染复数为(multiplicity of infection, MOI)10的BCG培养物感染细胞6 h;Eto+BCG组用Eto预处理RAW264.7细胞2 h后,用MOI=10的BCG培养物感染细胞6 h。
1.5 Western blot检测
Eto预处理RAW264.7细胞2 h后,用MOI=10的BCG培养物感染细胞6 h,提取细胞总蛋白,BCA定量后进行SDS-PAGE凝胶电泳。PVDF膜转印后,5%脱脂奶粉室温封闭1 h,过夜孵育 CPT-1A(1∶1 000)、Beclin1(1∶1 000)、LC3-II(1∶1 000)以及Rab7(1∶1 000)抗体,次日TBST(Tween-20含量0.3%)洗膜6次(5 min·次-1),二抗室温孵育1 h,TBST 洗膜6次后,化学发光检测蛋白表达水平。
1.6 游离脂肪酸定量试验
用MOI=10的BCG悬液感染RAW264.7细胞6 h后收集细胞,用含1% Triton X-100的氯仿充分裂解细胞,13 000×g离心10 min,去除不可溶物质并收集有机相。将收集的有机相置于50 ℃烘箱中至氯仿去除后,真空干燥30 min,从而提取细胞中游离脂肪酸(free fatty acid, FFA)。所提取的FFA根据说明书进行定量并与细胞蛋白含量进行归一化处理。
1.7 BODIPY检测脂滴
以3×105cell·mL-1细胞量接种于放有盖玻片的12孔板中,MOI=10的BCG悬液感染RAW264.7细胞6 h后,PBS漂洗细胞3次(5 min·次-1),4%多聚甲醛固定20 min,BODIPY 染色15 min, PBS漂洗3次(5 min·次-1),用含DAPI封片剂封片。
1.8 免疫荧光检测自噬小体
以3×105cell·mL-1的细胞量接种于放有盖玻片的12孔板中,Eto预处理RAW264.7细胞2 h后,用MOI=10的BCG培养物感染细胞6 h,PBS漂洗感染后的细胞3次(5 min·次-1),4%多聚甲醛固定20 min,Triton X-100室温通透20 min,5% 山羊血清室温封闭30 min,LC3抗体(1∶200)37 ℃孵育2 h,荧光二抗(1∶1 000)37 ℃孵育30 min。用含DAPI的封片剂封片,激光共聚焦显微镜观察细胞中自噬小体聚集情况。
1.9 自噬流检测
将对数生长期的RAW264.7细胞以2×105cell·mL-1细胞量接种于放置有盖玻片的12孔板中,过夜培养。mRFP-GFP-LC3荧光双标腺病毒以感染复数(multiplicity of infection,MOI)50感染6 h,更换新鲜完全培养基继续培养24 h。Eto预处理2 h,BCG(MOI=10)感染6 h,PBS漂洗3次(5 min·次-1),4%多聚甲醛固定20 min,抗荧光淬灭封片剂封片,激光共聚焦显微镜观察细胞中mRFP-LC3和mRFP-GFP-LC3点状聚集。
1.10 qRT-PCR检测IL-1β、IL-6、TNF-α mRNA表达
Eto预处理RAW264.7细胞2 h后,用MOI=10的BCG培养物感染细胞6 h,用细胞总RNA提取试剂盒提取细胞总RNA,并根据反转录试剂盒说明书将提取到的RNA反转录合成cDNA。以cDNA作为模板进行qRT-PCR操作。qRT-PCR试验数据用2-ΔΔCt法分析各试验组中IL-1β、IL-6、TNF-αmRNA的相对表达水平。鼠IL-1β、IL-6、TNF-α及GAPDH上下游引物见表1。
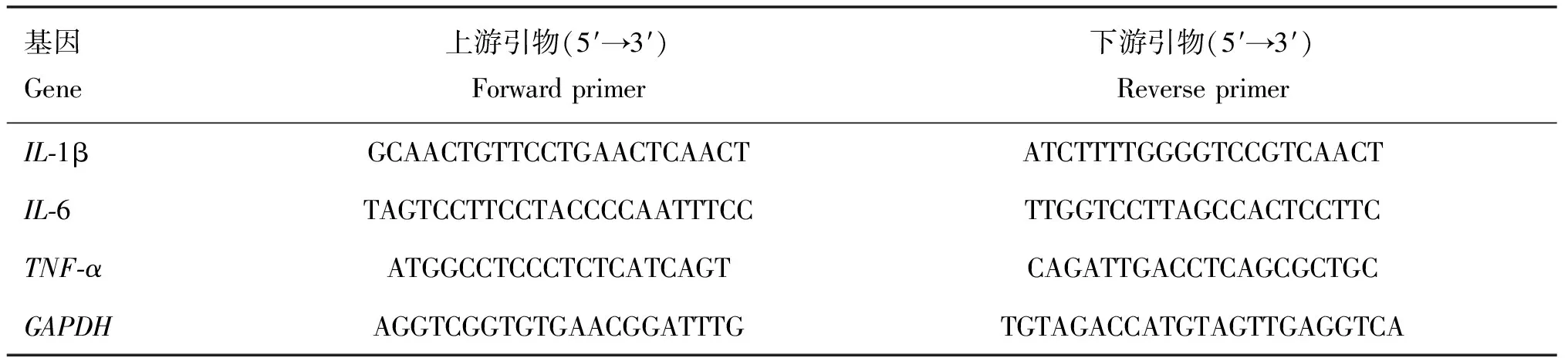
表1 qRT-PCR引物序列
1.11 ELISA检测IL-1β、IL-6和TNF-α含量
Eto预处理RAW264.7细胞2 h后,用MOI=10的BCG培养物感染细胞6 h,收集细胞培养上清,1 000 r·min-1离心20 min,用小鼠IL-1β、IL-6和TNF-α ELISA试剂盒检测上清中IL-1β、IL-6和TNF-α含量。
1.12 胞内菌存留试验
Eto预处理RAW264.7细胞2 h后,用MOI=10的BCG培养物感染细胞2 h,PBS漂洗细胞3次清除胞外菌,继续培养细胞6 h,0.5% Triton X-100 裂解细胞;待巨噬细胞全部裂解后,将裂解产物10倍稀释并均匀涂布在含有OADC的Middlebrook7H10 琼脂培养基上,培养3周后,进行菌落计数。
1.13 统计学分析
所有试验数据均经过3次独立试验的验证,试验数据采用GraphPad Prism 9.0中T-test或One Way ANOVA进行统计学分析,数据用平均数±标准误(x±sx)表示。
2 结 果
2.1 BCG感染促进RAW264.7细胞脂肪酸氧化
BODIPY标记脂质检测BCG感染前后细胞中脂滴含量,结果显示:BCG感染引起RAW264.7细胞中脂滴积累(图1A、B),而游离脂肪酸含量显著下调(P<0.05)(图1C);且BCG感染促进了肉毒碱棕榈酰基转移酶1A(carnitine palmitoyltransferase 1A, CPT-1A)表达(图1D),并在BCG感染4 h 时其表达量达到最高。

A、B.BODIPY标记脂质,激光共聚焦观察BCG感染前后RAW264.7细胞脂滴聚集情况,BODIPY为绿色,DAPI为蓝色;C.吸光光度法检测BCG感染前后,RAW264.7细胞细胞中游离脂肪酸含量; D.Western blot检测BCG感染不同时间点CPT-1A表达水平。*.P<0.05,**.P<0.01
2.2 抑制BCG诱导RAW264.7细胞FAO抑制RAW264.7细胞中BCG存留量
CFU试验检测Eto预处理后,BCG感染的RAW264.7细胞中BCG存活量。结果显示:Eto预处理后的细胞中BCG存留量较BCG组显著减少(图2)(P<0.01)。说明抑制BCG诱导RAW264.7细胞FAO抑制RAW264.7细胞中BCG存活。

**.P<0.01
2.3 BCG诱导RAW264.7细胞FAO参与调控细胞自噬
Western blot检测自噬相关蛋白Beclin1和LC3-Ⅱ以及溶酶体蛋白Rab7表达变化。结果显示,BCG感染促进了Beclin1、LC3-Ⅱ和 Rab7的表达;Eto预处理进一步上调Beclin1、LC3-Ⅱ和Rab7的表达,且差异具有统计学意义(P<0.05,图3A~D)。激光共聚焦结果也显示,与BCG组相比,Eto预处理后的细胞中聚集大量自噬小体(图4A、B)。

Eto预处理2 h,BCG感染RAW264.7细胞6 h后,Western blot检测Beclin1、LC3-Ⅱ和Rab7表达水平。*.P<0.05,**.P<0.01

A.激光共聚焦观察细胞中自噬小体的聚集情况,LC3-Ⅱ为绿色,DAPI为蓝色; B.每个细胞中自噬小体含量定量结果。**.P<0.01
2.4 抑制BCG诱导RAW264.7细胞FAO促进自噬流
激光共聚焦检测Eto预处理后,BCG感染的RAW264.7细胞中自噬体(mRFP-GFP-LC3)和自噬溶酶体(mRFP-LC3)聚集情况。结果显示:BCG感染的RAW264.7细胞中出现自噬体mRFP-GFP-LC3和自噬溶酶体mRFP-LC3点状聚集,且经Eto处理后,RAW264.7细胞中自噬体和自噬溶酶体含量均出现显著上调(P<0.05,图5)。说明抑制BCG诱导RAW264.7细胞FAO途径促进了自噬流发生。
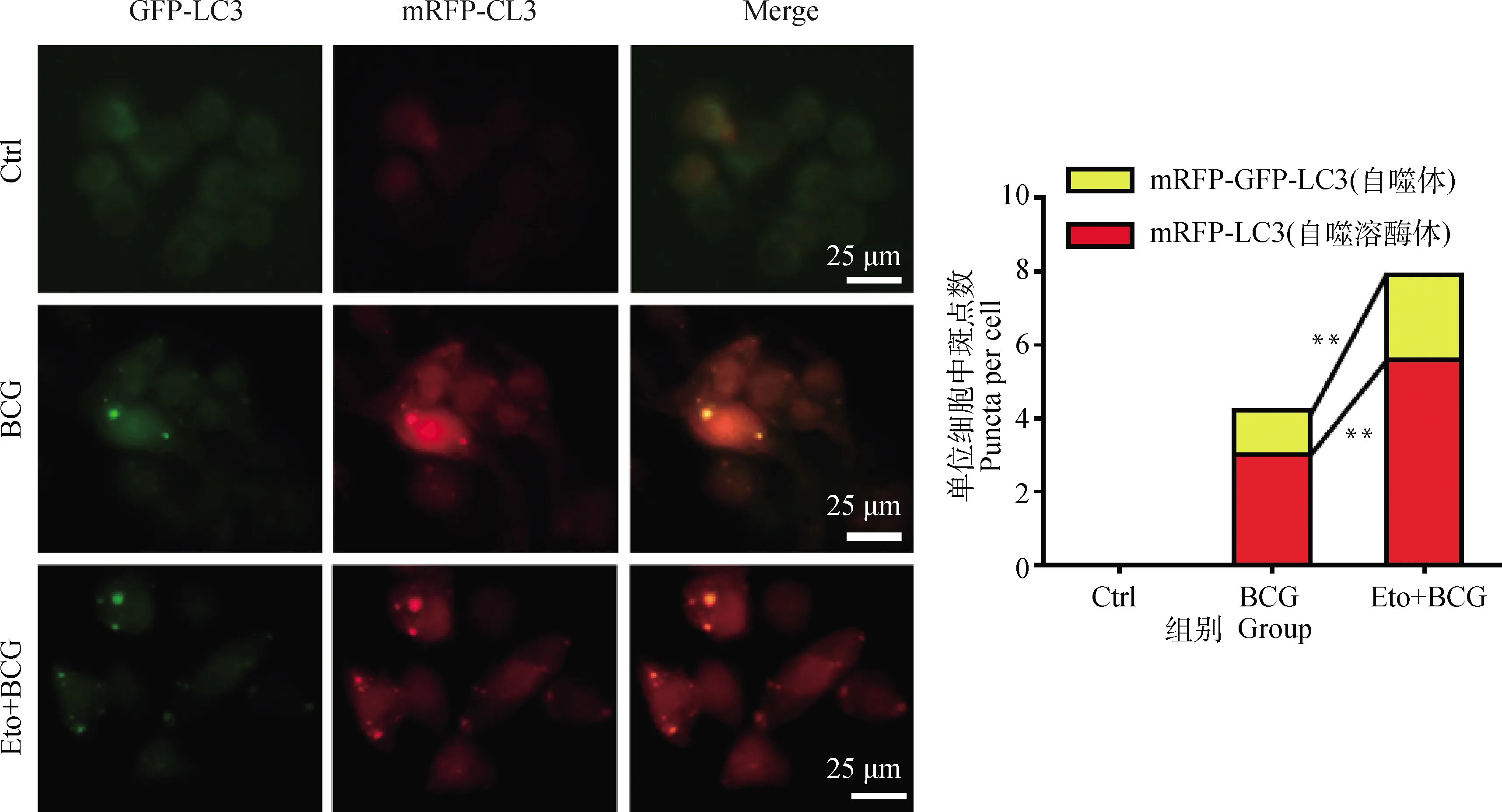
*.P<0.05,**.P<0.01
2.5 抑制BCG诱导RAW264.7细胞FAO下调IL-1β、IL-6和TNF-α表达
qRT-PCR检测促炎因子IL-1β、IL-6和TNF-αmRNA表达情况。结果显示,Eto预处理抑制BCG感染引起的IL-1β、IL-6和TNF-αmRNA表达(图6A~C),且差异均具有统计学意义(P<0.05)。为了进一步探究BCG诱导RAW264.7细胞FAO对促炎因子IL-1β、IL-6和TNF-α表达的影响,收集细胞培养上清,用ELISA方法检测上清中IL-1β、IL-6和TNF-α含量,试验结果与qRT-PCR结果一致,即Eto预处理后,上清中IL-1β、IL-6和TNF-α含量较BCG感染组显著下调(P<0.05,图6D~F)。

A、B、C.Eto预处理2 h,BCG感染RAW264.7细胞6 h后,qRT-PCR检测促炎因子IL-1β、IL-6和TNF-α mRNA表达水平;D、E、F.Eto预处理2 h,BCG感染RAW264.7细胞6 h后,收集细胞培养上清,ELISA 检测细胞培养上清中促炎因子IL-1β、IL-6和TNF-α含量。*.P<0.05,**.P<0.01
3 讨 论
早期研究显示,Mtb利用宿主细胞脂肪酸作为碳源维持其在胞内生长繁殖[9-12]。Podinovskaia等[13]应用荧光脂肪酸转运试验观察到细胞中Mtb内存在宿主细胞来源的脂肪酸,说明Mtb摄取并利用了宿主脂肪酸[14]。在巨噬细胞、小鼠以及人肺组织Mtb感染模型中,参与脂肪酸利用相关基因表达上调[15-17]。本研究用BODIPY染色标记脂滴,发现BCG感染的RAW264.7细胞中出现大量脂滴聚集,而细胞中游离脂肪酸含量减少,且参与FAO的关键酶——CPT-1A表达上调。此结果说明:BCG感染促进了巨噬细胞FAO。
Mtb感染导致的巨噬细胞代谢变化将影响吞噬体与溶酶体的融合[18-19],从而为Mtb在宿主细胞中长期滞留提供了良好的条件。由此可见,改变Mtb与巨噬细胞代谢间的平衡机制可抑制胞内病原菌存活[20]。肉芽肿是结核病的主要病理特征,感染了Mtb的巨噬细胞在其胞浆区域积聚脂质,并分化形成泡沫巨噬细胞[21-22],构成了肉芽肿主要成分之一。泡沫巨噬细胞在Mtb感染扩散中发挥着重要作用。因此,调控巨噬细胞脂代谢进程可以控制结核病的发生与发展。目前,基于宿主细胞代谢的宿主导向治疗(host-directed therapy, HDT)方法在人结核病的治疗中,尤其在感染多重耐药结核分枝杆菌患者的治疗中取得了显著效果[23-24]。自噬作为一种溶酶体清除机制,在调控巨噬细胞对Mtb的清除中发挥着重要的作用[25]。多种因素调控细胞自噬,代谢途径改变所导致的能量变化则是其中因素之一[26-28]。FAO作为细胞供能方式之一,其变化也将影响巨噬细胞自噬清除作用。CPT-1A通过介导长链脂肪酸进入线粒体,进而进行FAO。Eto通过与CPT-1A结合,进而抑制FAO的进行[29]。为探究BCG诱导的RAW264.7细胞FAO对细胞自噬和促炎因子的表达调控作用,本研究用Eto抑制FAO并检测BCG感染后自噬相关蛋白Beclin1和LC3-II以及炎性因子IL-1β、IL-6和TNF-α的表达情况,结果显示,Beclin1和LC3-II的表达均显著上调,且细胞中出现大量自噬小体;而IL-1β、IL-6和TNF-α的表达却受到抑制。Rab7是自噬体与溶酶体融合进程中重要调节分子之一[30],参与调控自噬溶酶体的成熟过程,敲除Rab7将导致自噬小体聚集[31]。结果显示,Eto预处理不仅上调了自噬相关蛋白的表达,同时促进了Rab7的表达,说明抑制FAO可以促进自噬小体和溶酶体融合,并且自噬流检测结果也进一步显示干预FAO后,细胞中自噬溶酶体数量增多,胞内存留BCG也显著下调。由此可见,BCG诱导FAO参与调控巨噬细胞自噬,抑制FAO可以激活RAW264.7自噬途径清除细胞中滞留的病原菌,并且可以防止因为过度炎性反应所致的炎性损伤。然而,FAO调控巨噬细胞自噬的具体机制将是本课题接下来要探究的问题。
4 结 论
BCG感染促进RAW264.7细胞FAO,且此代谢途径参与调控RAW264.7细胞自噬:抑制BCG诱导的RAW264.7细胞FAO促进了细胞自噬从而抑制胞内菌的存活,且抑制了促炎因子IL-1β、IL-6和TNF-α的表达和分泌。说明FAO途径在巨噬细胞抗结核分枝杆菌感染中发挥着双重调控作用。
