靶向BCMA CAR-T细胞在复发难治性多发性骨髓瘤中的治疗进展
2021-09-26杜文王晓青成娟综述赵丽审校
杜文 王晓青 成娟 综述 赵丽 审校
多发性骨髓瘤(multiple myeloma,MM)是血液系统第二常见肿瘤,美国癌症协会统计数据提示新发骨髓瘤占所有肿瘤的1.7%,占血液肿瘤的18%[1]。目前,MM 尚无法治愈,主要治疗目标为控制疾病进展,延长患者生存期。MM 患者在接受以化疗为主的综合治疗后,终将复发成为复发难治性多发性骨髓瘤(relapsed/refractory multiple myeloma,R/R MM)。近年来,嵌合抗原受体T 细胞(chimeric antigen receptor T cell,CAR-T)在R/R MM 治疗中获得了较传统方法更好的有效性和缓解率。
1 靶向BCMA CAR-T
嵌合抗原受体(chimeric antigen receptor,CAR)是通过基因工程技术获得的嵌合蛋白,共有4 代,主要由细胞外抗原识别域,通常是单克隆抗体的单链可变片段(scFv),铰链区CD8 的跨膜结构域,以及细胞内信号转导结构域3 个部分组成[2]。目前临床上的CAR-T 产品多为第二代产品。CAR-T 免疫疗法是一种使用基因修饰的效应T 细胞治疗肿瘤的新策略,其可以不受主要组织相容性复合物限制,特异性识别并杀死表达特定抗原的肿瘤细胞[3]。
B 细胞成熟抗原(B cell mature antigen,BCMA)又称CD269、TNFRSF13C,是一种Ⅲ型跨膜蛋白,属于肿瘤坏死因子受体家族[4]。BCMA 激活NF-κB 和MAPK/JNK 通路结合B 淋巴细胞活化因子( B cell activating factor belonging to the TNF family,BAFF),从而调节长寿浆细胞的生存并维持正常的体液免疫信号转导通路。同时,也可以结合增殖诱导配体(a proliferation inducing ligand,APRIL)促进MM 细胞在骨髓微环境的扩散[5]。BCMA 广泛表达于多发性骨髓瘤细胞表面,且表达量随MM 进展递增,但在正常细胞上低表达,在CD34+造血细胞上不表达。因此,BCMA 是MM 免疫治疗的一个理想靶点[6]。2013年,Carpenter 等[7]使用慢病毒载体转导形成了第一批靶向BCMA CAR-T 细胞。随后,有研究[8]进行了靶向BCMA CAR-T 细胞的首次临床试验,共12 例患者参与,试验结果提示靶向BCMA CAR-T 细胞对治疗R/R MM 具有强大的有效性。
2 靶向BCMA CAR-T 细胞在临床应用中的试验进展
目前,许多靶向BCMA CAR-T 产品已处于不同的研究阶段。虽然这些CAR-T 细胞的构建体存在相似之处,但其所使用的共刺激结构域(如4-1BB、CD28、OX40)、铰链区(CD8)、跨膜结构域(CD8、CD28)、用于产生抗BCMA 的scFv 的物质(来源于小鼠、人、美洲驼等)、用于增强CAR-T 细胞疗法安全性的方法(截短的表皮生长因子受体或其他安全开关)、转导方法(逆转录病毒与慢病毒)以及用于离体富集和刺激CAR-T 细胞增殖的培养基(涂有顺铂的顺磁珠)有所差异。在起初CAR 的设计中,更加关注scFv 的亲和性以及其识别的抗原表位对细胞疗法的有效性,甚少关注动物源性scFv 的抗原性。动物源性scFv 片段可诱导机体产生免疫反应,降低治疗的有效性,同时大剂量的输注,可能引起更高的不良反应率,如细胞因子释放综合征(cytokine release syndrome,CRS)等。此外,有研究证明鼠源性scFv 片段可限制CAR-T 细胞扩增,降低治疗的持久性,人源性的scFv片段相较于鼠源性scFv 片段在降低机体免疫反应的同时增加治疗的持久性[9]。
2.1 鼠源性scFv 片段的靶向BCMA CAR-T 产品
鼠源性scFv 片段的靶向BCMA CAR-T 产品,见表1。
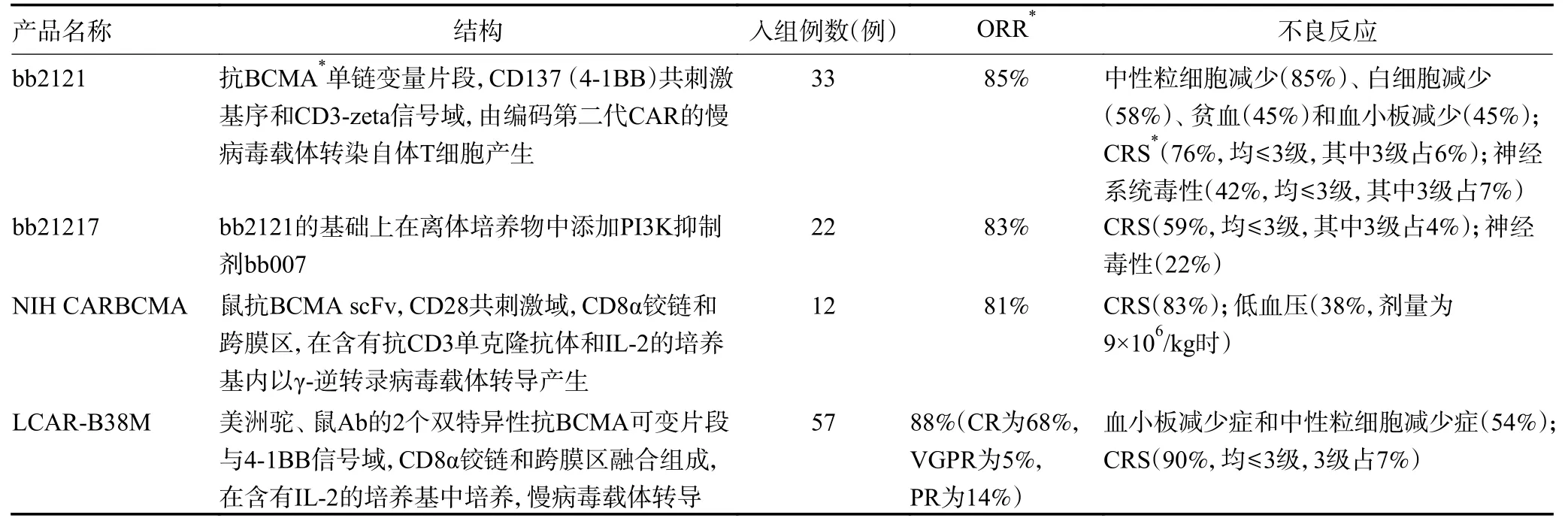
表1 鼠源性scFv 片段的靶向BCMA CAR-T 产品
2.1.1 bb2121/bb21217 bb2121 是由编码第二代CAR的慢病毒载体转染自体T 细胞产生,该载体中含有抗BCMA 单链变量片段、CD137(4-1BB)共刺激基序和CD3-zeta 信号域,bb2121 在不同的BCMA 表达水平下,甚至在可溶性BCMA 存在的情况下,均能在体外有效杀伤骨髓瘤细胞。此外,在人类MM 小鼠模型中,单次给药后bb2121 显示出快速、持续的肿瘤消除和100%的生存率[10]。基于上述发现,Raje 等[11]进行关于bb2121 的Ⅰ期临床试验,33 例患者接受bb2121治疗,客观缓解率(objective response rate,ORR)为85%,完全缓解(complete response,CR)为9%,严格意义的完全缓解(stringent complete response,sCR)为36%,其中不良事件为中性粒细胞减少(85%)、白细胞减少(58%)、贫血(45%)和血小板减少(45%)。76%患者出现CRS,其中70%为1 级或2 级,6%为3 级。42%患者发生神经系统毒性作用(均≤3 级,其中3 级1 例)。当CAR-T 细胞数量≥150×106/kg 时观察到较为明显的反应,第11 天可达到反应高峰,安全性评估剂量高达800×106/kg CAR-T 细胞。
bb21217 是一种类似于bb2121 的CAR-T 细胞,是在bb2121 的基础上在离体培养物中添加PI3K 抑制剂bb007 以增加记忆性T 细胞表型,能增加CART 细胞的持久性和效力,并在开展Ⅰ期临床试验的剂量递增试验。Shah 等[12]纳入50 例接受≥3 种既往治疗方案的R/R MM 患者,给予150、450、800、1 200×106/kg的CAR-T 细胞输注,结果显示在R/R MM 中以150×106/kg CAR-T 细胞的剂量持久性和效力最佳。7 例患者ORR 为86%,其中1 例sCR,3 例非常好的部分缓解(very good partial response,VGPR),2 例部分缓解(partial response,PR)。3 例可评估应答者经下一代测序均为微小残留病(minimal residual disease,MRD)阴性。CRS 发生率为62.5%,其中3 级CRS 1 例,伴4 级脑病,表现为后部可逆性脑病综合征。截至2019年4月CRB-402 的研究结果提示:22 例患者接受bb21217 输注,83%患者有临床反应,13 例发生CRS(均≤3 级,其中3 级1 例),5 例出现神经毒性,均在服用药物后得到控制。提示bb21217 具有良好的持久性且不良反应可控[13]。
2.1.2 NIH CARBCMA NIH CARBCMA 由 鼠抗BCMA scFv,CD28 共刺激域,CD8α 铰链和跨膜区,在含有抗CD3 单克隆抗体和IL-2 的培养基内以γ-逆转录病毒载体转导产生。Ali 等[14]进行的剂量递增试验中,12 例患者接受治疗。所有患者经环磷酰胺、氟达拉滨预处理后开始剂量递增计划,初始剂量为0.3×106/kg CAR-T 细胞,剂量依次以每个后续剂量水平的3 倍递增,观察到在剂量为9×106/kg 时ORR 为81%,且此剂量时CRS 相关的不良反应较大,其中38%以9×106/kg 治疗的患者发生低血压,需要血管加压药才可维持,但初步显示了靶向BCMA CAR-T 细胞对治疗耐药的MM 具有强大的活性。
2.1.3 LCAR-B38M LCAR-B38M由美洲驼、鼠Ab 的2 个双特异性抗BCMA 可变片段与4-1BB 信号域、CD8α 铰链和跨膜区融合组成,在含有IL-2 的培养基中培养,采用慢病毒载体的转导方式转导。其抗原识别部分由针对BCMA 的2 个表位美洲驼、鼠Ab 的2 条重链组成。该结构可以增加抗原识别的特异性,还可能增加CAR-T 的抗原结合亲和力,从而产生更强的抗MM 效应。Xu 等[15]在17 例R/R MM 患者中进行的临床试验提示,LCAR-B38M 在17 例R/R MM 患者中ORR 为88.2%(其中76.5% sCR、11.8%VGPR)。1年无进展生存期(progression-free survival,PFS)为52.9%,1年总生存期(overall survival,OS)为82.3%。最常见的不良反应为CRS(1~2 级10 例,3级6 例,5 级1 例),52.9%患者有1 级以上的肝功能不全。随后Zhao 等[16]进行的Ⅰ期开放单臂试验中,将(0.07~2.10)×106/L CAR-B38M CAR-T 细胞输注,57 例患者中有50 例有反应;ORR 为88%,39 例(68%)获得CR,3 例(5%)获得VGPR,8 例(14%)获得PR,36 例(63%)MRD 阴性,常见不良事件有CRS(90%)和血小板减少症和中性粒细胞减少症(54%),51 例发生CRS,大多为1 级和2 级(83%),其中3 级为4 例(7%)。LCAR-B38M 显示出与其已知作用机制一致的易于管理的安全性,有望成为R/R MM 患者的高效疗法。
2.2 人源性scFv 片段的靶向BCMA CAR-T 产品
人源性scFv 片段的靶向BCMA CAR-T 产品,见表2。
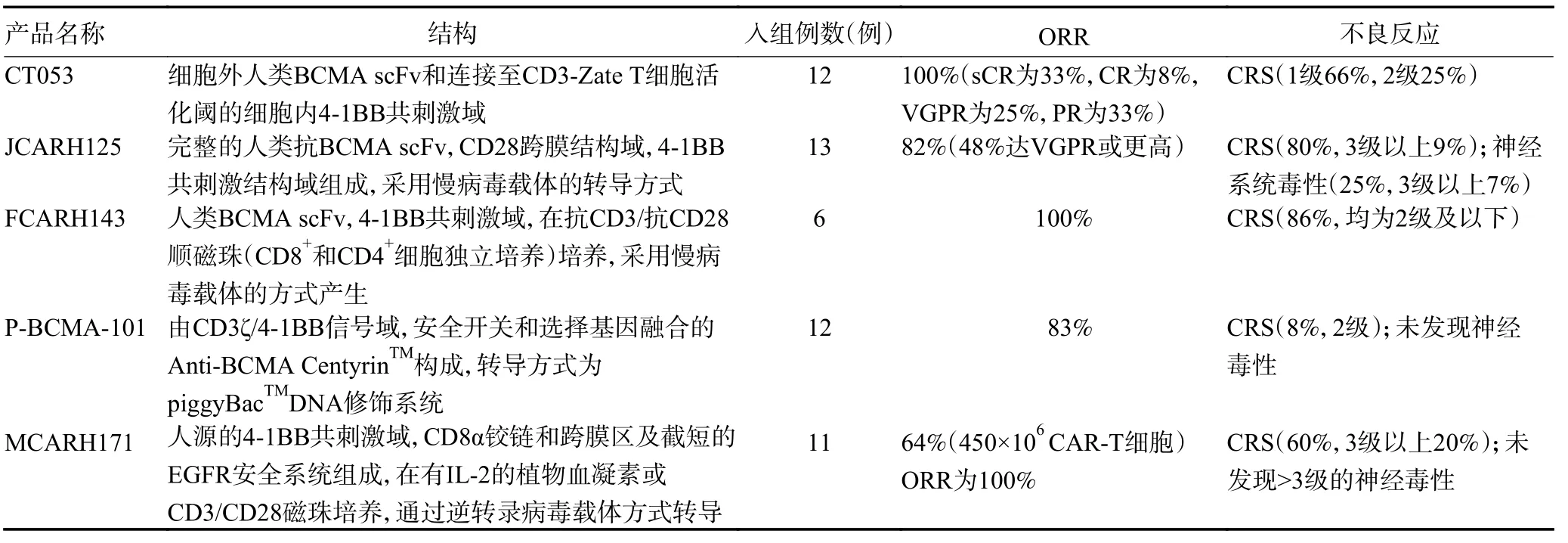
表2 人源性scFv 片段的靶向BCMA CAR-T 产品
2.2.1 CT053 CT053 是经过基因修饰的T 细胞,包括细胞外人抗BCMA scFv 和连接至CD3-Zate T 细胞活化阈的细胞内4-1BB 共刺激域。Jiang 等[17]设计一项由多中心发起的临床试验,以评估先前≥2 种方案治疗失败的R/R MM 中CT053 的效果。研究结果表明,在13 例接受CT053 输注且参与临床反应初步评估的患者中,ORR 为100%,单剂量输注4 周时92%达明显缓解(4 例PR,6 例VGPR,2 例CR),在≥1.5×108给药患者在中位生存时间(median overall survival,mOS)8 周时获得持久CR,期间观察到≤3级CRS 3 例(3 级1 例),服用tocilizumab 后迅速缓解。随访截至2020年6月[18],9 例受试者完成了24 个月的随访,其中8 例sCR 和1 例CR。总体缓解率为87.5%,其中包括79.2% 的CR 或sCR(CR 3 例,sCR 16 例)。中位缓解持续时间为21.8 个月。中位PFS(median PFS,mPFS)为18.8 个月,其中6 个月和12 个月的PFS 分别为87.0% 和60.9%。截至2020年7月,分别于中国、北美进行的CT053 的临床试验显现出基本一致的结果。Chen 等[19]在中国开展的Ⅰ期试验,共招募14 例受试者,在至少进行4 周疗效评估的12 例受试者中,观察到100% 的ORR(其中包括sCR 4 例,CR 1 例,VGPR 3 例和PR 4 例)。在105敏感度水平上,CR/sCR 5 例受试者MRD 阴性。常见不良反应为血液学毒性,大多均2 周缓解,12 例受试者中8 例出现1 级CRS,3 例出现2 级CRS。CRS 事件发生在输注后的中位数为6(2~12)天,中位持续时间为7 天。8 例受试者接受tocilizumab 治疗,其中1 例2 级CRS 受试者同时接受tocilizumab 和类固醇治疗。Kumar 等[20]在北美进行的Ⅰb/Ⅱ期临床试验招募患者14 例,其中可以评估10 例受试者至少2 个月的疗效评估,中位随访时间为4.5(2~8)个月。观察到100% 的ORR,其中包括sCR 2 例,CR 2 例,VGPR 1 例和PR 5 例。其中86% 患者经历了1 级或2 级CRS。同时2 例受试者接受tocilizumab 的治疗,1 例患有2 级CRS 的受试者同时接受tocilizumab 和类固醇的治疗。1 例受试者2 级神经毒性,在注射地塞米松后24 h 内完全消退。提示CT053 具有较好的安全性和功效,并且不良事件短暂、可管理且可逆,有望成为R/R MM 患者的新疗法。
2.2.2 JCARH125 JCARH125 是由完整的人类抗BCMA scFv、CD28 跨膜结构域和4-1BB 共刺激结构域组成,采用慢病毒载体的传导方式。Mailankody等[21]纳入13 例患者的临床递增试验,提示经环磷酰胺和氟达拉滨预处理后,以50、150、450×106/kg 的剂量输注,ORR 为82%,其中48% 达VGPR 或更高,MRD 阴性67%。CRS 发生率为80%,其中3 级以上CRS 占9%,发生CRS 中位时间为3 天,持续中位时间5 天,25%患者发生神经系统事件,其中3 级以上为7%。
2.2.3 FCARH143 由完全人类BCMA scFv、4-1BB共刺激域,在抗CD3/抗CD28 顺磁珠(CD8+和CD4+细胞独立培养)培养,采用慢病毒载体的方式产生,产品以1∶1 的CD4+与CD8+CAR T 细胞比例注入,并表达短截的无功能的人类表皮生长因子受体,以帮助鉴定转导的T 细胞。6 例可评估的患者在接受治疗后ORR 为100%,在输注90 天后仍可检测到CAR-T细胞,发生CRS(2 级及以下)占86%,未观察到明显的神经毒性[22]。
2.2.4 P-BCMA-101 P-BCMA-101 是由与CD3ζ/4-1BB信号域,安全开关和选择基因融合的Anti-BCMA CentyrinTM构成,转导方式为piggyBacTMDNA 修饰系统,是迄今为止唯一使用非病毒转导方法产生的BCMA 的CAR,仅需质粒DNA 和mRNA。与使用传统的基于抗体的结合剂不同,P-BCMA-101 使用抗BCMA centyrin 融合到CD3 蛋白/4-1BB 信号域。centyrins 是完全人类的,具有高结合亲和性,但更小、更稳定,潜在的免疫原性更低。Gregory 等[23]开展的一项在12 例R/R MM 患者评估P-BCMA-101 的安全性和有效性的剂量递增试验提示,其中ORR 为83%,且仅1 例患者出现2 级CRS,未发现神经毒性。该研究表明P-BCMA-101 的新颖设计能产生显著疗效,且具有更少的不良反应,同时这消除了对病毒的需要,成本更低,与相似剂量的其他抗BCMA CAR-T 产品相比具有明显优势。
2.2.5 MCARH171 MCARH171 是由人源的4-1BB共刺激域,CD8α 铰链和跨膜区及截短的EGFR 安全系统组成,在有IL-2 的植物血凝素或CD3/CD28 磁珠培养,通过逆转录病毒载体方式转导[24]。Mailankody等[25]开展的Ⅰ期剂量递增临床试验纳入11 例患者,经环磷酰胺和氟达拉滨预处理后,所有测试剂量水平的ORR 为64%, 接受更高的测试水平(450×106CART 细胞)ORR 为100%,反应持续时间为17~235 天。该研究中,3 例接受最高剂量治疗,反应时间>6 个月,1 例患者在第10 个月时仍具有持续反应,CRS 发生率为60%,其中3 级以上占20%,未发现>3 级的神经毒性。
3 结语与展望
目前,MM 治疗已从传统的联合化疗发展到免疫疗法、细胞疗法等综合治疗方式,随着治疗时间的延长,复发难治性患者成为了临床治疗MM 的新挑战。CAR-T 疗法作为R/R MM 的一种新疗法,在提高缓解率、延长持久性和保障安全性上,是未来CAR-T 设计中最迫切需要解决的问题。研究表明,有效的氟达拉滨和(或)环磷酰胺预处理[26]、阻断免疫检查点(CTLA-4 或PD-1)或将细胞与免疫检查点封锁抑制剂联合使用[27]、调节白介素混合物以影响T 细胞的记忆功能[28]、通过代谢抑制剂或使用不同结构的共同刺激结构域和受体调节代谢途径[29]均可能提高CAR-T免疫疗法的有效性,同时联合γ-促分泌酶抑制剂、来那度胺、伊布替尼在临床上也发现具有可靠的疗效。
目前,虽然靶向BCMA CAR-T 细胞在临床试验中取得了较好的疗效,但在此基础上亟需扩大临床试验例数,进一步验证及探索其在中国R/R MM 患者中的有效性和安全性。随着更多的临床试验开展,CART 治疗将不断完善,为R/R MM 患者的治疗带来新的希望。
