肺腺癌中免疫相关lncRNA的筛查表达与预后分析
2021-09-26方明,袁立,黄龙
方 明,袁 立,黄 龙
(南昌大学第二附属医院肿瘤科,南昌 330006)
肺癌是全球发病率和病死率最高的恶性肿瘤。其中,非小细胞肺癌(NSCLC)约占肺癌的85%[1],而肺腺癌是NSCLC最常见的病理亚型,约占50%[2]。尽管传统治疗及靶向治疗已取得一定成功,但肺癌的五年总生存率仍只有10%~15%[3]。近年免疫相关的靶向治疗如细胞毒性T淋巴细胞相关抗原4、程序性死亡受体1(PD-1)和程序性死亡受体-配体1(PD-L1)的抗体靶向治疗已在许多恶性肿瘤中显示出较好的疗效,在晚期NSCLC的治疗中亦发挥一定的作用[4-5],提示免疫相关的靶向治疗可能在肺癌治疗中具有潜在作用。
LncRNA是长度≥200核苷酸的长链非编码RNA,无或低翻译潜力[6],能在表观遗传、转录和转录后水平调控基因的表达,广泛参与机体的病理生理过程[7-9]。例如,lncRNA可充当转录因子或RNA聚合酶Ⅱ的靶点,破坏它们与靶基因启动子/增强子的结合,从而促进或抑制基因表达[8],而这些靶基因中包含免疫相关的基因。目前,免疫相关的lncRNA在肺腺癌中研究报道较少。本文通过生物信息学分析肺腺癌中免疫相关的lncRNA及其与肺腺癌患者预后的关系,可望为肺腺癌预后判断及治疗提供参考。
1 资料与方法
1.1 资料来源
自美国TCGA数据库(https://cancergenome.nih.gov/)筛选肺腺癌患者的数据资料。入选标准:1)患者资料含转录谱;2)患者临床资料完整。排除标准:1)无生存时间资料的患者;2)生存时间≤30 d的患者。本研究共获得477个肺腺癌的样本资料。
1.2 研究方法
1.2.1 肺腺癌中免疫相关lncRNA的挖掘
1)参照文献[10]的挖掘方法确定lncRNA图谱;2)根据基因的ID将其分为蛋白质编码基因和非编码基因,且仅保留NetAffx注释文件中的长非编码基因;3)从Molecular Signatures Database v7.0中提取免疫基因[11](immune system process M13664,Immune response M19817);4)使用美国Cytoscape软件3.5.0[12]构建免疫-lncRNA共表达网络获得免疫相关的lncRNA(P<0.001)。参照文献[13-15]确定风险评分。患者的风险评分参照以下公式计算:风险值=基因1值×lncRNA1值+基因2值×lncRNA2值+…+基因n值×lncRNAn值。采用单变量Cox回归分析分配风险评分,筛选预后相关lncRNA基因并依据其P值进行升序排列。以P=0.001作为临界值。以中位风险值为界值,将入选的肺腺癌分为低风险组和高风险组。
1.2.2 统计学方法
使用R3.6.1软件和SPSS26.0软件对各患者的基线资料(年龄、性别、TNM分期、T分期、N分期、M分期及风险值)分别进行单变量、多变量Cox回归分析。单变量Cox回归分析用于预测患者生存的预后因素;多变量Cox回归分析用于预测患者生存的独立预后因素。使用R3.6.1软件和limma包进行主成分分析,研究基于免疫基因、免疫相关lncRNA、风险值和全基因表达谱的低、高危人群之间的三维可视化。使用GraphPad Prism 8软件进行Kaplan-Meier生存分析。基因组富集分析(http://www.broadinstitute.org/gsea/index.jsp)分析2组之间的功能注释。以P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA的筛选
数据库挖掘获得14 142个lncRNA和331个免疫相关基因,关联分析获得1133个免疫相关的lncRNA。单因素COX回归分析获得15个免疫相关的lncRNA(图1)。多因素COX回归分析获得6个免疫相关的lncRNA,分别为AL161431.1、AC079949.2、LINC00707、AC010980.2、AC068338.3、AC123595.1。
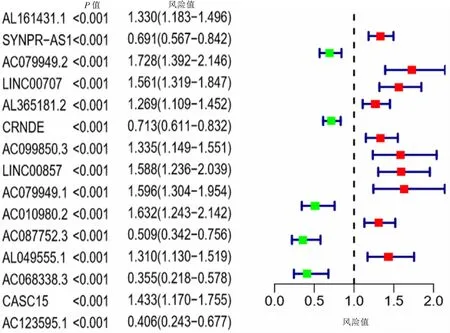
图1 与肺腺癌预后相关的免疫相关lncRNA的风险值(单因素Cox回归分析)
2.2 6个免疫相关lncRNA的表达及其与生存的关系
风险评分结果显示,低风险组和高风险组分别有239例和238例。AL161431.1、AC079949.2、LINC00707和AC010980.2在高风险组表达量高,而AC068338.3、AC123595.1在低风险组表达量高(图2)。随着风险评分递增,死亡人数递增;低风险组总体生存期(OS)较高风险组更长(P<0.000 1),其中5年生存率分别为53.4%和18.2%(图3)。
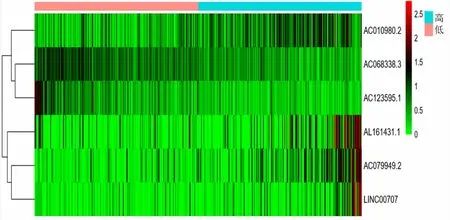
图2 6个lncRNA在高、低风险组中的表达
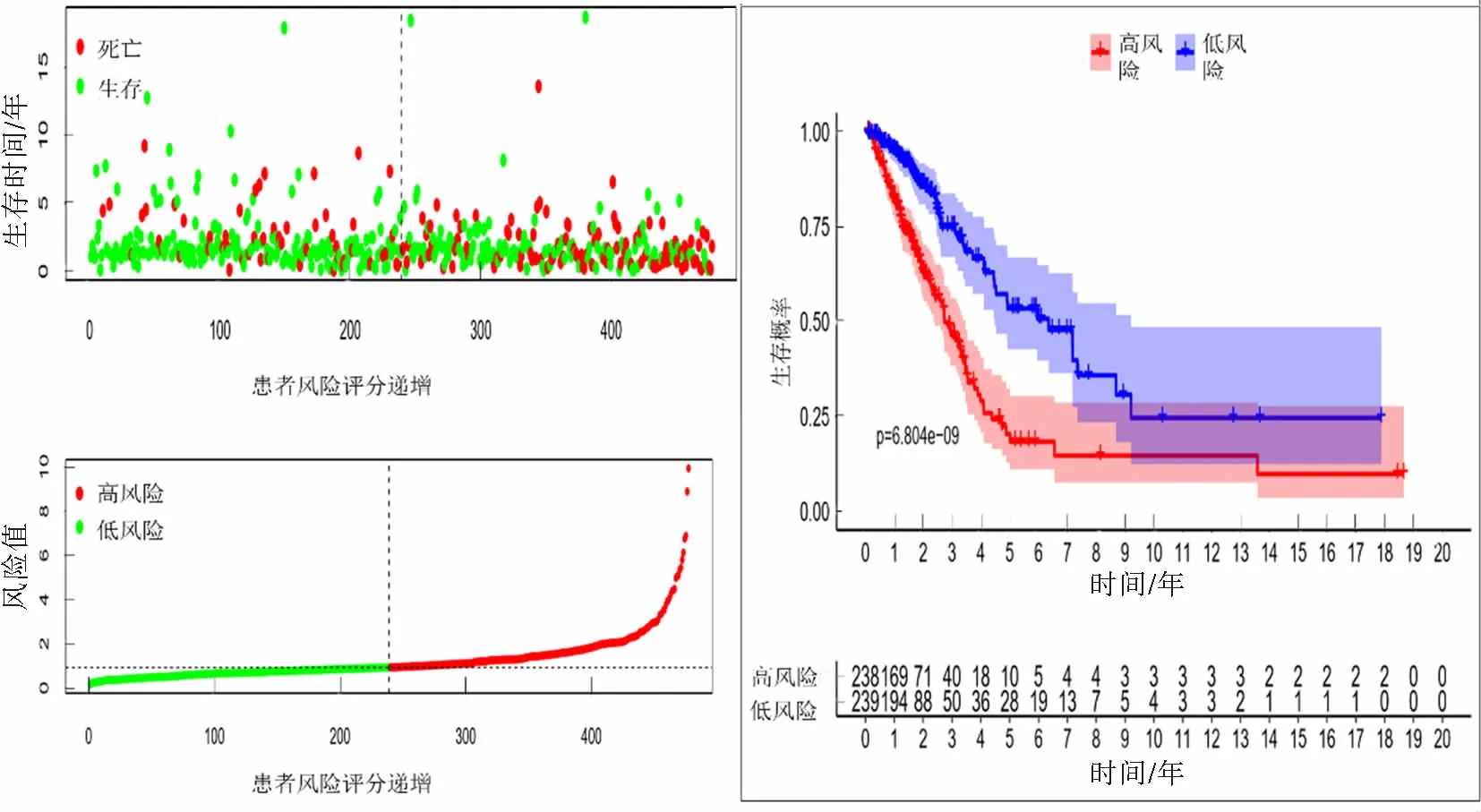
图3 6个lncRNA的表达与患者生存的关系
2.3 Cox回归分析情况
单因素Cox回归分析显示,T分期、TNM分期和风险评分是肺腺癌患者的预后因素;多因素Cox回归分析显示,风险评分和TNM分期是与肺腺癌患者OS相关的独立预后因素。见图4。在6个免疫相关的lncRNA中AC068338.3随着T分期和N分期的升高,其表达量减少;AC010980.2和AC079949.2表达量与性别相关(P<0.01);6个lncRNA表达量与年龄无关(P>0.05)。见图5。
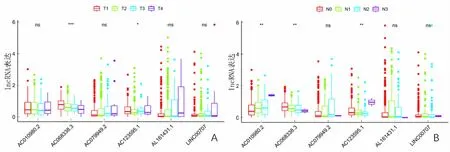
A—F:lncRNA表达依次与T分期、N分期、M分期、TNM分期、年龄和性别的关系。
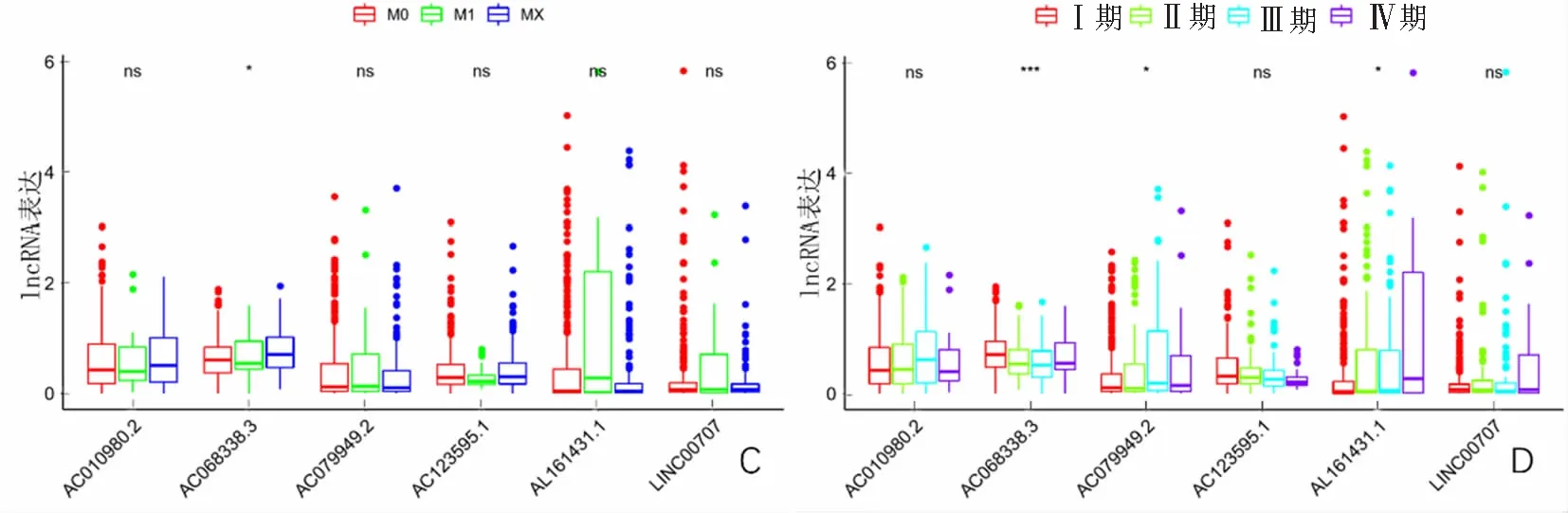
图5(续)
2.4 主成分分析情况
主成分分析显示,2组风险值有显著差别,而免疫基因、免疫相关lncRNA和全基因表达谱相互混合。见图6。
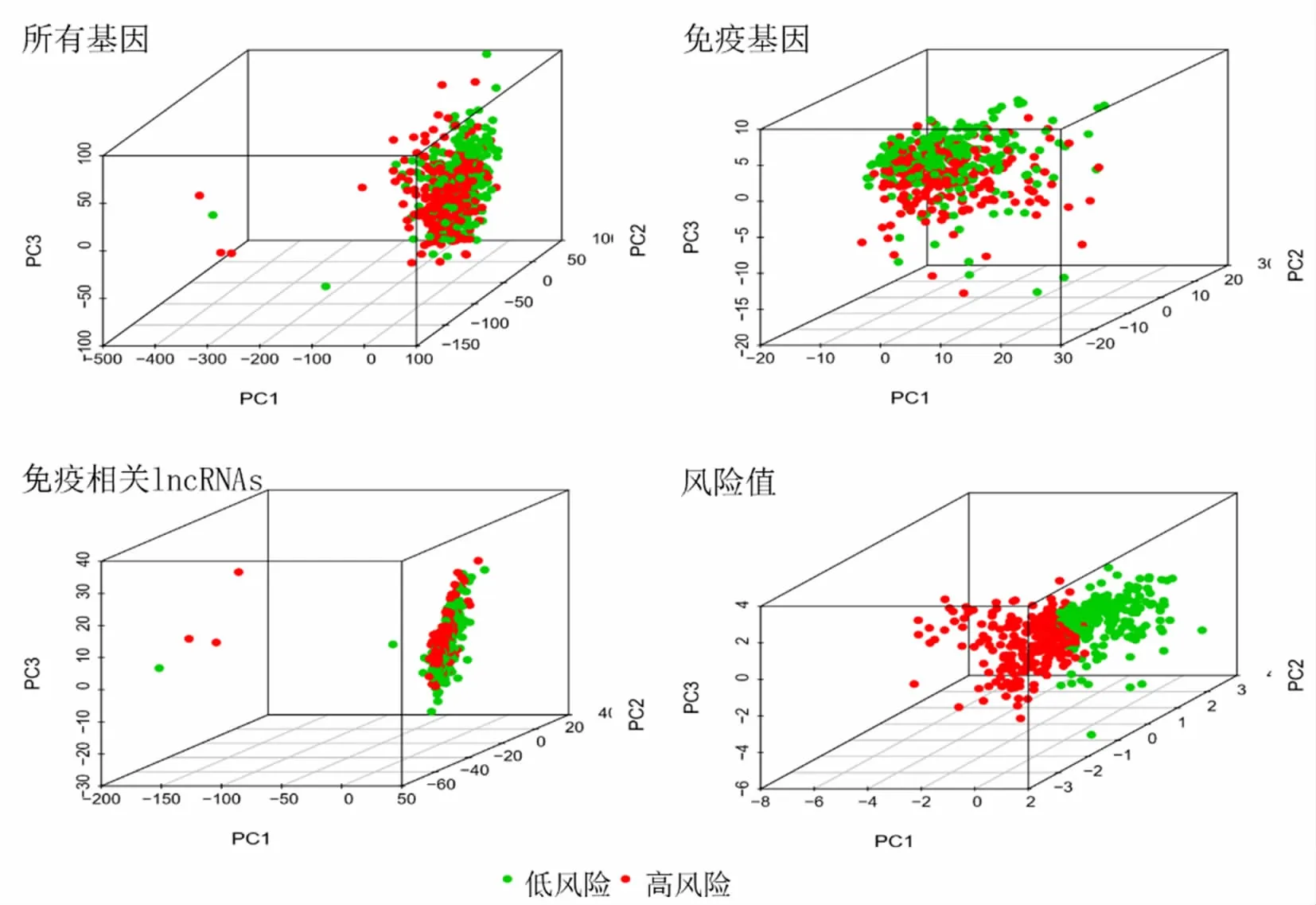
图6 主成分分析
2.5 基因富集分析情况
基因富集分析结果显示,基因功能注释[11,16]表现为高、低风险组在免疫系统过程和免疫应答通路中均有富集。见图7。
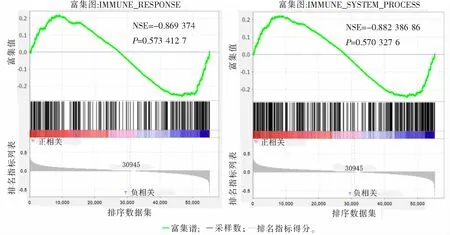
图7 基因富集分析
3 讨论
有研究[17]显示PD-L1作为预测肿瘤免疫治疗疗效的标志物,其特异性并不高。故寻找更为敏感及特异的预后标志物在肿瘤治疗中具有重要意义。lncRNA作为一类癌症预后标志物,对免疫系统的调节也具有重要作用。例如,lncRNA NRON通过隔离细胞质中磷酸化的去磷酸化活化T细胞核因子(NFAT)来维持T细胞的静止状态[18]。本研究发现6个免疫相关的lncRNA即AL161431.1、AC079949.2、LINC00707、AC010980.2、AC068338.3、AC123595.1。其中,有研究[19-22]发现LINC00707作为癌基因,能促进多种癌细胞包括肺腺癌、大肠癌、乳腺癌及肾癌等的增殖;AL161431.1也被证实能促进子宫内膜癌细胞的增殖和迁移[23];AC123595.1被认为用于评估乳腺癌的预后[24]。本研究依据风险评分将肺腺癌分为高、低风险组,多因素Cox回归分析发现风险评分是与肺腺癌患者OS相关的独立预后因素。
lncRNA与免疫相关的肿瘤微环境的关系密切。免疫相关的lncRNAs在免疫细胞中呈较高的表达,并与免疫细胞浸润显著相关。而有研究[25-26]显示肿瘤浸润淋巴细胞增多和CD4+/CD8+T细胞比例升高均与非小细胞肺癌的良好预后和生存有关。此外,lncRNAs不仅影响骨髓细胞的分化、发育及免疫细胞中炎症基因的表达[27],也参与免疫细胞的调节回路。LINC00301通过靶向TGF-β增加调节性T细胞数量,同时降低CD8+T细胞数量[28]。本研究获得的6个免疫相关lncRNA中AC079949.2、AC010980.2、AC068338.3和AC123595.1在肺癌领域尚未被研究,LINC00707和AL161431.1作为免疫相关的癌基因,是否参与肿瘤微环境中免疫细胞的激活仍有待进一步研究。此外,本研究发现AC068338.3随着肺腺癌的T和N分期的升高而表达下降,提示其可能是潜在的抑癌基因。与本研究相似,LI等[29]发现2个免疫相关lncRNA簇,其中簇1代表更高的突变频率,特别是突变基因,也能预测肺腺癌预后。PAGS等[30]采用免疫评分作为结肠癌患者复发风险的预测指标,发现免疫评分高的患者5年复发的风险最低。提示本研究中的6个免疫相关的lncRNA可能通过调节免疫微环境影响肺腺癌预后。
综上,本研究确定了6个与肺腺癌免疫相关的lncRNA,并发现其可预测肺腺癌患者预后,有助于指导临床实践。但本研究存在一定的局限性。例如,单因素及多因素COX回归分析显示肺腺癌患者M分期与其预后不相关,这与临床实践不符,可能与M1期患者例数较少(24例)而M0期患者例数较多(322例)有关。
