创制非天然辅酶偏好型甲醇脱氢酶
2021-09-24王俊婷郭潇佳李青万里赵宗保
王俊婷,郭潇佳,李青,万里,赵宗保
(1 中国科学院大连化学物理研究所,辽宁 大连 116023;2 中国科学院大学,北京 100049)
甲醇是大宗有机一碳化合物,全球年产量达6000 万吨,有望成为未来生物炼制产业的重要原料[1-2]。煤、天然气、页岩气和CO2等通过化学法可规模化制备甲醇,而在废物处理和垃圾填埋场中,厌氧消化产生的甲烷和合成气,也可进一步转化为甲醇[3]。通过改造甲基营养型微生物或重建甲基利用途径,构建了一系列以甲醇为原料的微生物细胞工厂[4-5]。甲醇氧化酶将甲醇氧化为甲醛为代谢提供碳源,同时产生过氧化氢,后者需要消耗额外能量予以清除[6]。烟酰胺腺嘌呤二核苷酸(NAD,图1)依赖型甲醇脱氢酶(MDH)也可氧化甲醇合成甲醛,同时生成化学计量的NADH 可作为代谢的还原力[7]。来源于嗜热脂肪芽孢杆菌Bacillus stearothermophilusDSM2334 的NAD 依赖型MDH(BsMDH,UniProt:P42327.1)对甲醇亲和力较高[8],Km为20 mmol/L[7]。目前文献中研究较多的NAD 依赖型MDH 包括BsMDH 和Bacillus methanolicus(BmMDH)[6],而BmMDH对甲醇的Km为132 mmol/L[1,9],其对甲醇的亲和力比BsMDH 更低。除此之外,还有来源于谷氨酸棒杆 菌Corynebacterium glutamicum的MDH 的Km也在97 mmol/L 左右;来源于钩虫贪铜菌Cupriavidus necatorN-1 的MDH 与BmMDH 相似,对甲醇的亲和力在132 mmol/L 左右,且对ACT 不敏感;来源于解木糖赖氨酸芽孢杆菌Lysinibacillus xylanilyticus的MDH 的Km在3 mmol/L 左右,虽然对甲醇的亲和力相对较高,但其最适反应条件为pH9.5 和55 ℃,不符合大肠杆菌的最适生长条件[10]。研究表明,BsMDH 易于在大肠杆菌中过量表达,已成功用于构建利用甲醇的工程菌株[11-12]或基于甲醇的胞外氧化还原体系[13]。
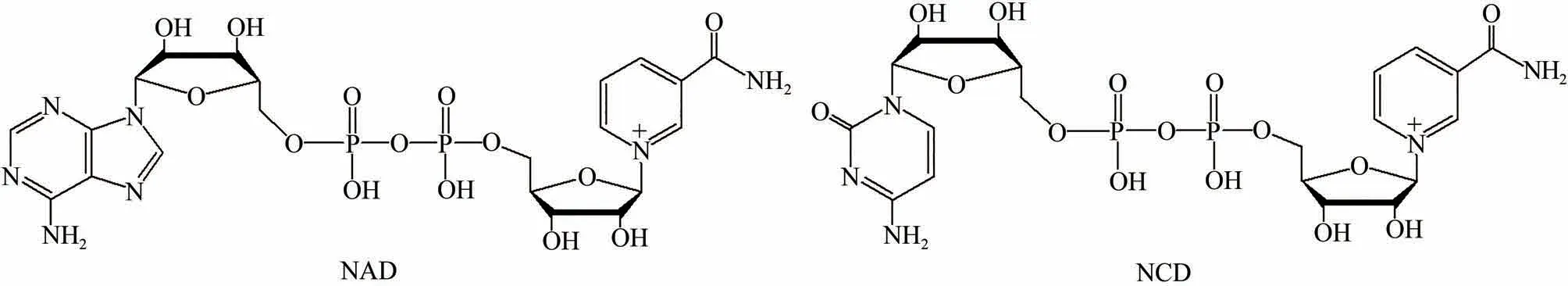
图1 NAD及NCD的结构Fig.1 Structures of NAD and NCD
NAD 及其还原型NADH 是胞内重要的辅因子,广泛参与氧化还原代谢反应[14]。NAD(H)还可以参与其他生物学过程如细胞繁殖、生长、分化和凋亡等[15]。调控胞内NAD(H)水平是代谢工程及合成生物研究中改善宿主性能的常用手段,获得过大量成功案例[16]。然而,NAD(H)水平扰动可对胞内代谢反应产生复杂且难以预测的影响[17-18]。利用NAD 类似物,可提高催化效率、促进辅因子循环再生或提高生物催化反应[19-20]。虽然一些结构简化的NAD 类似物可用于体外酶催化,但在胞内应用需特别考虑生物兼容性,如氧化还原电位、溶解性以及结构单元是否易于生物合成等[21]。此外,也有研究尝试将NAD 生物合成前体如烟酰胺单核苷酸(NMN)和化学修饰的NAD 类似物用做非天然氧化还原辅酶[22-23]。本课题组早期合成了一系列具有生物活性的NAD 类似物[24-26],其中烟酰胺胞嘧啶二核苷酸(NCD,图1)与NAD 在结构上存在一个碱基差异。以NAD 依赖型苹果酸酶为模型,改造筛选获得了系列偏好NCD 的苹果酸酶突变体[27],通过改造亚磷酸脱氢酶和甲酸脱氢酶的辅酶结合口袋,均得到了偏好NCD 的突变体,并成功构建了NCD 介导的、正交于内源氧化还原辅酶的代谢线路[28-29]。最近,也有研究尝试构建基于NMN[30]及其他烟酰胺衍生物[21]的氧化还原催化体系,并取得了有价值的成果[31]。这些研究不断丰富氧化还原催化元件,对合成生物学领域发展具有重要意义。
本研究的目的是改造BsMDH 的辅酶结合口袋,筛选获得偏好NCD 的突变体,为构建利用甲醇的新型氧化还原催化体系及微生物细胞工厂提供功能元件。
1 材料和方法
1.1 材料
1.1.1 菌株与质粒
构建文库及蛋白质表达及纯化时所用宿主为大肠杆菌BL21(DE3)。密码子优化的BsMDH 编码基因[8]由Synbio Technologies合成,并已克隆在表达质粒pTrc99K-MDH[32]。
1.1.2 培养基
LB 培养基:氯化钠10 g/L,胰蛋白胨10 g/L,酵母提取物5 g/L。
TB 培养基:胰蛋白胨12 g/L,酵母提取物24 g/L,甘油4 mL/L,磷酸二氢钾0.017 mol/L,磷酸氢二钾0.072 mol/L。
1.1.3 主要试剂和仪器
试剂:NBT(硝基四氮唑蓝)、PMS(酚嗪硫酸甲酯)、溶菌酶、MTT(噻唑蓝)、PES(酚嗪硫酸乙酯)、NAD 等购自北京鼎国昌盛生物技术公司。NCD由本实验室合成[6]。
仪器:全波长酶标扫描仪(PowerWave XS,Bio-Tek Instruments Inc.,USA);蛋白结构模拟工具Swiss model和MOE(CCG,Montreal,Canada);高通量细胞培养与活性分析系统(Beckman)。
1.2 文库构建及筛选
1.2.1 结构模拟及分子对接
以序列相似度58% 的醇脱氢酶(PDB ID:3s2e)的晶体结构为模板,用蛋白质结构同源性模型服务器(SWISS-MODEL)模拟BsMDH 的结构[33],用软件PyMOL 分析结构确定突变氨基酸残基的空间位置并作图[34]。用MOE 进行分子对接和结构分析。分子对接:BsMDH 为受体,NCD 为配体,NAD 空腔为配体结合位点,对接选择默认方法,其中放置方法为Triangle Matcher,优化方法为Rigid Recepter,打分方法为London dG 和GbBVI/WSA dG,pose 值分别设置为300 和50,虚拟筛选设计方法选择Residue Scan,筛选方法选择LowMode,突变位点选择1个。
突变体的分子对接利用MOE 进行,分别将BsMDH、突变体3-1 和9D1 与NAD 和NCD 对接。首先利用BsMDH 的晶体结构(PDB:6IQD)对接NAD 和NCD。参照来源于Pseudomonas aeruginosa的醇脱氢酶(PDB:1LLU)中NAD 的结合区域,对接BsMDH 和NAD、NCD,配体放置方法为Triangle Matcher,优化方法为Rigid Recepter,打分方法为London dG 和GbBVI/WSA dG,pose 值分别设置为100 和20。对于突变体,首先利用SWISS-MODEL 对突变体3-1 和9D1 建模,然后按照类似的方法与NAD和NCD对接。
1.2.2 突变位点选择
基于NCD 与NAD 的结构差异,推测通过改变氧化还原酶NAD 腺嘌呤结合空腔大小来实现辅酶偏好性的改变,选择辅酶腺嘌呤0.8 nm 范围内的氨基酸残基,进行单独或组合突变。
1.2.3 文库构建
利用96 孔板的筛选技术构建饱和突变文库[35],由于密码子的简并性,选择NNK(N 为A,G,T,C;K为G,T)代替原来的3个碱基覆盖所有可能的氨基酸,即用32 个密码子可代表20 种氨基酸。使用不依赖于限制性内切酶的克隆(RF 克隆)方法[36]构建文库,对于单位点突变,设计具有简并密码子NNK的引物,然后进行RF克隆;对于多位点突变,首先扩增具有简并密码子的片段,然后进行RF 克隆。构建文库时,以携带野生型MDH 的质粒用作模板,将PCR 产物在37 °C 用DpnI 处理2 h,然后将其转化进大肠杆菌BL21(DE3)细胞中,待转化子长出。
1.2.4 文库筛选
为提高获得最优结果的概率,构建在每个位点都覆盖所有氨基酸的突变体文库,然后进行筛选[37-38]。利用NBT-PMS 偶联用方法,根据570 nm光吸收变化测定甲醇脱氢酶的活性[39-40]。按文献方法估算拟筛选的转化子数目[41],保证覆盖相应文库理论值的95%。
初筛在96孔板(每孔400 μL培养液),复筛在24孔板(每孔2.5 mL菌液),25 ℃培养48 h;离心去上清,每孔加入细胞裂解液100 μL,在-80 ℃冻17~18 h,然后37 ℃裂解2 h。显色体系为HEPES(pH7.5)50 mmol/L,异丙醇13 mmol/L 或甲醇50 mmol/L,NBT 100 μmol/L,PMS 30 μmol/L,上清液10 μL。显色时,初筛体系中添加NCD,复筛时设置2 个体系,分别加NCD 和NAD。辅酶浓度在0.1 mmol/L以上,根据文库及活性情况而调整。
1.2.5 粗酶活测定
取上清粗酶液10 μL,在酶标板上分别进行与NAD 和NCD 的反应,在570 nm 下测定光密度变化[28]。测定结果以每分钟光密度的变化表示粗酶活(mOD570/min)。每个样品3 个平行。体系为HEPES(pH7.5)50 mmol/L,NAD、NCD 的浓度根据酶对辅因子的活性而调整,异丙醇13 mmol/L或甲醇50 mmol/L,MTT 400 μmol/L,PES 1 mmol/L,粗酶液10 μL。鉴于MDH 以异丙醇为底物时催化活性更高[32],在MDH活性筛选时,均首先以异丙醇为底物,再以甲醇进行复筛和验证。
1.3 动力学测定
1.3.1 蛋白纯化
突变体用LB 培养,WT 用TB 培养,添加50 μg/mL 卡那霉素,9D1 添加0.05 mmol/L IPTG,3-1 及其他突变体都添加0.1 mmol/L IPTG。纯化(采用Invitrogen 的Ni-NTA 纯化系统)时,菌体加入NBB 缓冲液(50 mmol/L NaH2PO4,0.5 mol/L NaCl,pH8.0)超声破碎,14 000 r/min离心30 min,上清液移到再生好的柱中,过夜静置结合,用NWB缓冲液洗出杂蛋白,NEB 缓冲液(50 mmol/L NaH2PO4,0.5 mol/L NaCl,250 mmol/L 咪 唑,pH8.0)洗出目的蛋白,将目的蛋白洗脱液用10 kDa超滤管超滤浓缩,保存在20%甘油中,-80 ℃保存。
1.3.2 酶动力学测定
酶循环法测定MDH 突变体的动力学,检测条件为25 ℃,检测波长570 nm[40]。酶活测定体系:HEPES(pH7.5)50 mmol/L,甲醇800 mmol/L,MTT 400 μmol/L,PES 1 mmol/L,NAD 或NCD 的浓度呈梯度变化,加超纯水至100 μL,每个样品3 个平行。分别将各酶稀释不同的倍数用于NAD或NCD 检测[28]。利用Origin8.5 拟合米氏方程。根据kcat=Vm/[E]([E]为酶浓度)计算kcat。
酶活力单位定义为每分钟产生1 μmol NADH或NCDH所需的酶量。比酶活按以下公式计算:
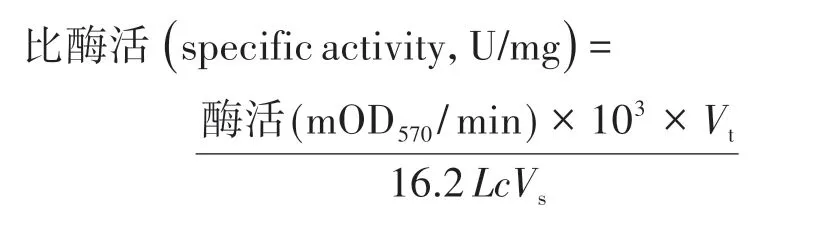
式中,Vt为反应总体积,mL;L为光程,cm;Vs为加入酶的体积,mL;c为反应体系中酶的浓度,mg/mL。
实验用酶标扫描仪测酶循环法产生的甲䐶,其消光系数为16.2 L/(mmol·cm)。生成甲䐶的量与产生的NADH或NCDH存在严格的计量关系。
2 结果与分析
2.1 虚拟筛选
分析MDH 结构[图2(a)],NAD 腺嘌呤0.8 nm 范围内氨基酸位点有21 个,分别是I170、Y171、G172、I173、G174、V194、D195、I196、K200、L216、I235、S236、V237、A238、V239、N240、K241、K242、A243、F244、Q246。在筛选前,先使用MOE软件进行了虚拟筛选[图2(b)、(c)],当∆Affinity 大于0 时,表明亲和力降低,当∆Affinity小于0时,表明亲和力提高。其中对NAD亲和力下降的包括:G172、I196、V237、A238、V239、N240、A243;而对NCD 亲和力上升的包括Y171、S197、K200、V237、A238、N240、K242、A243、F244。显然,V237、A238、N240和A243可能在降低对NAD亲和力的同时,提升对NCD的亲和力。

图2 BsMDH结构模拟及辅酶结合性能虚拟筛选结果Fig.2 Structural modelling of MDH and virtual screening results with different cofactors
2.2 文库构建及筛选
对MDH 位点的选择主要依赖于分析晶体结构中氨基酸残基与NAD 腺嘌呤的空间相对位置[42],再结合晶体中氨基酸残基与NAD 腺嘌呤相互作用分析,采用迭代饱和突变和组合突变等方法对突变文库进行半理性设计[43-44]。
对2.1 中所述位点进行饱和突变,按照流程[图3(a)]构建11 个单位点文库及4 个双位点文库,从第1 轮文库筛选中得到4C1 和3D2。经过测序,4C1携带K242H/A243S突变;3D2携带V237T突变。粗酶活结果(图3)中,以异丙醇为底物时3D2 的NCD/NAD 值提高了2 倍,而以甲醇为底物时提高了50%。所得结果包括V237和A243位点突变,与虚拟筛选结果相符。
继续以4C1 和3D2 为模板,选取NAD 腺嘌呤周围0.8 nm的其他位点,构建突变体文库。然而以4C1为模板构建3个双位点文库和11个单位点文库,并没有得到更偏好NCD 的突变体;而在以3D2 为模板构建3个双位点文库和10个单位点文库时,得到两个更好的突变体:3F1和5D3。其中,3F1携带V237T/N240E 突变,5D3 携带V237T/N240V 突变。粗酶活分析表明,3F1 和5D3 相比于3D2,其对NAD的活性降低了50%[图3(b)、(c)]。3F1 和5D3均在相同位点突变,表明V237和N240位点对于辅酶偏好性有重要贡献。
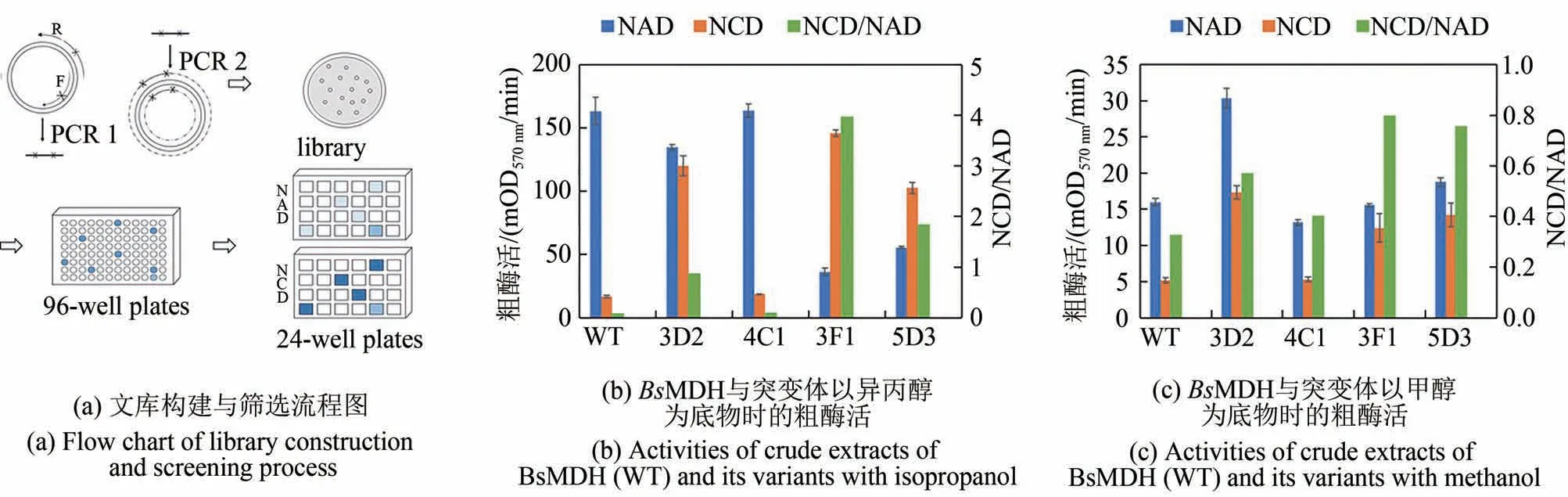
图3 文库筛选及粗酶活分析结果Fig.3 Library screening and activities of crude extracts
2.3 辅酶结合空腔改造
2.3.1 MDH辅酶结合空腔结构分析
分析MDH 的结构表明,V237 和N240 分别处于NAD 腺嘌呤平面的两个方向。鉴于NAD 和NCD 的重要区别在于腺嘌呤比胞嘧啶基团空间更大,如果在腺嘌呤周围选择3个方向的位点进行突变,就可能更好地改变辅酶结合空腔大小,获得辅酶结合空腔缩小不利于NAD 结合但适合NCD 的突变体。通过分析MDH 结构,并根据已有筛选经验[27],推测第3个方向的位点可能是Y171或I196。
2.3.2 单位点突变优化辅酶结合空腔
根据上述推测和筛选的初步结果,基于位点Y171、I196、V237 和N240,设计了8 种MDH 突变体,即1-1~1-4 和2-1~2-4,以引入体积相对较大、极性的氨基酸侧链[图4(a)]。在大肠杆菌中表达这些突变体,并分别以异丙醇和甲醇为底物,以NAD 和NCD 为辅酶,进行了粗酶活分析。结果发现,除1-3 外,这些突变体与WT 比利用NAD和NCD的活性均降低到20%以下[图4(b)、(c)],暗示所引入的突变可能导致辅酶结合空腔过于拥挤,不利于NAD 或NCD 结合。因此,选择具有大侧链的K241 位点,将其突变为侧链较小的丙氨酸A,构建了5种组合突变,即3-1、3-2、3-3、3-4和3-5。幸运的是,以异丙醇为底物时,突变体3-1利用NCD的粗酶活显著高于其他突变体,而利用NAD 的粗酶活很低,表现出明显的NCD 偏好性[图4(b)]。以甲醇为底物时,3-1 利用NCD 比NAD具有稍高的粗酶活。

图4 BsMDH及突变体粗酶活分析结果Fig.4 Results of activity assay of crude extracts of BsMDH and its variants
虽然粗酶活分析表明突变体3-1已具有NCD 偏好性,但其I196 位点尚未优化。因此,以突变体3-1 为模板,构建了I196 饱和突变文库,筛选得到突变体9D1,其NCD/NAD 粗酶活比进一步提高,而对NAD 的活性显著降低。测序分析表明,9D1携带5 个位点突变,即Y171R/I196V/V237T/N240E/K241A。
2.4 突变体的酶学性质
2.4.1BsMDH突变体偏好NCD
在大肠杆菌中表达MDH WT 及突变体3D2、3F1、3-5、3-1 和9D1,纯化得到重组蛋白。以甲醇为底物,分别以NAD 和NCD 为辅酶,分别进行酶催化反应动力学分析,实验数据见表1。
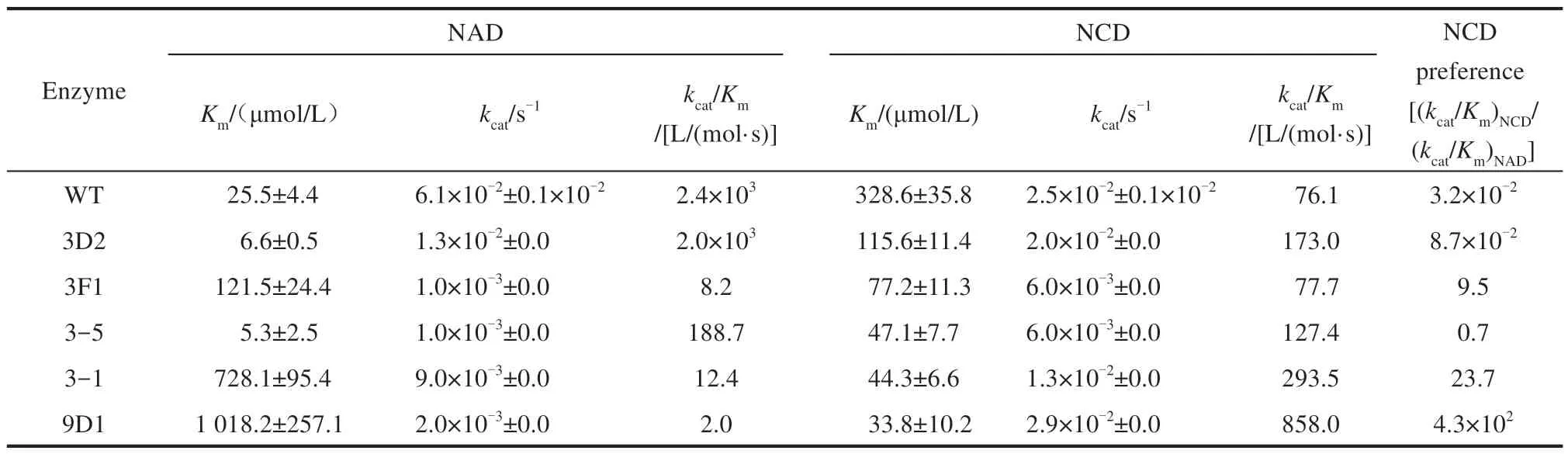
表1 MDH及突变体催化甲醇氧化的动力学数据Tab.1 Kinetic data of methanol oxidation catalyzed by MDH variants
首先分析以NAD 为辅酶的催化性能。除突变体3D2 和3-5 外,其他3 个突变体比WT 有更高的Km值,表明其对NAD 的亲和力降低;而所有突变体均比WT 具有更低的kcat值,表明突变体的催化速率下降。总体上,以NAD 为辅酶时,突变体的催化效率(kcat/Km)最低降到WT 的0.1%以下。以NCD 为辅酶的催化性能变化趋势相反。突变体比WT有更低的Km值,表明其对NCD 的亲和力增强;但突变体的催化速率与WT 的相当,均在10-2s-1量级。但由于Km值降低较多,突变体9D1利用NCD的催化效率比WT提高仍然达10倍以上。突变体9D1对NAD 的Km值约1.0 mmol/L,对NCD 的Km值约为30 μmol/L;利用NCD 的催化效率为858 L/(mol·s),是利用NAD 的300 倍。用(kcat/Km)NCD/(kcat/Km)NAD来表示酶的NCD 偏好性,WT 与9D1 的NCD 偏好性分别为3.2×10−2和4.3×102,提高了13 000 倍;而突变体3-1 的NCD 偏好性则相对提高了740 倍。更重要的是,突变体9D1和3-1利用NCD的催化速率与WT 利用NAD 的催化速率均在10−2s−1量级,表明它们不仅具有很好的NCD 偏好性,还保留了较高的催化活性。总体而言,成功获得了NCD 偏好型MDH突变体9D1。
2.4.2BsMDH突变体的稳定性
初步比较了WT和突变体9D1在不同条件下的酶活性。结果表明,WT 与9D1 在25 ℃环境下酶活性呈现相同的变化趋势,5 h 后均能保持55%以上活性[图5(a)]。在37 ℃,pH9.0 的条件下孵育2 h 后,WT 和9D1 均能保留酶活60%以上。此外,它们在37 ℃下比30 ℃或25 ℃下具有更高活性[图5(b)];在pH9.0 比pH5.0 或7.0 的缓冲体系中活性更高[图5(c)],即环境因素对酶活性的影响趋势相同。可见,突变体9D1 除辅酶偏好性改变外,稳定性基本未受到影响。
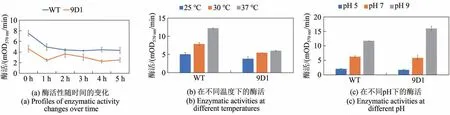
图5 不同条件下BsMDH及突变体9D1的活性Fig.5 Enzymatic activity of BsMDH(WT)and variant 9D1 under different conditions.
2.5 辅酶结合空腔结构变化
对BsMDH 和突变体3-1、9D1 进行分子对接,分别对接NAD 和NCD,并分析辅酶结合空腔大小。从图6 可以看出,BsMDH 中Y171、I196 和N240形成的空腔远大于突变体3-1和9D1中相应残基形成的空腔。BsMDH 中Y171 和I196 之间的距离为0.81 nm,而突变体3-1 中R171 和I196 之间的距离缩短到0.38 nm,突变体9D1 中R171 和V196之间的距离为0.37 nm。此外,Y171R 突变是辅酶结合空腔变小的主要原因。由于NAD 的腺嘌呤结构在空间上大于NCD 的胞嘧啶结构,突变体辅酶结合空腔变小导致难以结合NAD,而有利于结合NCD。初步说明辅酶结合空腔变小是MDH 突变体偏好非天然辅酶NCD 的主要原因。这较好地吻合了亚磷酸脱氢酶辅酶偏好性改造研究中通过突变体-NCD复合物晶体结构分析观察到的现象[45]。
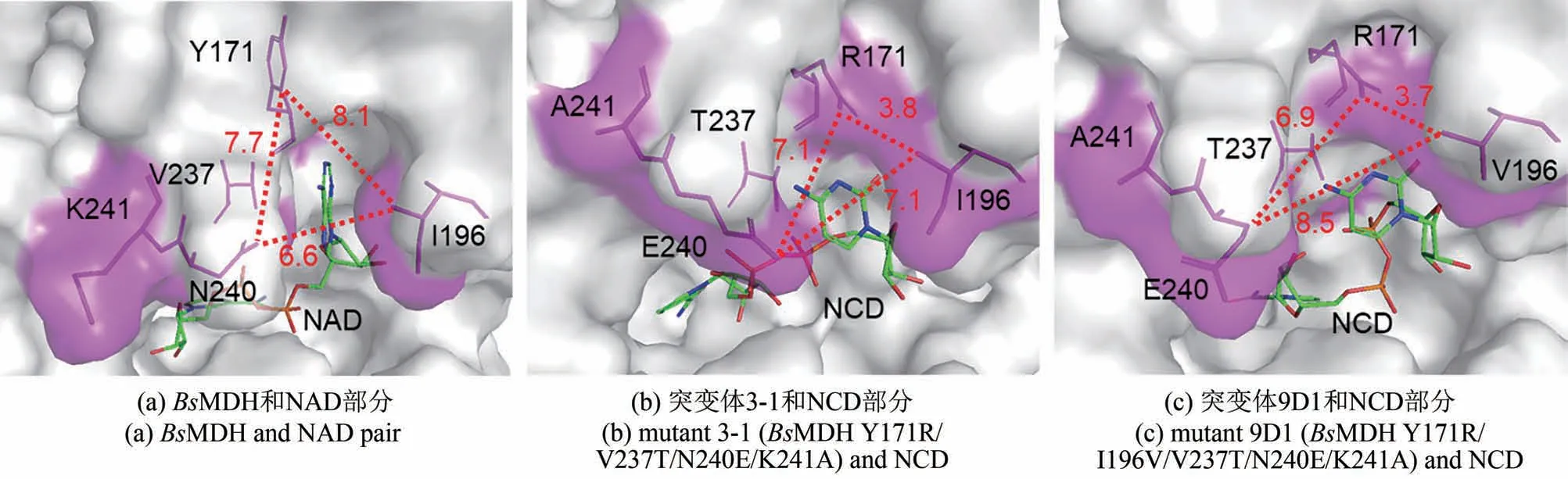
图6 不同酶-辅酶组合的分子对接结果Fig.6 Docking results of different enzyme-cofactor pairs binding pocket
3 结论与展望
本文以NAD 依赖型甲醇脱氢酶BsMDH 为模板,模拟并分析了MDH 结构后,借助虚拟筛选参考了一部分会对其辅酶偏好性产生影响的位点,而后通过对腺嘌呤0.8 nm 范围的位点进行了文库构建及筛选,确定了V237和N240位点对辅酶偏好性的影响,从而进一步分析MDH 结构,对Y171、I196 等位点进行了定点突变,最终成功得到偏好非天然辅酶NCD 的突变体。通过分析实验数据,得到以下结论:
(1)鉴于NCD 的结构小于辅酶NAD,将改造MDH 辅酶偏好性的重点放在缩小MDH 辅酶结合空腔上。通过模拟BsMDH 的结构并确定NAD 的结合模式,从而确定了与腺嘌呤相距0.8 nm 范围内氨基酸位点;通过构建突变体文库、筛选和理性预测指导定点突变,最终得到偏好NCD 的突变体。通过对突变体9D1 和3-1 与NAD 和NCD 的分子对接,发现BsMDH 中Y171、I196 和N240 形成的空腔远大于突变体3-1 和9D1 中相应残基形成的空腔,进一步说明改造辅酶结合空腔对辅酶偏好性的重要性。
(2)酶催化反应动力学数据表明,以NAD 为辅酶时,突变体3F1、3-1 和9D1 比WT 有更高的Km值和更低的kcat值,表明这3 种突变体对NAD 的亲和力降低和催化速率下降。WT 与9D1 对NCD的偏好性分别为3.2×10-2和4.3×102,酶的NCD 偏好性提高达13000 倍;同样,与WT 比,突变体3-1 的NCD 偏好性提高了740 倍。此外,突变体利用NCD 的催化速率与WT 利用NAD 的催化速率均在10-2s-1量级,表明它们保留了较高催化活性。
基于本文成果,未来可开展以下更深入的研究:
(1)改造其他氧化还原酶的辅酶偏好性。本文改造MDH 辅酶偏好性的经验和流程,可能应用于其他NAD 依赖型氧化还原酶如甲醛脱氢酶等。事实上,本文及前期改造苹果酸酶[27]、亚磷酸脱氢酶[45]和甲酸脱氢酶[46]的系列研究表明,在结构分析和半理性设计指导下,在辅酶结合空腔选择位点,构建突变体文库并筛选,并最终得到具有高NCD 偏好性的突变体,通常均包含一些新引入的大侧链极性氨基酸突变。本研究的中后期,采用单位点突变方法构建13 种突变体的实验,正是基于上述经验。因此,预计未来将其他NAD 依赖型氧化还原酶改造为NCD 偏好性的研究进程将变得更加有效和精准。
(2)构建基于甲醇的新型氧化还原催化体系。甲醇可分3 步逐级生物氧化为CO2,每步反应均有相应辅酶依赖型氧化还原酶从而产生计量的还原型辅酶。本研究得到NCD偏好型MDH将甲醇氧化为甲醛,而此前的研究已获得NCD 偏好型甲酸脱氢酶[29,46]。未来如果将甲醛脱氢酶的辅酶偏好性也予以改造并获得NCD 偏好型突变体,即可构建以甲醇为还原性底物的NCDH 供给体系,用于选择性为特定代谢反应或途径提供还原力。本课题组认为,这种基于甲醇的NCDH 供给体系,与此前构建的基于亚磷酸[7]和甲酸[8]的体系相比,更加绿色并具有更好的经济性。
总之,NCD偏好型MDH 突变体将可作为独特的合成生物学功能元件,用于构建新型氧化还原催化体系和先进微生物细胞工厂。
