何首乌中1个新的木脂素酰胺类化合物
2021-09-23杨建波高慧宇王雪婷宋云飞段宝忠程显隆胡笑文马双成
杨建波,高慧宇,王雪婷,宋云飞,段宝忠,程显隆,魏 锋*,王 莹,汪 祺,胡笑文,马双成*
1.中国食品药品检定研究院 中药民族药检定所,北京 100050
2.大理大学药学院,云南 大理 671000
何首乌为蓼科植物何首乌Polygonum multiflorumThunb.的干燥块根,生何首乌味苦、甘、涩,微温,归肝、心、肾经,具有解毒、消痈、截疟、润肠通便等功效,可用于疮痈、风疹瘙痒和润肠通便等[1],主要分布于我国贵州、四川、云南、安徽和广东等地,其中广东肇庆市德庆县为传统道地产区[2-3]。何首乌被广泛应用于处方药、非处方药和保健食品中,含有何首乌的药品约有500余种、保健食品约有200余种[4]。然而,近年来,国内外关于服用何首乌及其相关制剂引发的不良反应,尤其肝损伤的不良反应报道较多,其安全性问题已经引起国内外高度关注[5-6]。
目前,从何首乌中提取分离得到约200个单体化合物,主要为蒽醌(单核蒽醌和双核蒽醌)类、二苯乙烯类、萘类、黄酮类和其他类成分[7-13],其中双核蒽醌为本课题组首次从何首乌中分离得到,主要有polygonumnolide A1~A4、polygonumnolide B1~B3[9]、polygonumnolide C1~C4[10]、polygonumnolide E[11]、顺式-大黄素二蒽酮和反式-大黄素二蒽酮[13]。何首乌中潜在的肝毒性成分,可能为蒽醌类(包括大黄素等单核蒽醌和大黄素二蒽酮等双核蒽醌)、二苯乙烯苷类和没食子酸类等成分[5,14-16]。其中关于何首乌中二蒽酮成分为其潜在肝毒性成分,为本项目组首次报道。所以,一方面为了进一步丰富何首乌中的化学成分种类;另一方面,也为了继续寻找何首乌中潜在的肝毒性成分。本课题组继续对何首乌70%乙醇提取部分进行化学成分研究,分离得到8个化合物,分别鉴定为(E)-2- (4-hydroxy-3-methoxyphenyl)-3-[N-2-(4-hydroxyphenyl) ethyl]carbamoyl-5-[N-2-(4-hydroxyphenyl)ethyl] carbamoylethenyl-7-methoxybenzofuran(1)、cannabisin D(2)、grossamide(3)、eleutherinol(4)、isolariciresinol(5)和N,N-二甲基-色氨酸甲酯(N,N-dimethyl-tryptophan methyl ester,6)、N-反式-阿魏酰酪胺(N-trans-feruloyltyramine,7)和N-反式阿魏酰-3-甲氧基酪胺(N-trans-feruloyl-3-methyl dopamine,8)。其中,化合物1为新的木脂素酰胺类化合物,命名为何首乌庚素。化合物2~6均为首次从该药材中分离得到,并通过二维核磁谱补充了化合物4和6的核磁数据。化合物1对正常人L02肝细胞具有较强的抑制作用。
1 仪器与材料
岛津UV-2700型紫外可见分光光度计(日本岛津仪器有限公司);IM-PACT400型傅里叶变换红外光谱仪(美国尼高力公司);布鲁克Avance-500和600型核磁共振波谱仪(德国布鲁克公司);安捷伦HP1200高效液相色谱仪(美国安捷伦公司);岛津LC-6AD型制备高效液相色谱仪(日本岛津公司);C18反相填料(日本YMC公司);MCI GEL CHP20P填料(日本三菱化学公司);EYELASB-1000旋转蒸发仪(日本EYELA公司);DM-8型大孔吸收树脂(津达正源化工);酶标仪(Bio-Tek);二氧化碳培养箱(Bio-Tek);QUINTIX313-1CN型万分之一电子天平(德国Sartorius公司);正常人L02肝细胞,上海陶术生物科技有限公司;高糖DMEM培养基(货号06-1055-57-1ACS,BI公司)、RPMI1640(货号01-100-1ACS,BI公司)、FBS(货号FB-1058/500,Biosera公司)、CCK-8试剂盒(货号C0005,上海陶素生化科技有限公司);0.25%胰酶- EDTA(货号325-043-CL,维森特生物技术公司);常规试剂为分析纯,高效液相用试剂为色谱纯。
实验用何首乌样品于2013年10月采集于广东省肇庆市德庆县,经中国食品药品检定研究院张继副研究员鉴定为何首乌P.multiflorumThunb.的干燥块根,样品标本(No.060104)保存于中国食品药品检定研究院。
2 提取与分离
取何首乌干燥块根28 kg,粉碎,用70%乙醇加热回流提取3次,每次2 h,提取液减压回收溶剂得浸膏4.0 kg。将浸膏于1.5 L水中混悬,用二氯甲烷萃取,剩余水部分,再加水稀释至10 L,过DM-8型大孔吸附树脂,依次用不同体积分数的乙醇洗脱,得到5个不同组分,分别为水洗脱部分(组分A,2.0 kg)、25%乙醇(组分B,62.0 g)、40%乙醇(组分C,200.0 g)、55%乙醇(组分D,38.0 g)和95%乙醇洗脱部分(组分E,55.0 g)。组分B(62.0 g)经ODS中压柱色谱,依此用10%~100%甲醇洗脱,再经过反相硅胶薄层色谱检测、合并,共获得20个亚组分,分别为B1~B20。其中亚组分B2(3.5 g),经过半制备液相分离纯化,流动相 [乙腈-水(35∶65)],检测波长为230 nm,体积流量为5.0 mL/min,得到化合物7(tR=28 min,29.0 mg)、8(tR=34 min,7.5 mg)。其中亚组分B5(5.0 g),经过半制备液相分离纯化,流动相[甲醇-水(32∶68),检测波长为230 nm,体积流量为5.0 mL/min,得到化合物5(tR=33.0 min,3.0 mg)、6(tR=41.0 min,3.5 mg)。组分B10(6.5 g),用水溶解,过MCI树脂,依此用不同浓度甲醇洗脱,得到5个不同组分,依此为水洗脱部分(组分B10A)、30%甲醇(组分B10B)、50%甲醇(组分B10C)、70%甲醇(组分B10D)和100%甲醇洗脱(组分B10E)。组分B10B,经过半制备液相分离纯化,流动相 [乙腈-水(30∶70)],检测波长为230 nm,体积流量为5.0 mL/min,得到化合物2(tR=32.0 min,2.5 mg)和3(tR=39.0 min,3.0 mg)。组分B10C,经过半制备液相分离纯化,流动相 [乙腈-水(40∶60)],检测波长为230 nm,体积流量为5.0 mL/min,得到化合物1(tR=35.0 min,4.0 mg)和4(tR=43.0 min,3.0 mg)。
3 结构鉴定
化合物1:淡黄色无定形粉末。HR-ESI-MS显示准分子离子峰m/z: 623.237 9 [M+H]+(计算值623.238 8),提示该化合物分子式为C36H34N2O8,不饱和度为21。UV光谱显示其在224、252、310 nm处有最大吸收;IR光谱在3459、1657、1609、1538 cm-1有吸收峰,提示其含有羟基和酰胺基[12]。
1H-NMR(表1)和1H-1H COSY谱(图1)中显示该化合物含有2个酰胺基 [δH8.10 (t,J= 4.8 Hz,α-NH),3.37 (2H,m,H-8′′),2.67 (2H,t,J= 7.2 Hz,H-7′′); 8.50 (t,J= 4.8 Hz,β-NH),3.49 (2H,m,H-8′′′),2.77 (2H,t,J= 7.2 Hz,H-7′′′)];2组AA′BB′偶合系统的芳香氢信号 [δH7.03 (2H,d,J= 8.4 Hz,H-2′′/6′′),6.69 (2H,d,J= 8.4 Hz,H-3′′/5′′); 7.06 (2H,d,J= 8.4 Hz,H-2′′′/6′′′),6.89 (2H,d,J= 8.4 Hz,H-3′′′/5′′′)];1组ABX偶合系统的芳香氢信号 [δH7.46 (1H,d,J= 1.8 Hz,H-2′),7.31 (1H,dd,J= 8.4,1.8 Hz,H-6′),6.89 (1H,d,J= 8.4 Hz,H-5′) ];1组AX偶合系统的芳香氢信号 [δH7.17 (1H,s,H-2),7.24 (1H,s,H-6)];1组反式双键 [δH7.49 (1H,d,J= 15.6 Hz,H-7),6.64 (1H,d,J= 15.6 Hz,H-8)] 和2个甲氧基 [δH4.01 (3H,s,Me-3),3.81 (3H,s,Me-3′)]。化合物1的13C-NMR、HSQC以及DEPT数据分析,发现有36个碳信号,其中15个季碳,包括2个羰基信号 [δC165.0(C-9),163.1(C-9′)];4个亚甲基信号,包括2组AX偶合系统的脂肪族亚甲基的碳信号 [δC34.4 (C-7′′) 和40.7 (C-8′′);34.1 (C-7′′′) 和40.9 (C-8′′′)];15个次甲基信号,包括2组AA′BB′偶合系统的芳香环上的碳信号 [δC115.1 (C-3′′/5′′) 和129.5 (C-2′′/6′′);115.2 (C-3′′′/5′′′) 和129.5 (C-2′′′/6′′′)];1组ABX偶合系统的芳香环上的碳信号δC110.7 (C-2′),115.8 (C-5′),120.5 (C-6′);1组AX偶合系统的芳香环上的碳信号δC106.2 (C-2),112.1 (C-6) 和1组反式双键的碳信号δC138.9 (C-7),121.6 (C-8) 以及2个甲氧基碳信号δC55.9 (C-3),55.6 (C-3′)。
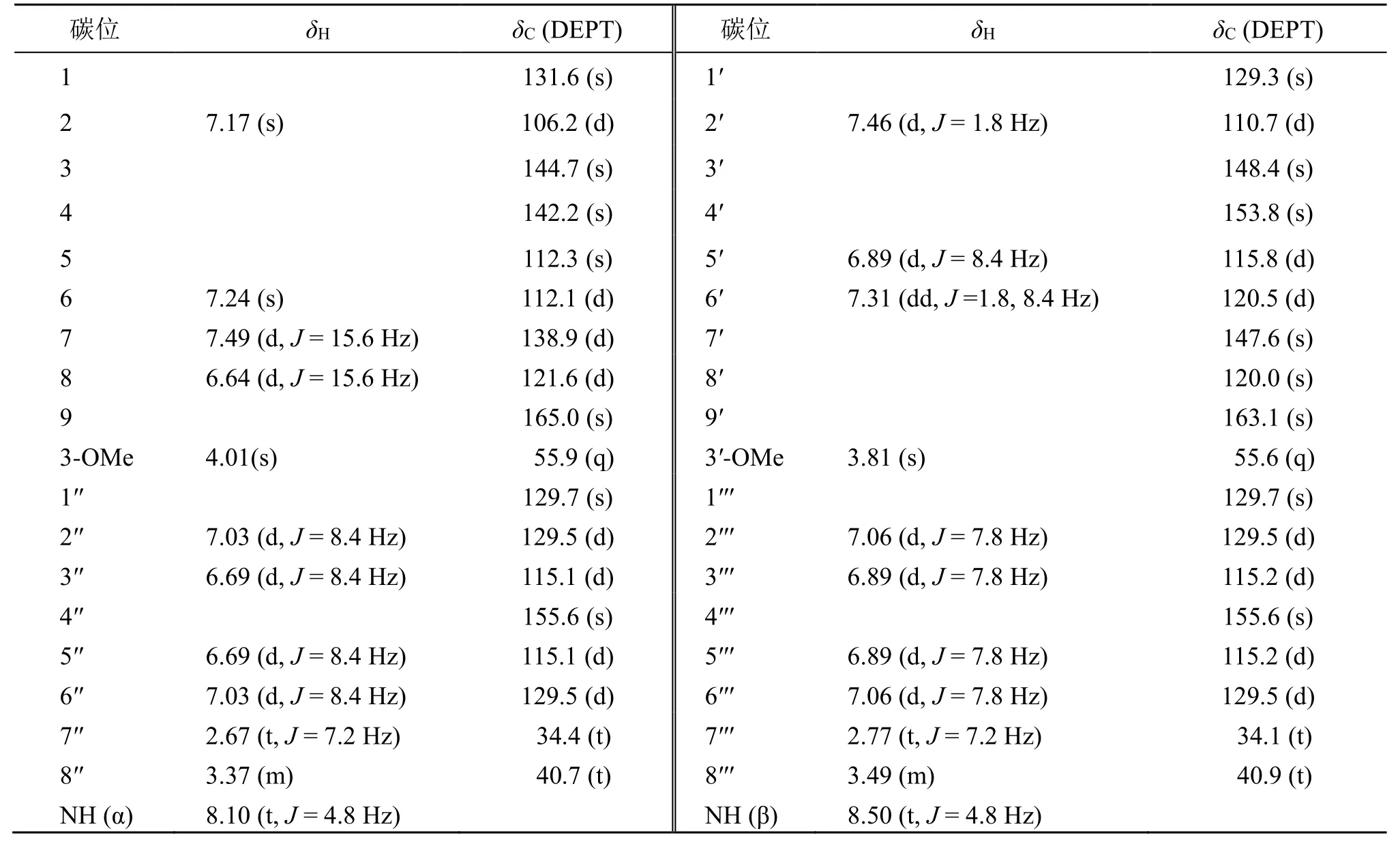
表1 化合物1的氢谱和碳谱数据 (600/150 MHz,DMSO-d6)Table 1 1H and 13C-NMR spectral data of compound 1 (600/150 MHz,DMSO-d6)
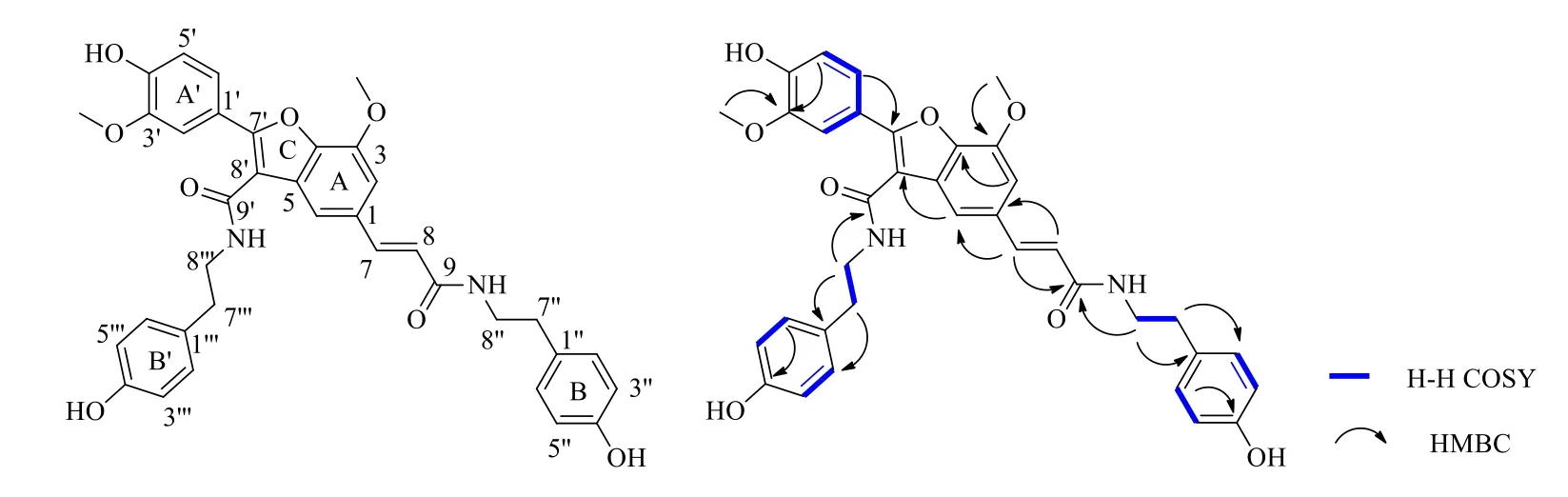
图1 化合物1的结构和1H-1H COSY、HMBC图谱Fig.1 Structure and 1H-1H COSY,HMBC correlations of compound 1
在HMBC图谱中(图1),δH7.31 (H-6′) 与δC147.6 (C-7′) 相关,δH6.89 (H-5′) 与δC148.4 (C-3′)相关,说明化合物1的A′苯环中C-1′位连接在C环的C-7′位。δH3.49 (H-8′′′) 与δC163.1 (C-9′),129.7 (C-1′′′) 相关,δH2.77 (H-7′′′) 与δC115.2 (C-3′′′) 相关,说明化合物1的B′苯环中C-1′′′位连接在C-7′′′位,C-9′连接在C环的C-8′位。δH7.17 (H-2) 与δC142.2 (C-4) 相关,δH7.24 (H-6) 与δC120.0 (C-8′)相关,δH7.49 (H-7) 与δC112.1 (C-6),165.0(C-9)相关,δH6.64 (H-8) 与δC131.6 (C-1) 相关,说明C-7为连接在A环的C-1位,C-9连接在C环的C-8位。δH3.37 (H-8′′) 与δC165.0 (C-9),129.7 (C-1′′) 相关,δH2.67 (H-7′′) 与δC115.1 (C-3′′) 相关,说明化合物1的B苯环中C-1′′位连接在C-7′′位。δH4.01 (Me-3) 与δC144.7 (C-3) 相关,δH3.81 (Me-3′) 与δC148.4 (C-3′) 相关,说明化合物1的B苯环中C-1′′位连接在C-7′′位。
综合上述信息,确定化合物1为N-反式-阿魏酰酪胺的二聚体,结构为(E)-2-(4-hydroxy-3- methoxyphenyl)-3-[N-2-(4-hydroxyphenyl)ethyl]carba moyl-5-[N-2-(4-hydroxyphenyl)ethyl]carbamoylethenyl- 7-methoxybenzofuran,为1个新化合物,命名为何首乌庚素。
化合物2:淡黄色固体粉末。ESI-MSm/z:625.3 [M+H]+。1H-NMR (600 MHz,DMSO-d6)δ: 7.23 (1H,s,H-4),6.96 (2H,d,J= 8.4 Hz,H-2′′,6′′),6.84 (1H,s,H-5),6.86 (2H,d,J= 8.4 Hz,H-2′′′,6′′′),6.70 (1H,d,J= 1.8 Hz,H-2′),6.65 (2H,d,J= 8.4 Hz,H-3′′′,5′′′),6.62 (2H,d,J= 8.4 Hz,H-3′′,5′′),6.55 (1H,d,J= 8.4 Hz,H-5′),6.50 (1H,s,H-8),6.25 (1H,dd,J= 8.4,1.8 Hz,H-6′),4.23 (1H,d,J= 2.4 Hz,H-1),3.78 (3H,s,3-OMe),3.68 (3H,s,3′-OMe),3.60 (1H,d,J= 2.4 Hz,H-2),3.24 (2H,m,H-8′′),3.10 (2H,m,H-8′′′),2.61 (2H,t,J= 7.8 Hz,H-7′′),2.43 (2H,t,J= 7.2 Hz,H-7′′′);13C-NMR (150 MHz,DMSO-d6)δ: 170.9 (C-2a),167.6 (C-3a),155.6 (C-4′′),155.6 (C-4′′′),147.7 (C-6),147.2 (C-3′),146.2 (C-7),145.0 (C-4′),135.0 (C-1′),131.7 (C-4),131.3 (C-8a),129.6 (C-1′′),129.5 (C-1′′′),129.5 (C-2′′),129.5 (C-2′′′),129.5 (C-6′′),129.5 (C-6′′′),126.5 (C-3),122.9 (C-4a),119.6 (C-6′),116.2 (C-5′),115.1 (C-3′′),115.1 (C-3′′′),115.0 (C-5′′),115.0 (C-5′′′),112.1 (C-8),111.8 (C-5),55.7 (3-OMe),55.6 (3′-OMe),47.8 (C-2),41.2 (C-1),40.9 (C-a′),40.4 (C- a),34.3 (C-β),34.3 (C-β′)。以上数据与文献对照[17],鉴定化合物2为cannabisin D。
化合物3:淡黄色固体粉末。ESI-MSm/z:623.2 [M-H]-;1H-NMR (600 MHz,DMSO-d6)δ: 7.35 (1H,d,J= 15.6 Hz,H-1′′′′),7.05 (1H,s,H-6),7.01 (2H,d,J= 8.4 Hz,H-2′′′′′,6′′′′′),6.89 (1H,d,J= 1.8 Hz,H-2′),6.79 (1H,d,J= 8.4 Hz,H-5′),6.72 (1H,dd,J= 8.4,1.8 Hz,H-6′),6.78 (2H,d,J= 8.4 Hz,H-3′′′,5′′′),6.73 (2H,d,J= 8.4 Hz,H-2′′′,6′′′),6.69 (2H,d,J= 8.4 Hz,H-3′′′′′′,5′′′′′′),6.46 (2H,d,J= 15.6 Hz,H-2′′′′),6.39 (1H,s,H-4),5.88 (1H,d,J= 8.4 Hz,H-2),4.18 (1H,d,J= 8.4 Hz,H-3),3.91 (3H,s,7-OMe),3.83 (3H,s,3′-OMe),3.66 (2H,m,H-1′′),3.62 (2H,m,H-1′′′′′),2.64 (2H,t,J= 7.8 Hz,H-2′′),2.58 (2H,t,J= 7.8 Hz,H-2′′′′′);13C-NMR (150 MHz,DMSO-d6)δ: 169.9 (3-CONR),165.7 (2′′′′-CONR),156.1 (C-4′′′′′′),156.1 (C-4′′′),149.2 (C-8),148.1 (C-3′),147.3 (C-4′),144.5 (C-7),141.1 (C-1′′′′),131.1 (C-1′),130.3 (C-1′′′′′′),130.0 (C-2′′′,6′′′),129.9 (C-1′′′),129.8 (C-2′′′′′′,6′′′′′′),129.7 (C-5),129.0 (C-9),119.3 (C-6′),119.0 (C-4),118.8 (C-2′′′′),116.4 (C-3′′′,5′′′),115.6 (C-3′′′′′′,5′′′′′′),115.5 (C-5′),110.8 (C-6),110.4 (C-2′),88.2 (C-2),56.3 (C-3),56.2 (3′-OMe),56.2 (7-OMe),41.3 (C-1′′′′′),41.1 (C-1′′),34.9 (C-2′′′′),34.7 (C-2′′)。以上数据与文献对照基本一致[18-19],故确定化合物3为grossamide。
化合物4:淡黄色固体粉末。ESI-MSm/z:257.0 [M+H]+;1H-NMR (600 MHz,DMSO-d6)δ: 7.20 (1H,s,H-4),6.58 (1H,s,H-5),6.57 (1H,s,H-7),6.18 (1H,s,H-12),2.72 (3H,s,3-Me),2.38 (3H,s,13-Me);以上数据与文献报道的数据基本一致[20],但是未见该化合物的碳谱文献报道,通过二维谱对化合物碳谱数据进行了归属,具体如下:13C-NMR (150 MHz,DMSO-d6)δ: 178.9 (C-11),163.8 (C-1),163.8 (C-13),159.7(C-6),157.1 (C-8),139.0 (C-10),134.7 (C-3),125.1 (C-4),116.6 (C-2),112.4 (C-12),107.5 (C-9),103.3 (C-7),101.5 (C-5),23.4 (Me-3),19.9 (Me-13)。故鉴定化合物4为eleutherinol。
化合物5:淡黄色固体粉末。ESI-MSm/z:361.2 [M+H]+;1H-NMR (600 MHz,CD3OD)δ: 6.69 (1H,d,J= 1.8 Hz,H-2),6.75 (1H,d,J= 7.8 Hz,H-5),6.63 (1H,dd,J= 1.8,7.8 Hz,H-6),3.82 (1H,m,H-7),1.78 (1H,m,H-8),3.41 (1H,dd,J= 3.6,10.8 Hz,H-9α),3.68 (1H,dd,J= 5.4,10.8 Hz,H-9β),6.67 (1H,s,H-2′),6.19 (1H,s,H-5′),2.79 (1H,d,J= 7.8 Hz,H-7′),2.02 (1H,m,H-8′),3.66 (1H,dd,J= 4.8,7.8 Hz,H-9′α),3.72 (1H,dd,J= 4.8,10.8 Hz,H-9′β),3.78 (3H,s,3-OMe),3.82 (3H,s,3′-OMe);13C-NMR (150 MHz,CD3OD)δ: 149.0 (C-3),147.2 (C-3′),146.0 (C-4),145.3 (C-4′),138.6 (C-1),134.2 (C-6′),129.0 (C-1′),123.2 (C-6),117.4 (C-5′),116.0 (C-5),113.8 (C-2),112.4 (C-2′),65.9 (C-9′),62.2 (C-9),56.4 (3′-OMe),56.3 (3-OMe),48.1 (C-7),48.0 (C-8),40.0 (C-8′),33.6 (C-7′)。以上数据与文献对照[21-22],确定化合物5为isolariciresinol。
化合物6:白色固体粉末。HR-ESI-MSm/z:247.143 9 [M+H]+(计算值247.144 1),分子式为C14H18O2N2;1H-NMR (600 MHz,CD3OD)δ: 7.63 (1H,d,J= 8.4 Hz,H-2),7.34 (1H,d,J= 8.4 Hz,H-5),7.18 (1H,s,H-7),7.11 (1H,t,J= 8.4 Hz,H-4),7.05 (1H,t,J= 8.4 Hz,H-3),3.88 (1H,t,J= 7.2 Hz,H-10),3.41 (2H,d,J= 7.2 Hz,H-9),3.25 (9H,s,Me-12,13,14)。以上数据与文献报道的核磁数据基本一致[23-24],但是未见该化合物的碳谱文献报道,通过二维谱对化合物碳谱数据进行了归属,具体如下:13C-NMR (150 MHz,CD3OD)δ: 171.7 (C-11),138.1 (C-6),128.3 (C-1),122.6 (C-4),125.1 (C-7),120.0 (C-3),119.1 (C-2),112.4 (C-5),109.0 (C-8),80.6 (C-10),52.7 (C-12),52.7 (C-13),52.6 (C-14),24.6 (C-9)。故鉴定化合物6为N,N-二甲基-色氨酸甲酯。
化合物7:白色固体粉末。ESI-MSm/z:314.14 [M+H]+;1H-NMR (400 MHz,DMSO-d6)δ: 7.26 (1H,d,J= 15.7 Hz,H-7),7.07 (1H,d,J= 2.0 Hz,H-2),7.00 (2H,d,J= 7.8 Hz,H-2′,6′),6.94 (1H,dd,J= 8.4,2.0 Hz,H-6),6.74 (1H,d,J= 8.4 Hz,H-5),6.64 (2H,d,J= 7.8 Hz,H-3′,5′),6.38 (1H,d,J= 15.7 Hz,H-8),3.76 (3H,s,3-OMe),3.28 (2H,m,H-8′),2.60 (2H,t,J= 7.4 Hz,H-7′);13C-NMR (150 MHz,DMSO-d6)δ: 165.8 (C-9),156.2 (C-3),148.3 (C-4'),148.8 (C-4),139.4 (C-7),130.1 (C-1'),130.0 (C-2',C-6'),127.0 (C-1),122.0 (C-6),119.6 (C-8),116.2 (C-5),115.6 (C-3',5'),111.3 (C-2),56.0 (3-OMe),41.2 (C-8'),35.0 (C-7')。以上数据与文献对照[25-26],故鉴定化合物7为N-反式-阿魏酰酪胺。
化合物8:白色固体粉末。ESI-MSm/z:344.13 [M+H]+;1H-NMR (600 MHz,CD3OD)δ: 7.44 (1H,d,J= 15.6 Hz,H-7′),7.10 (1H,s,H-2′),7.00 (1H,d,J= 7.8 Hz,H-6′),6.81 (1H,s,H-2),6.79 (1H,d,J= 7.8 Hz,H-5),6.71 (1H,d,J= 7.8 Hz,H-5′),6.64 (1H,d,J= 7.8 Hz,H-6),6.41 (1H,d,J= 15.6 Hz,H-8′),3.86 (3H,s,3′-OMe),3.82 (3H,s,3-OMe),3.48 (2H,t,J= 7.2 Hz,H-8) ,2.76 (2H,t,J= 7.2 Hz,H-7)。以上数据与文献对照[25],故鉴定化合物8为N-反式阿魏酰-3-甲氧基酪胺。
4 生物合成途径
本项目组从何首乌中,首次分离得到N-反式-阿魏酰酪胺的3个二聚体和1个三聚体[13],发现其均为何首乌中微量成分,初步推测这些聚合物在何首乌中可能的生物合成途径,见图3。
5 对正常人L02肝细胞活性的影响
5.1 细胞培养
参考文献方法[27-28]:取正常人L02肝细胞,在37 ℃和5%二氧化碳条件下,培养于含10%的胎牛血清的高糖DMEM培养基中,待细胞长满培养皿80%~90%,用0.25%胰酶消化细胞,然后用新的培养基将细胞重悬,将细胞按适当比例传代,取对数生长细胞进行实验。
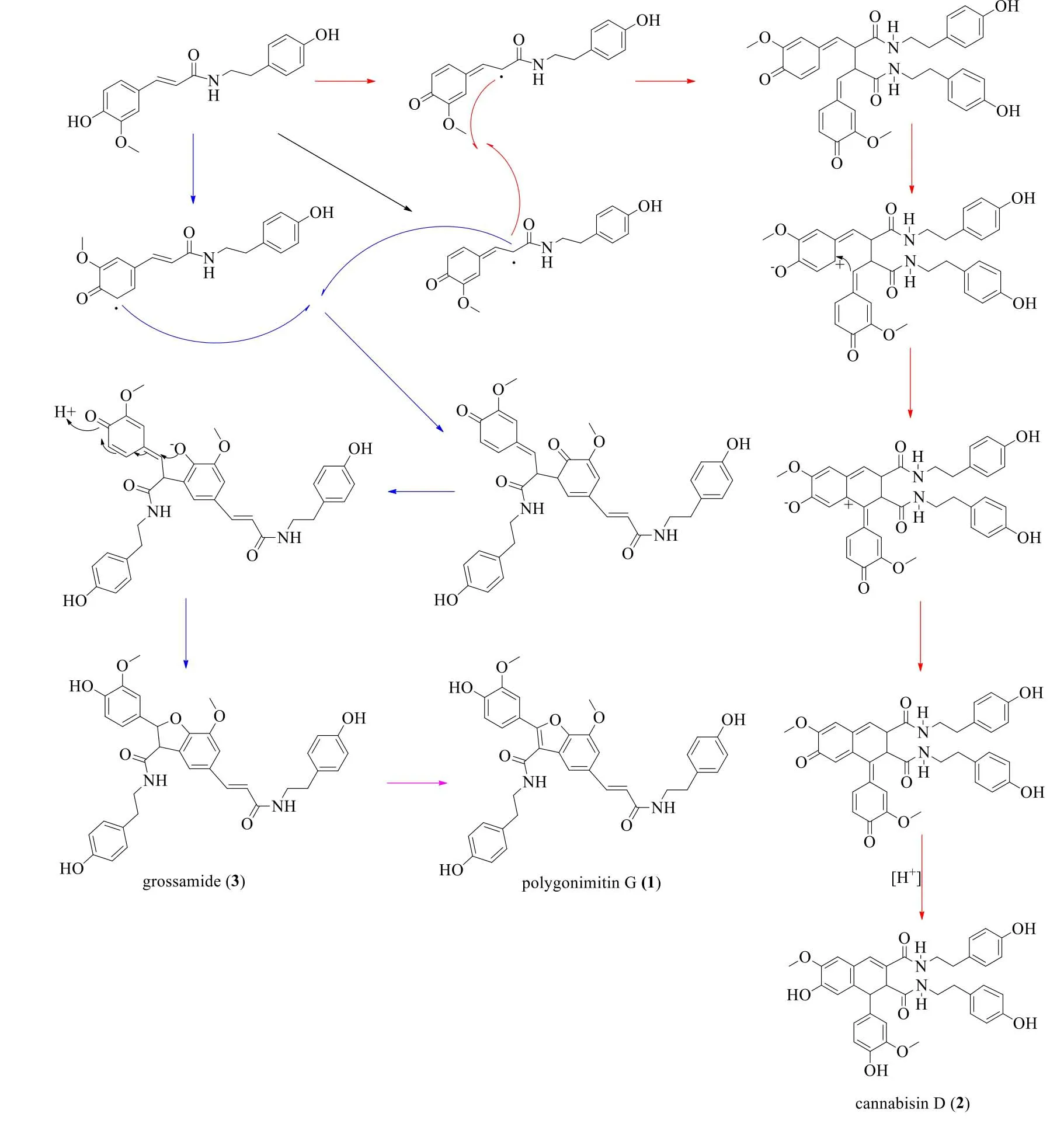
图3 化合物1~3的可能生物合成途径Fig.3 Plausible biogenetic route for compounds 1—3
5.2 样品溶液的配制
取化合物1、7和8适量,精密称定,加DMSO溶解,初始质量浓度为500.0 μg/mL,5倍梯度稀释,共计7个质量浓度梯度,分别为500.0、100.0、20.0、4.0、0.8、0.16和0.032 μg/mL,重复3次。
5.3 细胞生长抑制率测定
采用CCK8法,将肝细胞密度(800细胞/孔)接种于384孔细胞板中,每孔接种40 μL细胞悬液,细胞板置于37 ℃、5% CO2培养箱,孵育24 h。每孔加入10 μL化合物1、7、8的样品溶液,37 ℃、5% CO2培养箱,避光孵育72 h。孵育后,向细胞板中加入CCK8,5 μL/孔,置于37 ℃、5% CO2培养箱中孵育4 h(注意避光),然后在酶标仪中检测吸光度(A)值,吸收波长设为450 nm,按照公式计算细胞的抑制率。结果发现,化合物1、7和8对L-02细胞的IC50值,分别为(3.02±1.20)、(190.35±5.39)和(300.61±16.27)μmol/L。
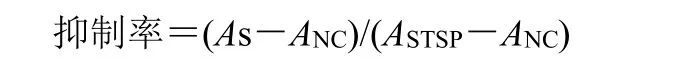
As为样品孔的A值(待测化合物);ANC为阴性孔A值(细胞+培养基+DMSO);ASTSP为星孢菌素(STSP)孔A值(细胞+培养基+10 μmol/L STSP)
6 讨论
目前,从何首乌中仅分离得到N-反式-阿魏酰酪胺、N-反式阿魏酰-3-甲氧基酪胺、N-反式咖啡酰酪胺、cannabisin D、grossamide、polygonimitin G和polygonimitin F等7个木脂素酰胺类成分,但化合物量较少,提示其可能为何首乌中一类新的微量成分。polygonimitin G(1)与N-反式-阿魏酰酪胺(7)和N-反式阿魏酰-3-甲氧基酪胺(8)相比,具有更强的L-02细胞抑制作用,提示该类化合物可能具有一定的潜在肝毒性。另据文献报道[13,29-31],该类成分还具有保肝、调血脂、抗肿瘤、抗氧化和抗炎等活性,所以,有必要对其进行全合成研究,从而进一步系统评价该成分的肝毒性和生物活性。
利益冲突所有作者均声明不存在利益冲突
