内生真菌对高寒草地紫花针茅凋落物分解的影响
2021-09-22宋梅玲王玉琴王宏生鲍根生
宋梅玲,王玉琴,王宏生,鲍根生
(省部共建三江源生态与高原农牧业国家重点实验室,青海大学畜牧兽医科学院,青海省高寒草地适应性管理重点实验室,青海西宁810016)
凋落物分解是陆地生态系统中碳素周转和矿质养分循环的重要过程[1],并且具有调节土壤有机物组成的作用[2],是释放矿质养分供植物生长的重要过程,并由此影响陆地生态系统净生产力[3]。凋落物分解率可以被生物和非生物因素所影响,决定分解率的因素主要有3个,分别为气候因素(如温度和水分)、凋落物质量(如化学成分)以及分解生物的特性和数量(如细菌、真菌和土壤无脊椎动物)[4]。最初的凋落物质量(如:C/N、纤维素、木质素)可以影响参与凋落物分解的微生物的多度、组成和活性,而这些也反过来决定凋落物的分解速率和养分循环[5]。
近年来,各国学者对于内生真菌与其宿主植物(禾草)和食草动物之间的相互关系及其在不同生态环境中的多样性已开展了大量的研究[6-9]。内生真菌与禾草在生态系统中维持着一种互利共生的关系,对于内生真菌来说,宿主禾草保证了其在植物体内生长所必需的营养物质和可靠有效的传播,而对于禾草来说,内生真菌通过其自身产生的次生代谢物保护了植物,使其免受外界环境胁迫的危害[10-11]。这种共生关系已经被证明可以影响生态系统过程,如土壤呼吸、凋落物分解等[12-13]。内生真菌通过改变微生物量及微生物群落结构,或宿主植物凋落物的数量和质量[14-15]影响凋落物分解速率。
紫花针茅(Stipa purpurea)草原是青藏高原地区高寒草地中分布面积较广、最具有代表性的草地类型。其建群种紫花针茅系寒旱生植物,粗蛋白含量高,粗纤维少,营养价值比较高[16],且具有耐寒、耐旱、耐践踏和抗风沙等特性[17-18]。主要分布在海拔1900~5150 m的高原地带,是青藏高原、帕米尔高原和中亚高山地带的特有植物[19]。紫花针茅内生真菌主要为无性繁殖的Epichloë属内生真菌,近年来,有关紫花针茅与内生真菌之间相互关系的研究较多,如紫花针茅内生真菌分离和鉴定,紫花针茅内生真菌共生体对根寄生危害的响应等[19-20]。然而,关于内生真菌对紫花针茅凋落物分解的影响及其机制的研究尚未见报道。
本研究通过对比带内生真菌与不带内生真菌紫花针茅之间的凋落物分解特征差异,明确内生真菌对宿主植物凋落物分解过程的影响(包括凋落物重量和质量等变化),以期揭示禾草内生真菌对草地生态系统元素循环中凋落物分解的作用,为禾草内生真菌共生体在高寒草地的利用提供基础数据。
1 材料与方法
1.1 凋落物采集
2017年9月,于青海省海北州海晏县(N 37°04′01″,E 100°52′48″)天然草场采集紫花针茅花序,每单株装于一个信封袋。将采自野外的紫花针茅花序分别按照李春杰等[21-22]的方法进行内生真菌检测,采集带菌植株的种子并通过高温高湿法进行去除内生真菌的处理,建立带内生真菌(E+)与不带内生真菌(E-)无性繁殖系种群。将处理好的E+、E-种子分别种植于花盆中,置于温室,使其自然生长。待植株长到枯黄时,采集地上植株,自然风干,作为凋落物备用。
1.2 试验设计
2018年12月,将E+、E-紫花针茅植株凋落物分别剪成5 cm的小段,称取5.00 g装入1 mm孔径的尼龙网袋(大小为:10 cm×10 cm),共计36个网袋,放置到海北州海晏县试验点,每个网袋间距大于10 cm,放置前清除地上植物组织,确保网袋均匀平铺在地表与土壤直接接触,并用大头针固定。在放置网袋后的第0、3、6、8、10、12个月随机采集凋落物网袋,每次每个处理采集3个网袋,以备后续试验用。
1.3 分析方法
网袋取出后,将凋落物全部取出,放置到实验室自然风干,之后过0.25 mm筛后称重。根据Olson[23]的指数分解模型公式,计算凋落物分解速率k值:

式中:X表示经过t年分解时间后凋落物的残留量;X0为凋落物初始量(5 g)。根据此公式,可模拟出凋落物残留率随时间变化的指数回归方程,进而推算出不同凋落物分解50%即半分解时间和分解95%所需的时间。
每次采集的网袋中的样品都需要测定其全氮、木质素和纤维素含量。其方法为:全N含量运用全自动凯氏定氮仪(Kjeltec 2300 Auto SystemⅡ,Foss Tecator AB,瑞典)进行测定。木质素和纤维素的含量则依据酸性洗涤纤维法进行测定[24]。同时,计算每个分解阶段的凋落物木质素/N以及N残留率、木质素残留率和纤维素残留率等。
元素残留率(R):
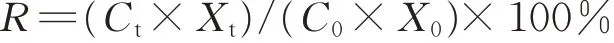
式中:Ct为t时刻凋落物元素含量(mg·g-1);Xt为t时刻凋落物干重(g);C0为初始元素含量(mg·g-1);X0为初始干重(g)。
1.4 数据分析
数据运用SPSS 17.0(SPSS,Inc.,Chicago,IL)软件进行分析,E+与E-之间凋落物重量、全N、木质素和纤维素含量、木质素∶N、纤维素∶N以及全N、木质素和纤维素的残留率等的差异显著性采用独立样本T检验的方法进行检验,内生真菌对紫花针茅凋落物重量、全N、木质素和纤维素含量、木质素∶N、纤维素∶N以及全N、木质素和纤维素的残留率等不同时间的影响采用重复度量方差分析方法进行检验,显著性区间定义为95%水平。
2 结果与分析
随着时间的延长,E+与E-紫花针茅凋落物重量都大幅度下降,其中0~8个月,凋落物重量下降速度较快,而8~12个月,下降速度趋于平缓(图1)。相对而言,E+紫花针茅的凋落物重量下降速度比E-快,且自第6个月以后,E+植株的凋落物重量显著低于E-(P<0.05,图1)。时间和内生真菌均对紫花针茅凋落物重量产生了显著影响(P<0.001),二者之间无显著交互作用(P>0.05,表1)。

图1 E+和E-紫花针茅凋落物重量随时间的变化Fig.1 The change of E+and E-S.purpurea litters weight over time
E+与E-紫花针茅凋落物分解系数分别为0.793和0.616(表2)。据此推算出,E+紫花针茅凋落物的半分解时间为0.84年,分解95%的时间为3.75年。而E-紫花针茅凋落物的半分解时间为1.14年,分解95%的时间为4.87年(表2)。因此,内生真菌缩短了紫花针茅植株凋落物的分解时间。

表2 E+和E-紫花针茅凋落物分解特征参数Table 2 Decomposition characteristics parameters of E+and E-S.purpurea litters
E+和E-紫花针茅凋落物中全氮含量随时间的延长有增加的趋势,其中,第6、10和12个月,E+紫花针茅凋落物中全氮含量均显著高于E-(P<0.05,图2a),内生真菌和时间对凋落物全氮含量产生了显著影响,且二者之间有显著的交互作用(P<0.05,表1)。另一方面,E+和E-紫花针茅凋落物中木质素含量均随着时间的延长迅速降低(图2b),至第8个月时,E+和E-凋落物中木质素含量均降至初始含量的1.5%以下,且随着时间的延长,E+凋落物的木质素含量由初始的显著高于E-(P<0.05),逐渐变为与E-无显著差异(P>0.05,图2b);时间对紫花针茅凋落物的木质素含量有显著影响(P<0.001),内生真菌与时间对木质素含量无显著的交互作用(P>0.05,表1)。E+和E-紫花针茅凋落物中纤维素含量与木质素含量有相同的变化趋势,均随着分解时间的延长而逐渐降低(图2c),不同的是,E+凋落物中纤维素含量始终低于E-,并在第3、8、10、12个月时达到显著水平(P<0.05,图2c);内生真菌和时间对紫花针茅凋落物纤维素含量的影响显著,但二者之间没有显著的交互作用(表1)。

表1 内生真菌在不同的时间对紫花针茅凋落物重量以及全氮、木质素和纤维素含量的重复度量方差分析Table 1 Repeated measures ANOVA for the effects of endophyte at different times on litter weight,total N,lignin and cellulose contents of S.purpurea litters

图2 E+和E-紫花针茅凋落物中全氮、木质素和纤维素含量随时间的变化Fig.2 The change of total N,lignin and cellulose contents in E+and E-S.purpurea litters over time
E+和E-紫花针茅凋落物中木质素∶氮值均随着时间的延长而逐渐降低(图3a)。E+凋落物中木质素∶氮值始终高于E-,并在分解第3和6个月时达到显著水平(P<0.05),在此过程中,内生真菌对紫花针茅凋落物中木质素∶氮值未造成显著影响,但是时间对其比值影响显著,二者无明显的交互作用(表3)。另一方面,E+和E-紫花针茅凋落物中纤维素∶氮值也随着时间的延长而降低,但是E+凋落物中纤维素∶氮值始终低于E-,并在第3、6、10、12个月时差异显著(P<0.05,图3b),内生真菌和时间对紫花针茅凋落物中纤维素∶氮值产生了显著的影响,但二者之间无明显的交互作用(表3)。

图3 E+和E-紫花针茅凋落物中木质素∶氮和纤维素∶氮随时间的变化Fig.3 The change of lignin∶N and cellulose∶N ratios in E+and E-S.purpurea litters over time
E+和E-紫花针茅凋落物中氮残留率均随着时间的延长而逐渐下降(图4a),相对E-来说,在分解后期E+凋落物氮残留率变化趋于平缓甚至有升高的趋势。到第8和10个月时,E+凋落物氮残留率显著低于E-(P<0.05,图4a)。E+和E-紫花针茅凋落物中木质素残留率均随着时间的延长而逐渐下降,在此过程中,E+与E-之间差异不显著(P>0.05,图4b)。纤维素与木质素残留率有相同的变化趋势,即E+和E-凋落物中纤维素残留率均随着时间的延长而降低,至第8和10个月时,E+凋落物中纤维素残留率显著低于E-(P<0.05,图4c)。总体而言,内生真菌显著影响紫花针茅凋落物氮和纤维素残留率,分解时间对于氮、木质素和纤维素残留率均产生了显著影响(P<0.05),但是内生真菌与分解时间对于三者均未产生明显的交互作用(P>0.05,表3)。

表3 内生真菌在不同的时间对紫花针茅凋落物木质素∶氮和纤维素∶氮比值以及全氮、木质素和纤维素残留率的重复度量方差分析Table 3 Repeated measures ANOVA for the effects of endophyte at different times on lignin∶N ratio,cellulose∶N ratio,and total N,lignin and cellulose residual rates of S.purpurea litters

图4 E+和E-紫花针茅凋落物中全氮、木质素和纤维素残留率随时间的变化Fig.4 The change of total N,lignin and cellulose residual rates in E+and E-S.purpurea litters over time
3 讨论
内生真菌在植物凋落物被分解之初,通过植物组织的自然衰亡而获得优先于其他腐生真菌的定殖优势[25],它们可能直接降解凋落物,也可能通过拮抗、资源竞争等方式与后定殖的腐生菌相互作用,从而间接影响凋落物分解速率[26-28]。本研究中,带内生真菌的紫花针茅凋落物具有更快的分解速率,进而,E+紫花针茅相比E-具有更短的凋落物分解周期(图1和表1),这可能与以上因素有关。凋落物分解速率对养分转化的速度产生直接影响,因此,内生真菌的存在加快了紫花针茅凋落物的分解,这有利于短期内对草原生态系统养分的补充[29-30]。内生真菌对一些禾草凋落物分解的影响已经被证实。Bell-Dereske等[31]发现内生真菌的侵染提高了美国沙茅草(Ammaophila breviligulata)的凋落物分解速率,本研究结果与之一致。然而,早期一些研究发现内生真菌具有降低禾草分解速率的可能,Omacini等[14]通过研究多花黑麦草(Lolium multiflorum)中的内生真菌对凋落物分解的影响,发现凋落物分解速率减少了17%;Lemons等[32]的研究也表明,与对照相比,E+处理的凋落物分解速率降低了8%。这可能主要与宿主植物的种类和共生体的生存环境等有关。Siegrist等[33]发现,尽管带菌高羊茅(Schedonorus arundinaceus)的凋落物中具有较高的生物碱含量,也未能造成带菌与不带菌高羊茅凋落物的干物质损失之间的较大差异,其可能原因是高羊茅的枯黄组织中生物碱的浓度非常低,以至于不能影响到微生物分解者。Gundel等[34]的研究也表明,在初始阶段凋落物体内生物碱含量越高,则其分解速率越大,但是长期观察的结果显示凋落物分解速率与生物碱含量之间没有相关性。因此,生物碱可能没有直接影响凋落物分解,但是可能参与到了初始微生物侵染凋落物的过程当中,进而影响凋落物分解速率。在与其宿主植物共生的过程当中,内生真菌也可能通过产生一些罕见的化合物而比生物碱更加直接地调控这种反应[33-34]。
凋落物质量与其分解速率密切相关,是影响其分解的内在因素,凋落物质量通常以凋落物养分含量的高低来衡量,并以各种含碳化合物(木质素、纤维素、单宁等)与养分元素(氮、磷、钾等)的含量比值来表示,或者直接以养分含量表示[35-36]。在凋落物分解过程中,水溶性物质和容易分解的碳水化合物可快速降解,初期呈现较快的分解速率,而木质素等难分解物质不断累积,结合成更加不易分解的高分子化合物,使得凋落物分解速率明显降低[37],许多研究发现,木质素在凋落物分解后期呈现净积累的现象[38-39]。本研究中,紫花针茅凋落物木质素含量随着分解时间的延长而逐渐降低,并且木质素∶N以及木质素残留率也持续降低(图2b,图3a和图4b),一方面可能是因为相对木本植物而言,草本凋落物木质素含量较低[40],另一方面,本研究中凋落物分解时间仅持续一年,尚未进行到后期阶段。凋落物质量损失率小于80%时认为分解处于前期阶段,而大于80%处于后期阶段[41-42],本研究中E+和E-紫花针茅凋落物的质量损失率分别为51.8%和43.8%,并没有到达木质素调控分解速率的后期阶段,这可能是木质素含量持续降低的原因之一。在分解初始阶段,E+紫花针茅凋落物的木质素含量显著高于E-,而随着分解时间的延长,二者之间差距逐渐减小,直至没有显著差异(图2b),并且E+与E-紫花针茅凋落物的木质素残留率没有显著差异(图4b),表明E+紫花针茅凋落物中的木质素相比E-而言其降解速率更快,内生真菌的调节作用在凋落物分解中可能发挥了显著作用。随着分解过程的延长,E+和E-紫花针茅凋落物的纤维素含量均逐渐降低,同时纤维素∶N以及纤维素残留率也持续降低(图2c,图3b和图4c),可见,在紫花针茅凋落物分解过程中,纤维素也随之逐渐被降解,这与之前的研究结果一致[39,43]。凋落物C质量被认为是决定分解的首要因子,纤维素、半纤维素作为凋落物C主要的承载者,一般认为在分解过程中,其含量也逐渐降低[39,44]。另一方面,凋落物纤维素主要是由真菌与细菌分解的,微生物分解者的数量及活性直接影响着它们的分解速率[45],因此,内生真菌可能通过影响微生物群落进而改变紫花针茅凋落物中纤维素的降解速率[14-15]。本研究中,在分解初期,E+与E-紫花针茅纤维素含量没有显著差异,随着分解时间的延长,E+紫花针茅的纤维素含量、纤维素∶N以及纤维素残留率显著低于E-。这也可能与纤维素酶的活性有关。许多研究表明,较高的N含量能增加纤维素酶的活性从而促进纤维素降解[46-47],本研究发现E+紫花针茅至分解后期有更高的全N含量(图2a),这可能部分解释了后期E+紫花针茅凋落物纤维素的降解速率显著高于E-的原因。
凋落物分解过程中,由于养分释放速度慢于凋落物质量损失速率,N、P等养分元素相对含量一般会逐渐升高[48]。本研究中,紫花针茅凋落物全氮含量随着时间的延长有上升的趋势(图2a),与前人的研究一致[36]。凋落物在分解过程中养分元素的迁移模式主要有:淋溶-富集-释放、富集-释放和直接释放3种模式[49-50]。元素的残留率与释放率密切相关,所以利用化学元素残留率的趋势图可分析元素在分解过程中的释放情况,即残留率下降表示元素在释放,残留率上升表示元素在富集[36,49-50]。E+和E-紫花针茅凋落物分解过程中N元素的残留率基本呈下降-升高-下降的趋势,表明紫花针茅的凋落物分解N元素的迁移可能呈淋溶-富集-释放模式。其中E+紫花针茅凋落物中的N残留率相比E-而言变化更快,且在后期,E+凋落物的N残留率显著低于E-(图4a),这可能是由于E+紫花针茅分解过程中微生物活动更加强烈,对N的需求更高,这也部分解释了E+紫花针茅凋落物相比E-具有更快的分解速度的原因。凋落物分解主要是微生物作用的过程,它们在分解过程中对N、P等元素浓度有很高的要求,因此,当凋落物含这些养分浓度较高时,微生物群落生长繁殖加速,活动加剧,分解速度加快[36,51]。这也可能是E+紫花针茅凋落物在分解过程中具有更低的纤维素残留率的原因之一(图4c),有研究表明,内生真菌在强化还田秸秆中有较广泛的应用[52],即植物内生真菌有降解纤维素的能力[53],由此可以推测,在本研究中,内生真菌也可能通过促进紫花针茅凋落物中纤维素的降解提高凋落物分解速率。然而随着分解时间的延长,这种优势有减弱的趋势,这可能主要是由于此时E+与E-紫花针茅凋落物中纤维素的残留率均到了较低的水平,因此内生真菌的作用逐渐不明显。
4 结论
内生真菌可以增强宿主植物紫花针茅的凋落物分解速率,缩短其分解周期,同时,随着分解时间的延长,内生真菌不同程度地促进了紫花针茅凋落物中N元素、木质素和纤维素的降解。因此,内生真菌对于加快紫花针茅向草地生态系统的养分输入起到积极作用。然而,本研究只观测了短期内凋落物分解的过程,更长期的凋落物分解变化以及分解环境条件、微生物活动和内生真菌次生代谢物等因素的影响仍需要进一步研究。
