2-碘-3-(对甲苯磺酰氧基)苯基醚的选择性合成
2021-09-17潘峰王磊郭怡沈金滢潘晓峰郑卫新
潘峰,王磊,郭怡,沈金滢,潘晓峰,郑卫新
2-碘-3-(对甲苯磺酰氧基)苯基醚的选择性合成
潘峰,王磊,郭怡,沈金滢,潘晓峰,郑卫新*
(杭州师范大学材料与化学化工学院,浙江 杭州 311121)
磺酰氧基卤代芳基醚是一种多功能化合物,在众多研究领域具有广泛应用价值。以2-碘间苯二酚为原料,经化学计量的双磺酰化、选择性单侧水解及与溴化物的亲核取代反应,合成系列2-碘-3-(对甲苯磺酰氧基)苯基醚。结果表明,双磺酰化产物的选择性单侧水解比2-碘间苯二酚通过单烃基化进行原料中2个对称羟基的选择性官能化更有优势。以低成本碱为水解试剂,探索反应时间、温度等因素对2,6-双(对甲苯基磺酰氧基)碘苯单侧选择性水解的影响,水解产物核磁纯度>99%,为对甲苯磺酰氧基碘代芳基醚的合成提供一种操作简便、反应条件温和、成本低和选择性高的方法。所有化合物结构均经1H-NMR、13C-NMR与高分辨质谱等方法确定。
磺酰氧基碘代苯基醚;合成;选择性水解
芳基醚是广泛存在于许多天然产物[1-2]和药物[3-5]分子中的重要骨架。芳环上官能团的选择性化学转化是芳基醚官能化的重要策略,因此多官能化芳基醚的选择性构建在合成化学中具有重要意义。磺酰氧基碘代芳基醚是组建众多具有生理活性分子的重要前体[6-10],其结构式为
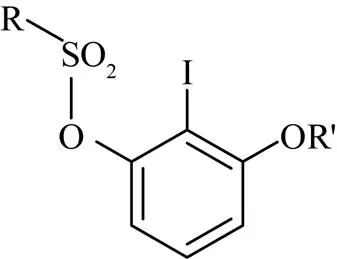
其中,相邻的卤素与磺酰氧基在芳基衍生化中发挥了重要作用[11-12]。卤素与磺酰氧基的活性差异可为选择性官能化提供有效途径[13-17]。此外,该化合物是苯炔这一活性物种的重要供体,通过环加成反应参与多种活性物质的合成[6,18]。
磺酰氧基碘代芳基醚中因取代基性质差异而拥有2种活性不同的C—O键,对应苯二酚前体的选择性反应是该类化合物合成的主要策略,实现酚羟基高选择性烃化与磺酰化是合成该化合物的关键。其合成方法主要有2种,一是先通过卤代苯二酚的非完全烃化反应进行单侧烃基化,再进行磺酰化[19-22]合成;二是通过卤代芳基二酚的磺酰化-选择性水解-衍生化合成。其中,三氟磺酰氧基的反应较常见,例如1,6-双(三氟磺酰氧基)碘苯可经Cs2CO3作用脱去其中一个磺酰基[23]。在常用磺酰基中,对甲苯磺酰基成本较低,近年来在许多过渡金属催化的偶联反应中表现出较好的活性和选择性[24]。2,6-二羟基苯乙酮中的2个酚羟基可以通过控制计量的对甲苯磺酰氯进行选择性单磺酰化,继而在未反应的羟基邻位发生碘代反应生成碘代丁二酰亚胺(NIS)[25]。CLARK等[26]报道了3,5-双磺酰氧基碘苯的单侧选择性水解。然而,对于磺酰氧基碘代芳基醚的合成前体,即2-卤代双对甲苯磺酰二苯酯的磺酰化或选择性水解,至今未见文献报道。
基于此,本文采用低成本碱高选择性地实现2,6-双对甲苯磺酰氧基2-碘苯的单侧水解,经亲核取代反应生成磺酰氧基碘代芳基醚,为磺酰氧基卤代芳基醚的合成提供一种低成本、高效的方法。
1 实验
1.1 实验仪器与实验原料
Bruker Avance DMX500核磁共振仪,Bruker DMX300核磁共振仪,Shimadzu HRMS-EI-TOF型高分辨仪,显微熔点仪X5。2-碘-1,3-苯二酚通过文献[27]中方法合成。
1.2 2,6-双磺酰氧基碘苯的合成
在250 mL烧瓶中加入2-碘代-1,3-苯二酚(4.72 g,20 mmol)、对甲苯磺酰氯(8.77 g,46 mmol)、碳酸钾(11.06 g,80 mmol)和丙酮(100 mL),室温下搅拌,薄层色谱(TLC)跟踪至反应完全。抽滤,滤渣用二氯甲烷洗涤,合并的有机相用饱和食盐水洗涤,经无水硫酸镁干燥,旋蒸浓缩。用乙酸乙酯和石油醚对粗产物重结晶,得到白色晶体2,6-双(对甲苯基)磺酰氧基碘苯。
1.3 2-碘-3-(对甲苯磺酰氧基)苯酚的合成
在1 L锥形瓶中加入2,6-双磺酰氧基碘苯(23.3 g,42.8 mmol)和甲醇(100 mL),保持35 °C,滴加含KOH(5.0 g,89.1 mmol)的水-甲醇混合溶液(2.5 mL水,225 mL甲醇)。滴加完毕后保持温度不变,搅拌3 h,升温至45°C继续搅拌15 min后冷却至室温,用水稀释至总体积为800 mL,用浓度为5%的盐酸中和,在4 °C下静置2 d。过滤,将滤渣溶解在乙醚中,用10%的NaOH溶液萃取。分出的油状物经乙醚洗涤后用5%的盐酸中和。混合物用乙醚萃取3次,合并的有机相经硫酸镁干燥,过滤,浓缩后得到2-碘-3-(对甲苯磺酰氧基)苯酚。
1.4 2-碘-3-(对甲苯磺酰氧基)苯基醚的合成
在250 mL烧瓶中加入2-碘-3-(对甲苯磺酰氧基)苯酚(7.80 g,20 mmol),卤代烃(20 mmol),碳酸钾(5.56 g,40 mmol)和乙腈(30 mL),室温下搅拌,TLC跟踪至反应完全。加50 mL水稀释,用乙酸乙酯萃取混合物,合并的有机相用饱和食盐水洗涤,无水硫酸镁干燥,过滤。用快速柱层析分离(石油醚()∶乙酸乙酯()=10∶1)粗产物,提纯得到系列2-碘-3-(对甲苯磺酰氧基)苯基醚。
2 结果与讨论
2.1 2-碘间苯二酚的选择性烃化
2-碘间苯二酚与苄溴的化学反应方程式为
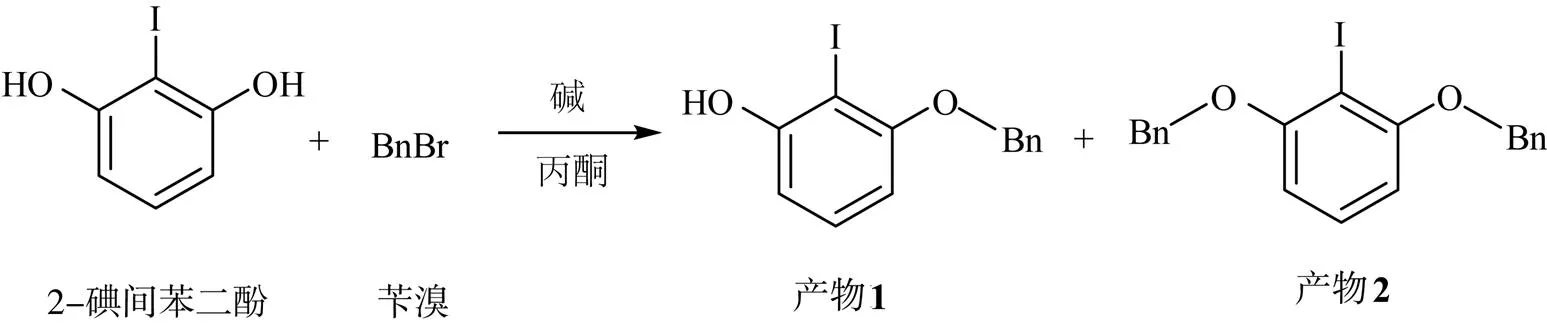
首先,选择烃化反应作为单侧选择性取代的起点,室温下将2-碘间苯二酚与碱在丙酮中混合,边搅拌边加入等物质的量的苄溴。不同碱的反应选择性如表1所示。

表1 2-碘间苯二酚与苄溴的反应
a:碱与2-碘间苯二酚的物质的量之比为1.2∶1;b:以TLC跟踪2-碘间苯二酚消失为准;c:核磁产率,括号内产物比例由反应混合物的1H-NMR确定,CH2Br2为内标。
由表1可知,在有机碱(Entry 4和5)作用下单取代产物1的产率高于无机碱(Entry 1~3)作用下产物1的产率,且可通过色谱柱分离产物1和2,但反应选择性无法满足高效合成的需求。尝试用2-碘间苯二酚与等物质的量的对甲苯磺酰氯进行选择性单侧磺酰化,依然未获得成功。
2.2 2, 6-双磺酰氧基碘苯的选择性水解
碘代间苯二酚在K2CO3作用下与对甲磺酰氯以物质的量之比为2∶1发生反应,计量生成2,6-双磺酰氧基碘苯。该化合物在溶剂为甲醇,碱为NaOH[26]的条件下可实现单侧水解,生成2-碘-3-(对甲苯磺酰氧基)苯酚,水解反应方程式为
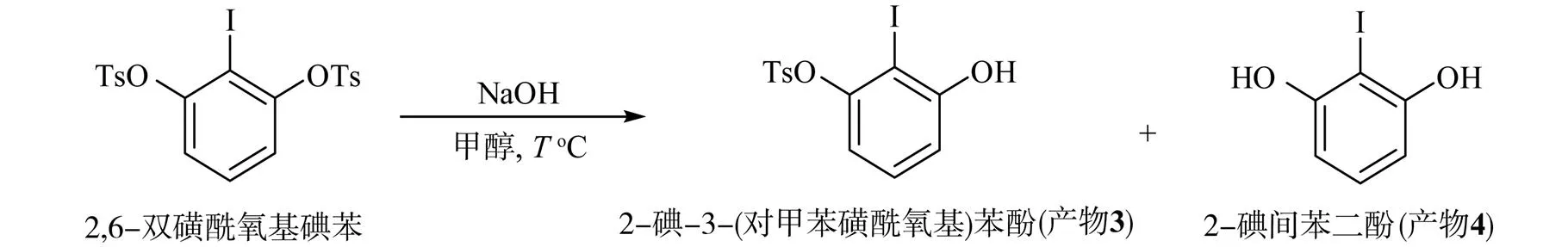
探索不同温度下2,6-双磺酰氧基碘苯的选择性单侧水解,结果见表2。
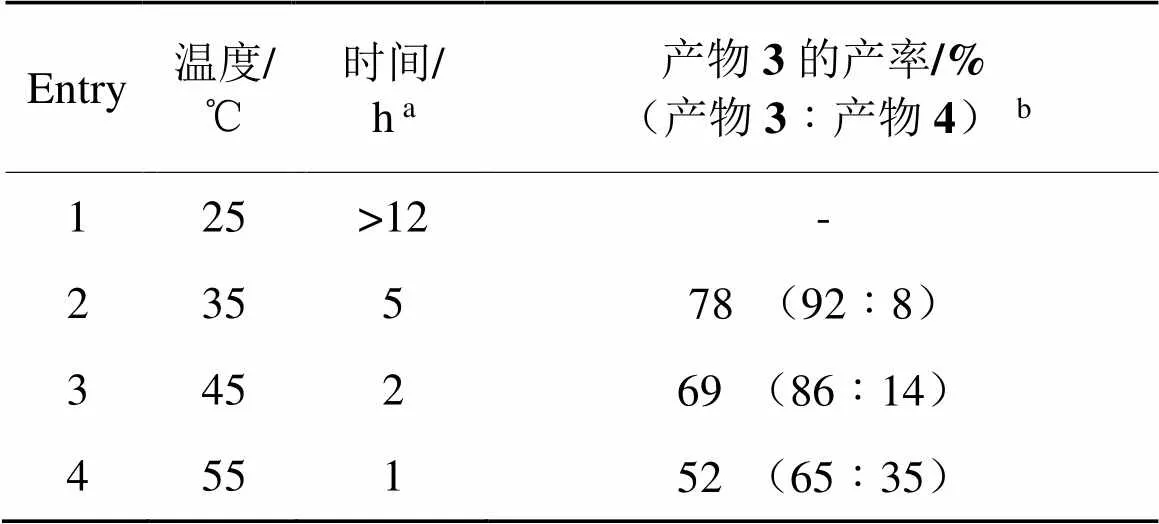
表2 2,6-双磺酰氧基碘苯的选择性单侧水解
a:由于2,6-双磺酰氧基碘苯不溶于反应溶液,此处时间是指从碱溶液滴完至固体消失的时间。b:核磁产率,括号内产物比例由反应混合物的1H-NMR确定,CH2Br2为内标。
由表2可知,在室温25 ℃下,反应时间较长,即使2,6-双磺酰氧基碘苯经历12 h,仍未反应完全。温度每升高10 ℃,反应明显加快,完全水解产物增加。因此,先将温度调至35 ℃反应3 h,然后升温至45 ℃反应15 min,经后处理无须提纯可获得核磁纯度>99%的2-碘-3-(对甲苯磺酰氧基)苯酚(产率达86%),如图1所示。该产物可达到后续合成应用的需求。
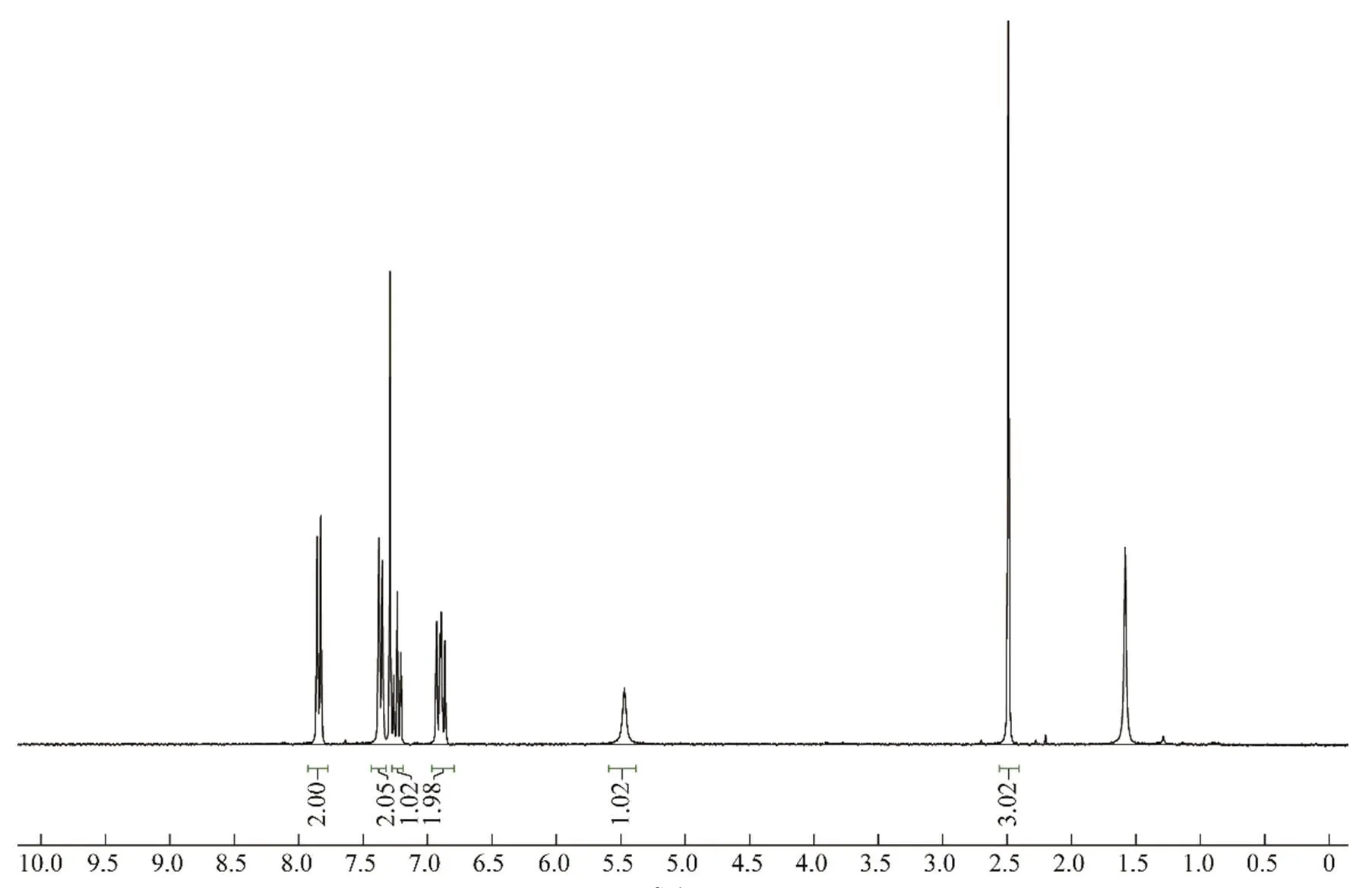
(ppm)

2.32-碘-3-(对甲苯磺酰氧基)苯酚的亲核取代反应
以乙腈为溶剂,2-碘-3-(对甲苯磺酰氧基)苯酚在K2CO3作用下与多种溴代烃发生亲核取代反应,生成系列2-碘-3-(对甲苯磺酰氧基)苯基醚(产物5a~j),其中,产物5a为甲基-(3-对甲苯磺酰氧基-2-碘)苯基醚,产率为86%;产物5b为乙基-(3-对甲苯磺酰氧基-2-碘)苯基醚,产率为78%;产物5c为正丙基-(3-对甲苯磺酰氧基-2-碘)苯基醚,产率为79%;产物5d为异丙基-(3-对甲苯磺酰氧基-2-碘)苯基醚,产率为88%;产物5e为苄基-(3-对甲苯磺酰氧基-2-碘)苯基醚,产率为89%;产物5f为(2-苯基)乙基-(3-对甲苯磺酰氧基-2-碘)苯基醚,产率为88%;产物5g为(2’-溴)苄基-(3-对甲苯磺酰氧基-2-碘)苯基醚,产率为75%;产物5h为(2’-碘)苄基(3-对甲苯磺酰氧基-2-碘)苯基醚,产率为81%;产物5i为烯丙基-(3-对甲苯磺酰氧基-2-碘)苯基醚,产率为82%;产物5j为(3-对甲苯磺酰氧基-2-碘)苯氧基乙酸乙酯,产率为83%。产物5a~j的详细数据请扫描右侧二维码。
亲核取代反应方程式为

产物5a~j的结构式如下:
3 结论
以2-碘间苯二酚为原料,经磺酰化、选择性水解、亲核取代反应,合成了系列磺酰氧基卤代芳基醚。以低成本碱为水解试剂,实现2,6-双(对甲苯基)磺酰氧基卤代苯的单侧选择性水解,水解产物核磁纯度>99%,为对甲苯磺酰氧基碘代芳基醚的合成提供了一种低成本、高效的方法。
[1]BRAD C, JOHN D F. Polybrominated diphenyl ethers from,and[J]. Tetrahedron, 1981, 37(13): 2335-2339. DOI:10.1016/s0040-4020(01)88886-4
[2]YAMADA T, TAKIGUCHI H, OHMORI K, et al. Total syntheses of pusilatins A-C, liverwort-derived macrocyclic bisbibenzyl dimers[J]. Organic Letters, 2018, 20(12): 3579-3582. DOI:10.1021/acs.orglett. 8b01366
[3]FUJIMOTO J, OKAMOTO R, NOGUCHI N, et al. Discovery of 3,5-diphenyl-4-methyl-1,3-oxazolidin-2-ones as novel, potent, and orally available delta-5 desaturase (D5D) inhibitors[J]. Journal Medicinal Chemistry, 2017, 60(21): 8963-8981. DOI:10.1021/acs.jmedchem.7b01210
[4]SINGER J M, WILSON M W, JOHNSON P D, et al. Synthesis and SAR of tolylamine 5-HT6 antagonists[J]. Bioorganic & Medicinal Chemistry Letters, 2009, 19(9): 2409-2412. DOI: 10.1016/j.bmcl.2009.03.077
[5]NORTON R S, CROFT K D, WELLS R J. Polybrominated oxydiphenol derivatives from the sponge dysidea herbacea[J]. Tetrahedron, 1981, 37(13): 2341-2349. DOI:10.1016/s0040-4020(01)88887-6
[6]MAMIKO N, YOSHIO A, FUMITAKA K, et al. Total synthesis of actinorhodin[J]. Angewandte Chemie International Edition, 2019, 58(13): 4264-4270. DOI:10.1002/anie.201814172
[7]BORGEL J, TANWAR L, BERGER F, et al. Late-stage aromatic C-H oxygenation[J]. Journal of the American Chemical Society, 2018, 140(47): 16026-16031.
[8]ARIYASU S, SAWA A, MORITA A, et al. Design and synthesis of 8-hydroxyquinoline-based radioprotective agents[J]. Bioorganic & Medicinal Chemistry, 2014, 22(15): 3891-905. DOI:10. 1016/j.bmc.2014.06.017
[9]BORGEL J, TANWAR L, BERGER F, et al. Late-stage aromatic C-H oxygenation[J]. Journal of the American Chemical Society, 2018, 140(47): 16026-16031.
[10]NING Y, FUKUDA T, IKEDA H, et al. Revisiting secondary interactions in neighboring group participation, exemplified by reactivity changes of iminylium intermediates[J]. Organic Biomolecular Chemistry, 2017, 15(6): 1381-1392. DOI:10.1039/c6ob02719a
[11]LIU Z, LI J, LI S, et al. SuFEx click chemistry enabled late-stage drug functionalization[J]. Journal of the American Chemical Society, 2018, 140(8): 2919-2925. DOI:10.1021/jacs.7b12788
[12]IQBAL J, EL-GAMAL M I, EJAZ S A, et al, Tricyclic coumarin sulphonate derivatives with alkaline phosphatase inhibitory effects: In vitro and docking studies[J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2018, 33(1): 479-484. DOI:10.1080/14756366.2018.1428193
[13]TRAN H, MCCALLUM T, MORIN M, et al. Homocoupling of iodoarenes and bromoalkanes using photoredox gold catalysis: A light enabled Au(III) reductive elimination[J]. Organic Letters, 2016, 18(17): 4308-4311. DOI:10.1021/acs.orglett.6b02021
[14]MONDAL S, DEBNATH S, DAS B. Synthesis of seven-membered fused sultones by reductive Heck cyclization: An investigation for stereochemistry through DFT study[J]. Tetrahedron, 2015, 71(3): 476-486. DOI:10.1016/j.tet.2014.11.068
[15]ALLEN P, BRAGG R A, CAFFREY M, et al. The synthesis of a tritium, carbon-14, and stable isotope-labeled cathepsin C inhibitors[J]. Journal of Labelled Compounds & Radiopharmaceuticals, 2017, 60(2): 124-129. DOI:10.1002/jlcr.3483
[16]STEINHARDT R C, O'NEILL J M, RATHBUN C M, et al. Design and synthesis of an alkynyl luciferin analogue for bioluminescence imaging[J]. European Journal of Organic Chemistry, 2016, 22(11): 3671-3675. DOI: 10.1002/chem.201503944
[17]LIN K, WILES R J, KELLY C B, et al. Haloselective cross-coupling via Ni/Photoredox dual catalysis[J]. ACS Catalysis, 2017, 7(8): 5129-5133. DOI: 10.1021/acscatal.7b01773
[18]JOSÉ A, GARCÍA L, MELIHA Ç, et al. Synthesis of hindered biaryls via aryne addition and in situ dimerization[J]. Organic Letters, 2015, 17(11): 2649-2651. DOI: 10.1021/acs.orglett.5b01115
[19]WANG Z, LIU Z, LEE W, et al. Design, synthesis and docking study of 5-(substituted benzylidene) thiazolidine-2,4-dione derivatives as inhibitors of protein tyrosine phosphatase 1B[J]. Bioorganic & Medicinal Chemistry Letters, 2014, 24(15): 3337-3340. DOI:10.1016/j.bmcl.2014.05.099
[20]TAKAHASHI S, SUDA Y, NAKAMURA T, et al. Total synthesis of kehokorins A-E, cytotoxic-terphenyls[J]. The Journal of Organic Chemistry, 2017, 82(6): 3159-3166. DOI:10.1021/acs.joc. 7b00147
[21]BRACCA A, KAUFMAN T, CORTÉS I, et al. Total synthesis and cytotoxic activity of 6,8-dimethoxy-1,3-dimethylisoquinoline isolated from ancistrocladus tectorius: A 6π-azaelectro-cyclization approach[J]. Synthesis, 2018, 51(2): 433-440. DOI:10.1055/s-0037-1610276
[22]ATTALURI S, IDEN C R, BONALA R R, et al. Total synthesis of the aristolochic acids, their major metabolites, and related compounds[J]. Chemical Research in Toxicology, 2014, 27(7): 1236-1242. DOI: 10.1021/tx500122x
[23]YOSHIDA S, MORITA T, HOSOYA T. Synthesis of diverse benzotriazoles from aryne precursors bearing an azido group via inter- and intramolecular cycloadditions[J]. Chemistry Letters, 2016, 45(7): 726-728. DOI:10.1246/cl.160349
[24]NERVIG C S, WALLER P J, KALYANI D. Palladium-catalyzed intramolecular C-H arylation of arenes using tosylates and mesylates as electrophiles[J]. Organic Letters, 2012, 14(18): 4838-4841. DOI:10.1021/ol302166n
[25]ALI R, GUAN Y, LEVEILLE A N, et al. Synthesis and anticancer activity of structure simplified naturally inspired dimeric chromenone derivatives[J]. European Journal of Organic Chemistry, 2019, 10(41): 6917-6929.
[26]CLARK C G, FLOUDAS G A, LEE Y J, et al.Molecularly tethered amphiphiles as 3-D supramolecular assembly platforms: Unlocking a trapped conformation[J]. Journal of American Chemical Society, 2009, 131(24): 8537-8547. DOI:10.1021/ja900999f
[27]TSUJIYAMA S I, SUZUKI K. Preparation of benzocyclobutenone derivatives based on an efficient generation of benzynes[J]Organic Syntheses, 2007, 84: 272-284. DOI:10.15227/orgsyn.084.0272

Selective synthesis of 2-iodophenyl-3-(-tosyloxy) 4-methylbenzenesulfonate
PAN Feng, WANG Lei, GUO Yi, SHEN Jinying, PAN Xiaofeng, ZHENG Weixin
(311121)
Halogenated sulfonyloxyaromatic ether has been regarded as the polyfunctionalized organic compound with wide applications in lots of fields. Using 2-iodoresorcinol as the starting material, series of iodonated alkyloxy 4-methylbenzenesulfonate were synthesized in high yields via stoichiometrical bissulfonylation, selective monohydrolysis of 2-iodo-1,3-phenylene bis(4-methylbenzenesulfonate) followed by nucleophilic substitution to various organobromides. Procedure for preparation of 3-hydroxy-2-iodophenyl-(4-methylbenzenesulfonate) was explored. It was found that the monodesulfonylation of bissulfonate was much more favorite than monohydrocarbylation for selective functionalization of the two symmetrical hydoxyls in 2-iodoresorcinol. Using low-cost alkali system, the reaction time, temperature of the monohydrolysis of the 2,6-bis(tosyloxy)iodobenzene had been investigated. The monohydrolysis product, 3-hydroxy-2-iodophenyl-(4-methylbenzenesulfonate), were obtained in the purity of above 99% in1H-NMR without further purification. This study provides a synthetic method of 3-alkyloxy-2-iodophenyl 4-methylbenzenesulfonate, which had the advantages of simple operation, mild reaction conditions, low cost and high selectivity. The structures of all the products were verified by1H-NMR,13C-NMR and HRMS, et al.
3-(-tosyloxy)-2-iodophenyl ether; synthesis; selective monohydrolysis
10.3785/j.issn.1008-9497.2021.05.009
O 627
A
1008⁃9497(2021)05⁃579⁃05
2020⁃01⁃01.
国家自然科学基金资助项目(20972037).
潘峰(1994—),ORCID: https://orcid.org/0000-0001-7016-2484,男,硕士研究生,主要从事导向金属有机合成研究,E-mail: pfgz0419@163.com.
,ORCID: https://orcid.org/0000-0003-4149-8100,E-mail:wxzheng@hznu.edu.cn.

