两种国兰C类花发育MADS基因的克隆与表达研究
2021-09-16田云芳王会鱼李春阁陈丽培徐艳花
田云芳, 王会鱼,罗 青,李春阁,陈丽培,徐艳花
(1 郑州师范学院 生命科学学院,郑州 450044;2 郑州市观赏药用特色资源植物重点实验室,郑州 450044)
国兰是中国十大名花之一,有花中君子的美誉。《孔子家语》载道:“芝兰生于深谷,不以无人而不芳;君子修道立德,不为困穷而改节。”国兰栽培历史悠久,香气淡幽,花型奇特。花是被子植物重要的生殖器官,也是被子植物进化过程中变化最丰富的结构。国兰花器官一般是由3枚萼片,3枚花瓣(其中1枚为唇瓣)及1个合蕊柱(雌雄蕊合生结构)构成(图1,Ⅰ)。合蕊柱为兰科植物花中最为独特的生殖结构,也是兰科植物的特征性器官。在ABCDE花发育基因模型(图1,Ⅱ)中,就模式植物拟南芥而言,萼片的生长发育由功能基因A+E控制;花瓣由功能基因A+B+E控制;雄蕊由功能基因B+C+E控制;雌蕊由功能基因C+E控制[1]。C类基因主要进行调控心皮和雄蕊的生长发育[2]。AG基因是植物花发育的C类MIKC 型MADS-box 基因[3],所编码的蛋白往往具有保守程度不同的M区(较为保守)和K区(相对保守),在花发育初级阶段决定雄蕊和雌蕊的发育,与心皮、胚珠及果实等的生长发育紧密相关,在花器官生长发育中起着重要的作用,而且在植物花发育、干细胞维持及发育进程结束的基因调控网络中扮演着重要的角色[4]。
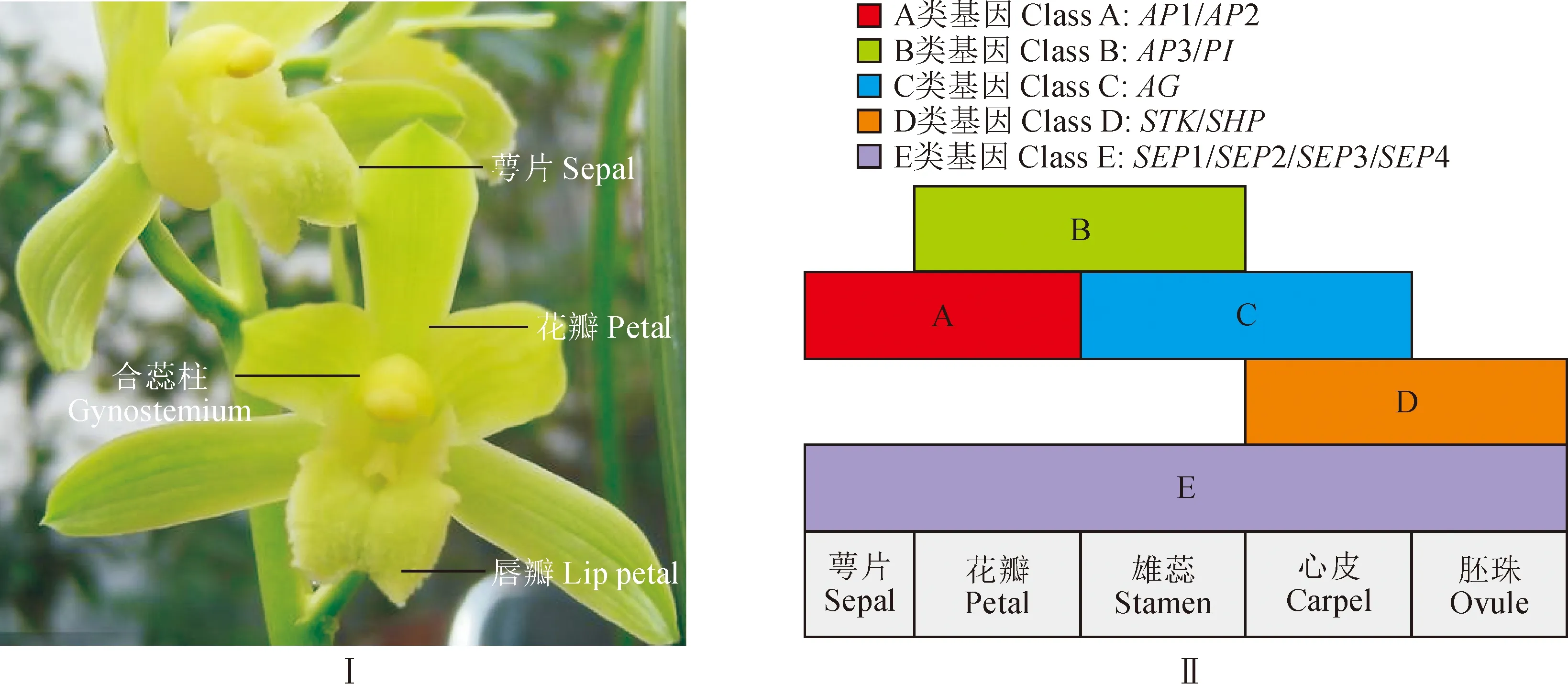
图1 国兰花型结构图(Ⅰ)及拟南芥花发育模型(Ⅱ)Fig.1 Flower type structure diagram of Chinese Cymbidium (Ⅰ) and flower development model of Arabidopsis thaliana (Ⅱ)
前人研究中,梅[5]、百合[6]的AG基因和红花玉兰的MAwuAG[7]基因主要表达于雌雄蕊;春兰CygoAG1基因仅在3个部位表达,花粉团、合蕊柱和子房,子房最高,CygoAG2 基因在所有花被片、花粉团、合蕊柱和子房中均检测到,合蕊柱最高[8];建兰CeMADS1 和CeMADS2 的时空表达特性也明显不同,分别主要参与子房、合蕊柱的生长发育[9];玫瑰RhAG基因在雄蕊中大量表达,其沉默致花瓣增多,RhAG主要影响雄蕊发育[10];杨树AG基因功能较为保守,沉默后致花器变化,进而影响花器官的决定、胚珠的分化和种毛的发育[11]。
随着分子生物学的发展,兰花花发育基因的表达和功能也成为研究的热点[12],深入探索国兰C类花器官发生发育的AG同源基因的表达调控机制。为了明晰AG同源基因在国兰花发育过程中的调控特征,本实验采用同源基因克隆技术从蕙兰和墨兰中获得了3 个AG基因,并分析了这3个基因在蕙兰和墨兰3个生长阶段的根、叶、花被片、合蕊柱及子房等的组织表达特性,比较了该基因的表达对花器官形态发育的调控,以期在分子层面深入研究2种国兰花发育的调控网络和后期育种时的花型改良奠定研究基础。为进一步阐明兰科植物的遗传进化与形态演变以及兰花分子育种提供理论依据。
1 材料和方法
1.1 试验材料
本研究材料蕙兰和墨兰取自郑州师范学院兰花工程研究中心,选取3个生长阶段(成苗期、花蕾期和盛花期)的器官和组织。
1.2 方 法
1.2.1 总RNA 提取及cDNA 第一链的合成按照RNAprep pure 试剂盒的方法提取2种国兰器官和组织的总RNA,分别吸取1 μL 所提取不同材料的RNA,在1.0%浓度(1g琼脂糖+100 mLTAE缓冲液) 的琼脂糖凝胶上进行电泳判断RNA是否完整,利用微量紫外分光光度计分析浓度、质量。以蕙兰和墨兰的子房总RNA 为模板,用M-MLV试剂盒完成反转录。
1.2.2AG基因克隆及分析根据GenBank 中已登录拟南芥Arabidopsisthaliana(X53579.1)及兰科植物建兰Cymbidiumensifolium(JN613149.1)、球花石斛Dendrobiumthyrsiflorum(DQ017702.1)、蝴蝶兰Phalaenopsishybrid cultivar(DQ534013.1)等的AG基因保守序列设计上下游引物(AG-F、AG-R,表1)。以蕙兰和墨兰子房总RNA反转录后的cDNA为模板进行RT-PCR,退火温度为51.9 ℃,预期目的条带获得后切胶回收,再连接T载体进行TA 克隆,测序后分析。输入正确的AG核苷酸序列在NCBI(http:// blast.ncbi.nlm.nih.gov/) 上通过Blastn检索,并与其他物种AG核苷酸序列比对;通过Blastp比对所编码蛋白并获得其保守结构域及功能域。
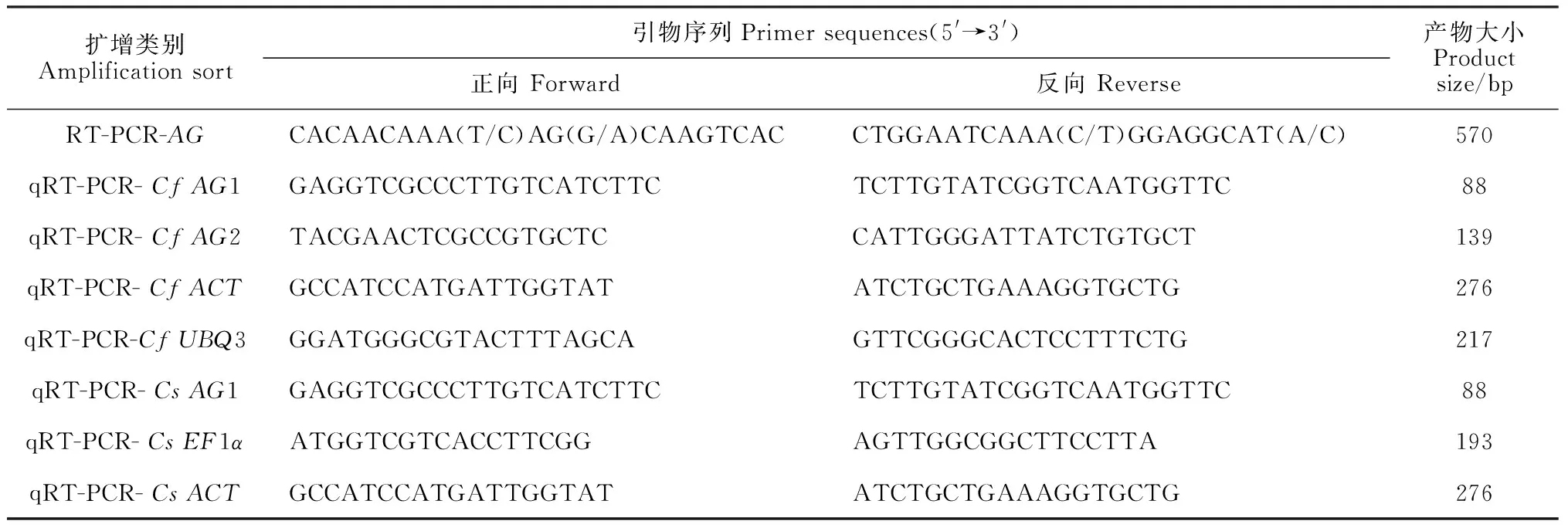
表1 本实验所用的引物
1.2.3AG基因时空表达分析依据测序分析得到的AG核苷酸序列设计特异性引物以进行qRT-PCR实验。参照SYBR Premix ExTaqTMⅡ 使用说明,用qRT-PCR 的方法检测AG基因在蕙兰和墨兰不同组织的相对表达,采用ACT、UBQ3作为蕙兰AG基因表达的内参基因,EF1α、ACT作为墨兰的内参基因,试验重复3次。Tm值设为58 ℃,利用蒸馏水为阴性对照,反应体系20 μL,PCR仪程序设置为:95 ℃预变性30 s,95 ℃变性15 s,58 ℃退火15 s, 72 ℃延伸30 s,共设40 个循环。
1.3 数据处理
用 Excel 2007进行数据分析并制图,采用SPSS25.0软件进行方差分析及相关性分析。统计值以平均值±标准误(mean±SE)表示。
2 结果与分析
2.1 AG基因cDNA序列克隆
分别以蕙兰、墨兰的子房cDNA为模板,结合AG-F、AG-R引物进行扩增,得到3条长度约为600 bp 的目的条带(图2),与预期结果一致,测序后长度分别为567、561和567 bp。将其核苷酸序列在NCBI上Blastn分析,发现蕙兰的序列1与春兰Cymbidiumgoeringii(MH917910.1) 的AG基因有99%的相似性;序列2与春兰(MF462085.1) 有84%的相似性;分别将该基因命名为CfAG1和CfAG2,提交GenBank,登录号为MW654188和MW654189。墨兰的序列与建兰Cymbidiumensifolium(JN613149.1) 的AG基因有99%的相似性,命名为CsAG1,登录号为MW654190。
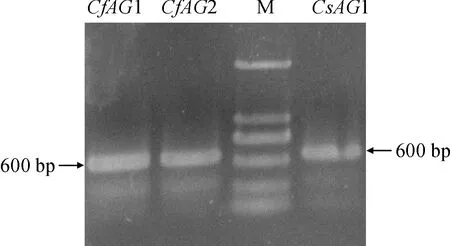
CfAG1. 蕙兰AG1; CfAG2. 蕙兰AG2; M.DL2000; CsAG1.墨兰AG1图2 蕙兰和墨兰AG基因的PCR产物CfAG1. C. faberi AG1; CfAG2. C. faberi AG2; M. DL2000; CsAG1. C. sinense AG1Fig.2 PCR product of AG gene from C. faberi and C. sinense
2.2 AG基因编码的蛋白序列分析
将3条核苷酸序列对应编码的氨基酸在GenBank库中通过Blastp检索,比对发现3个蛋白均包含高度保守的MADS区和半保守的K区,MADS蛋白结构域能够结合特定的DNA序列调控基因表达,是典型的MADS-box结构,调节蛋白质间的彼此作用。3条核苷酸序列均属于植物特有的C类MIKC型MADs-box基因(图3~5)。

图3 CfAG1基因核苷酸和推测的氨基酸序列及蛋白保守域Fig.3 Nucleotide acid and deduced amino sequences of CfAG1 and conservative protein domain structure

图4 CfAG2 基因核苷酸和推测的氨基酸序列及蛋白保守域Fig.4 Nucleotide acid and deduced amino sequences of CfAG2 and conservative protein domain structure

图5 CsAG1 基因核苷酸和推测的氨基酸序列及蛋白保守域Fig.5 Nucleotide acid and deduced amino sequences of CsAG1 and conservative protein domain structure
将蕙兰AG1基因编码的氨基酸进行同源分析表明,与建兰AG(AEZ51868.1)相似性高达99%,与球花石斛(AAY86364.1)相似性为95%,蝴蝶兰(ARX76299.1)相似性为94%,文心兰Oncidiumhybrid cultivar(AIJ29176.1)相似性为94%,春兰(QDF44721.1)相似性为85%,说明该基因进化保守。
蕙兰AG2与铁皮石斛Dendrobiumcatenatum(PKU76866.1)AG的相似性为90%,(AAZ95250.1)相似性为88%,建兰(ADP00516.1)相似性为85%,春兰(QDF44721.1)相似性为85%,说明该基因保守性较强。
墨兰AG1与建兰(AEZ51868.1)相似性为99%,球花石斛(AAY86364.1)相似性为95%,蝴蝶兰(ARX76299.1)相似性为94%,文心兰(AIJ29176.1)相似性为94%,小兰屿蝴蝶兰Phalaenopsisequestris(XP_020582512.1)相似性为86%,保守性也比较强。
2.3 AG基因表达分析
2.3.1 蕙兰为了确定AG基因在蕙兰中的时空表达模式,在不同的组织、器官中进行了实时荧光定量qRT-PCR。结果表明(图6),CfAG1在盛花期生殖器官合蕊柱中高丰度表达,在花蕾期花蕾和盛花期子房中中度表达;在苗期和花蕾期的营养器官中不表达,在盛花期的花被片和花葶中也几乎不表达,在盛花期的叶片中有少量表达。CfAG2在盛花期生殖器官子房中高丰度表达,盛花期生殖器官合蕊柱中中度表达,花蕾期花蕾和盛花期花萼中少量表达;在苗期和花蕾期的营养器官中几乎不表达,在盛花期的花瓣、叶片和花葶中也几乎不表达(图6)。
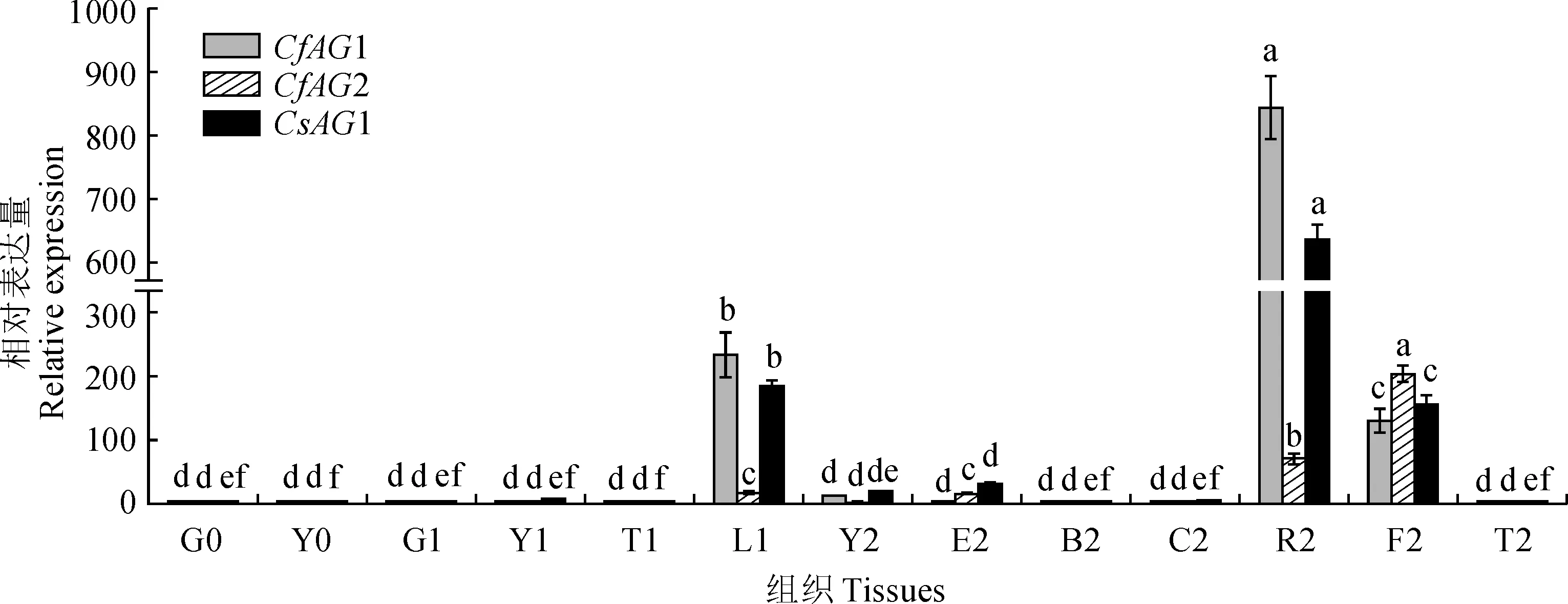
0. 成苗期;1.花蕾期;2.盛花期;G.根;Y.叶;T.花葶;L.花蕾;E.花萼;B.花瓣;C.唇瓣;R.合蕊柱;F.子房;不同小写字母表示同一基因在不同组织的表达量有显著性差异 (P<0.05)图6 CfAG1、CfAG2和CsAG1基因在不同组织中的表达模式0. Adult seedling stage; 1. Bud stage; 2. Full-blossom stage; G. Root; Y. Leaf; T. Inflorescence rachis; L. Bud; E. Calyx; B. Petal; C. Lip petal; R. Gynostemium; F. Ovary. Different normal letters mean significant difference of the same gene in different tissues (P<0.05)Fig.6 Expression patterns of CfAG1,CfAG2 and CsAG1 in different tissues
2.3.2 墨兰以墨兰3个时期的根、叶、花等组织的总RNA为模板分析CsAG1基因的表达模式。结果表明(图6),CsAG1基因表达量最高的部位是墨兰盛花期合蕊柱,表达量次之的部位是花蕾期花蕾和盛花期子房,盛花期萼片和叶片中轻微表达;在合蕊柱、花蕾、子房中表达丰度分别约是盛花期叶片的 33 倍、10倍和8 倍;在苗期和花蕾期的营养器官中几乎不表达,盛花期的花瓣、花葶中也几乎不表达。从表达时期来看,2个基因的表达量依次为:盛花期>花蕾期>成苗期。
3 讨 论
3.1 表达特性
多数MADS-box基因控制花器官的发育[13], 少见在花器官中不表达[14]。植物C 类花器官特征基因AG编码的MADS 转录因子家族成员,主要调控决定花器官第三和第四轮[15]。本研究中所获得的3个基因均具有保守的M区和相对保守的I区,属于MADS-box基因。3个基因在花瓣中均不表达,但在合蕊柱中高丰度表达,而且CfAG2、CsAG1在花萼中也有表达,这与梅AG基因在各器官中的表达一致[5],梅AG基因在萼片、雄蕊、雌蕊、果皮和种子均能检测到,且表达量较高,但是在叶片以及花器官的花瓣中不表达,春兰CygoAG2 基因在所有花被片、花粉团、合蕊柱和子房中也均检测到[8],推断CfAG2、CsAG1参与花萼的发育。CfAG1、CsAG1在花蕾和合蕊柱中突出表达也与萼脊兰AG基因表达也较为一致[16],萼脊兰AG基因在花蕾和蕊柱中表达量很高,很可能控制着雄蕊和雌蕊的发育,推断CfAG1、CsAG1主要参与花蕾和合蕊柱的发育。RhAG作为玫瑰中AG同源基因的代表,在雄蕊发育中显著高调表达,沉默玫瑰中AG的同源物RhAG可以导致其花瓣数量增加[10]。甜樱桃PaMADS5在花的雄蕊和心皮中表达,可能参与调控雌蕊的发育[17]。小麦WAG-2基因与花器官发育,尤其是雌蕊、心皮、胚珠的发育密切相关[18]。这也进一步证明本实验得到的3个基因很可能具有与其他植物类似的调控雄蕊、子房、花蕾、花萼等的发生发育的作用,为该基因的遗传转化及兰属植物新品种的培育提供了理论基础,下一步实验可以通过模式植物验证其基因功能。
3.2 两种国兰AG基因表达比较
蕙兰CfAG1和墨兰CsAG1表达特性相似,表达丰度最高的部位均是盛花期合蕊柱,其次是花蕾,接着是子房。二者与蕙兰CfAG2的表达特性较为一致的是,合蕊柱、子房中的表达量均比较高;不太一致的是在蕙兰中子房是CfAG2表达丰度最高的部位,花蕾中表达丰度相对较低。可以肯定的是这3个基因均能调控合蕊柱和子房的发育,推断3个基因均属于C功能基因;蕙兰CfAG1和墨兰CsAG1还调控花蕾的发育。二球悬铃木PaAG2在整个果实的发育过程中的表达量较高,更特异地在果实中表达,与B类基因PlacPI2a以及E类基因PlacSEP1有强烈互作[19]。AG是引发植物生殖器官发育的调控基因之一,本实验结果中合蕊柱、子房和花蕾中AG基因的高丰度表达很好地证实了AG基因与生殖器官发育引发的密切关系,也为兰属植物生殖器官尤其是兰科植物的特征器官合蕊柱的发育研究提供了很好的支持。
3.3 AG与AP1对花器官的控制
C类基因和A类基因在自身调控表达的器官或组织内彼此抑制[20]。在花发育进程中首先表达的是AP1和AP2两种A类基因,作为一种花分生组织特异性表达基因的AP1早在器官特异性基因的被激活前已经表达,比如CfAP11[21]和CfMADS1[22]的表达在蕙兰成苗期的叶片中就已经检测到,萼脊兰AP1-like也可能在调控植物由营养生长向生殖生长过渡阶段起重要作用[23]。由于A、C两类基因间的彼此抑制,一旦C类基因AG被激活表达后,即可在花器官的3、4轮对A类基因AP1抑制表达,比如在盛花期合蕊柱中CfAG1、CfAG2、CsAG1表达丰度高,而CfAP11和CfMADS1几乎检测不到[21-22],正好验证了C类基因AG对A类基因AP1表达的抑制; 而在花器官1、2轮AG基因被A类基因AP2抑制表达,而不是AP1,AP1不抑制AG基因的表达,例如,有研究表明,AP1和AG基因被LEAFY(LFY) 直接靶向,AP1对AG基因的表达不抑制[24-25],而AP2和CURLYLEAF(CLF)、LEUNIG(LUG)、STERILEAPETALA(SAP)、ANTEGUMENTA(ANT) 和SEUSS(SEU) 5个基因抑制AG基因在第1轮和第2轮花器官中表达[26-27]。在我们的实验中,在盛花期的花萼中CfAG2、CsAG1有一定量的表达,也证明了AG基因的表达不被AP1抑制。
维持及终止花分生组织干细胞的活性由C 类花器官特征基因AG调控[4]。同一器官或组织的不同发育时期,CfAG1、CfAG2和CsAG1基因的表达特性有所区别,进一步表明该基因参与了蕙兰和墨兰的花发育过程,然而3个基因的功能还需要遗传转化实验进一步去验证。再者,AG基因也属于开花调节基因,开花分子生物学研究一直是国际上的研究热点,然而AG基因控制调节开花方面的研究报道还比较少。同时,AG基因的持续表达导致茉莉酸甲酯产生也是拟南芥开花时间较短的主要原因[28]。综上所述,本结果为后期兰属植物花发育、遗传转化及新品种培育等研究提供了一定的基础数据和科学依据。
