马来西亚产小果沉香所结沉香的GC-MS分析
2021-09-14王军梅文莉王昊王雅丽段瑞军黄圣卓戴好富
王军 梅文莉 王昊 王雅丽 段瑞军 黄圣卓 戴好富


摘 要:采用乙醚超聲萃取法提取马来西亚产小果沉香所结沉香的挥发性成分,运用气相色谱-质谱(GC-MS)技术分析其化学成分,并与马来西亚产白木香、柯拉斯那沉香和近全缘沉香结香样品进行对比分析。结果表明,小果沉香结香样品挥发性成分的组成的主要为5,8-二羟基-2-(2-苯乙基)色酮、对映-4(15)-桉叶烷-11-醇-1-酮、6-甲氧基-2-(2-苯乙基)色酮和(1β,4αβ,7β,8αβ)-八氢-7-[1-(羟甲基)乙烯基]-1,8α-二甲基萘-4α(2H)-醇(相对百分含量均超过10%),栽培结香样品与野生结香样品区别较大,前者倍半萜类化合物相对百分含量明显高于色酮类化合物,而后者则是色酮类化合物相对百分含量高于倍半萜类化合物或相当,前者倍半萜和色酮种类均较多,其中倍半萜的种类也多于色酮类化合物,其相对百分含量也较高,色酮的种类较少,其相对百分含量也较低,而后者倍半萜和色酮的种类均较少,其中倍半萜的种类多于色酮类化合物,但相对百分含量较低,而色酮的种类少,但相对百分含量却较高。另外,有一种倍半萜类化学成分,即11,13-二羟基-9(10)-烯-8α,12-环氧艾里莫芬烷只在栽培小果沉香结香样品中检测到。此外,将小果沉香与白木香、柯拉斯那沉香、近全缘沉香结香样品中挥发性成分对比分析发现,其种类、相对百分含量与后三者均具有较大差异,所有样品中仅有2种共有成分,即5,8-二羟基-2-(2-苯乙基)色酮和6-甲氧基-2-(2-苯乙基)色酮。
关键词:小果沉香;栽培结香样品;野生结香样品;GC-MS分析
Abstract: The volatile components of agarwood from Aquilaria microcarpa in Malaysia were extracted by ether ultrasonic extraction and its chemical constituents were analyzed by gas chromatography-mass spectrometry (GC-MS) and were compared with those from Malaysia such as A. sinensis, A. crassna and A. subintegra. The results indicated that 5,8-dihydroxy-2-(2-phenylethyl)chromone, ent-4(15)-eudesmen-11-ol-1-one, (1β,4αβ,7β,8αβ)-octahydro-7-[1-(hydrox y m ethyl) ethenyl]-1,8α-dimethylnaphthalen-4α(2H)-ol and 6-methoxy-2-(2-phenylethyl) chromone (the relative percen tages were all above 10%) were the main volatile components of A. microcarpa samples. There was a big difference between the agarwood samples from cultivated and wild tree, the relative percentage contents of sesquiterpenoids was significantly higher than that of chromones in the former, while the relative percentage contents of chromones was higher than that of sesquiterpenoids or equivalent in the latter. There were more kinds of sesquiterpenoids and chromones in the former, among which the kinds and the relative percentage contents of sesquiterpenoids were more than chromones. However, the latter were less, among which the kinds of sesquiterpenoids were more than chromones, but the relative percentage was relatively low, while the relative percentage of chromones was higher. In addition, a sesquiterpenoid of 11,13-dihydroxy- 9(10)-ene-8α,12-epoxyemophilane was only detected in the agarwood samples from cultivated samples of A. microcarpa. Moreover, the volatile components of Agarwood samples from A. microcarpa, A. sinensis, A. crassna and A. subintegra were compared and analyzed. The results showed that the kinds and relative percentage contents of compounds from A. microcarpa were significantly different from those of the latter three. There were only two common components in all samples, namely 5,8-dihydroxy-2-(2-phenylethyl) chromone and 6-methoxy- 2-(2-phenylethyl)chromone.
Keywords: Aquilaria microcarpa; cultivated agarwood samples; wild agarwood samples; GC-MS analysis
马来西亚野生分布有5种瑞香科(Thymel aeaceae)沉香属(Aquilaria Lam.)植物,分别为小果沉香(A. microcarpa Baill.)、贝卡利沉香(A. beccariana Tiegh.)、马来沉香(A. malaccensis Lam.)、毛沉香(A. hirta Ridl.)和丝沉香[A. filaria (Oken) Merr.],其中小果沉香和贝卡利沉香主要分布于东马来西亚的砂拉越(Sarawak)地区,而后3种则主要分布于西马来西亚[1]。据调查与实地考察,近年来,还有从其他国家引种至马来西亚种植栽培的种类主要有白木香[A. sinensis (Lour.) Spreng.]、柯拉斯那沉香(A. crassna Pierre ex Lecomte)和近全缘沉香(A. subintegra Ding Hou)等。
小果沉香被认为是砂拉越地区重要的硬木之一[2],其为大乔木,高可达40 m,生于海拔低于200 m的低地雨林中,在马来西亚砂拉越州广布[3]。该种与马来沉香形态特征相近,但其果实较小,雄蕊等于或短于花瓣,可与之区别[4]。到目前为止,有关其研究主要包括解剖学研究[2]、栽培生理[5-7]、营养繁殖[8]、组织培养[9]、生殖生态学[10]、生物合成[11]、分子生物学与代谢组学[12-14]、与微生物互作[15-19]、微生物结香[20-21]、声波层析成像技术探测沉香[22]等,而对其相关的化学成分和药理活性的研究报道较少,如接菌结香小果沉香叶片甲醇提取物的抗氧化活性成分[23];小果沉香茎皮中的酚类化合物(phenolic)[24];小果沉香莖皮中的黄酮类化合物(flavonoid)[25];小果沉香结香样品乙醇提取物对金黄色葡萄球菌(Staphylococcus aureus)和奇异变形杆菌(Proteus mirabilis)的抗菌活性实验[26];酚类物质在小果沉香中作用[27];小果沉香的接菌结香样品提取物(Kemedangan)抗氧化活性研究[28]。而有关小果沉香结香样品中化学成分方面未有报道,因此,本文在前期调查取样的基础上,对小果沉香结香样品的挥发性成分进行了GC- MS分析,并与马来西亚产白木香、柯拉斯那沉香和近全缘沉香的结香样品挥发性成分进行了对比分析,旨在为小果沉香的进一步深入研究提供依据。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 9份样品中有6份采自东马来西亚砂拉越州,其中2份购自砂拉越与印度尼西亚边境小镇Serikin市场,2份样品采自西马来西亚柔佛州(Johor),1份采自森美兰州(Sembilan),样品信息见表1。S1~S6样品由砂拉越森林局(Sarawak Forest Bureau)Dawend jiwaN(大文吉湾)先生鉴定其基源植物为小果沉香(Aquilaria microcarpa Baill.),S7~S9由王军博士和马来西亚钟楠贵先生共同依次鉴定其基源植物为白木香[A. sinensis (Lour.) Spreng.]、柯拉斯那沉香(A. crassna Pierre ex Lecomte)和近全缘沉香(A. subintegra Ding Hou)。所有输液法结香技术均为中国热带农业科学院热带生物技术研究所研发的整树结香技术。凭证标本均存放于中国热带农业科学院热带生物技术研究所。
使用的试剂均为分析纯。
1.1.2 仪器与设备 Agilent 7820A-Agilent 5977E气质联用仪,美国安捷伦公司;色谱柱为HP-5MS 5% Phenyl Methyl Siloxane(30 mm×0.25 mm× 0.25 μm)弹性石英毛细管柱;EN2062电子秤,上海民侨精密科学仪器有限公司;B5510E-MT超声波清洗仪,美国Bransonic公司。
1.2 方法
1.2.1 样品制备 选取6份小果沉香与各1份的白木香、柯拉斯那沉香和近全缘沉香(共9份)体积相同的结香树干,分别去除白木,将沉香和其余部位分开。将沉香块分别粉粹后,再均匀混合,各取20 g,分别加入60 mL乙醚溶剂进行超声提取3次,每次超声30 min,静置5 min后过滤得到乙醚提取液,合并3次提取液,挥干后得到油状提取物。分别取油状提取物适量,配制成1 mg/mL的待测样品溶液。
1.2.2 GC-MS分析条件 (1)色谱条件。色谱柱为HP-5MS 5% Phenyl Methyl Siloxane(30 m× 0.25 mm×0.25 μm)弹性石英毛细管柱。升温程序:柱温50 ℃,以5 ℃/min升温至310 ℃,保持10 min。汽化室温度250 ℃;载气为高纯He(99.999%);载气流量1.0 mL/min;不分流进样;溶剂延迟时间4.0 min。
(2)质谱条件。电子轰击(EI)离子源;电子能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;接口温度280 ℃;发射电流34.6 μA;倍增器电压1612 V;质量扫描范围40~800 m/z。
2 结果与分析
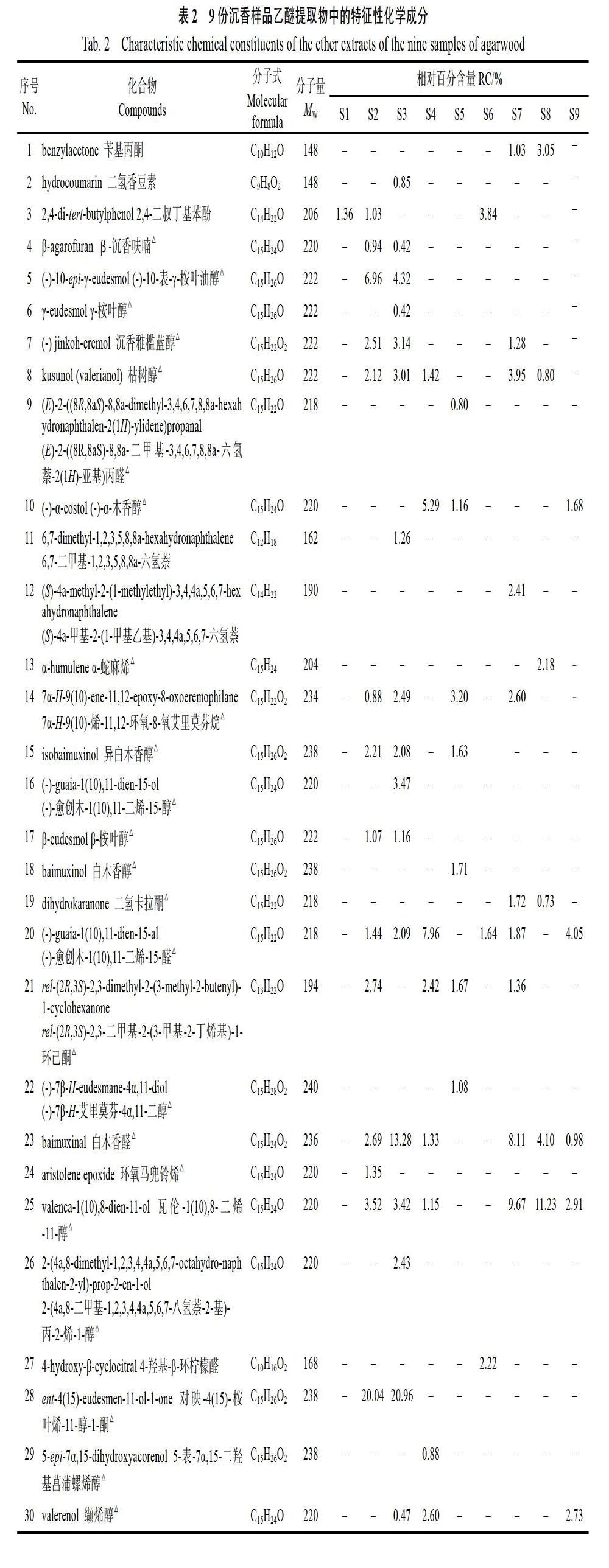
9份沉香样品乙醚提取物的总离子流图见图1,对总离子流图中的各峰经质谱数据系统检索及核对Nist2005和Wiley275标准质谱图,并借鉴前人的鉴定方法[29-32],结合质谱图与文献数据进行对照,并用峰面积归一化法测定色谱峰在样品中的总相对含量分别为小果沉香S1~S6:67.81%、82.83%、96.44%、96.66%、100.00%、68.49%和白木香(98.87%)、柯拉斯那沉香(100.00%)和近全缘沉香(94.16%),具体见表2。所检测和鉴定的倍半萜和色酮个数和相对百分含量分别为S1:倍半萜10个(34.39%)、色酮3个(30.93%),其中含量最大的成分为5,8-二羟基-2-(2-苯乙基)色酮(28.35%),其次为奇楠愈创木酮(8.23%);S2:倍半萜19个(63.38%)、色酮4个(18.42%),其中含量最大的成分为对映-4(15)-桉叶烷-11-醇- 1-酮(20.04%),其次为5,8-二羟基-2-(2-苯乙基)色酮(13.69%);S3:倍半萜19个(76.50%)、色酮3个(17.83%),其中含量最大的成分为对映- 4(15)-桉叶烷-11-醇-1-酮(20.96%),其次为5,8-二羟基-2-(2-苯乙基)色酮(16.87%);S4:倍半萜17个(61.67%)、色酮6个(34.99%),其中含量最大的成分为5,8-二羟基-2-(2-苯乙基)色酮(14.96%),其次为(1β,4aβ,7β,8aβ)-八氢-7-[1-(羟甲基)乙烯基]-1,8a-二甲基萘-4a(2H)-醇(14.45%);S5:倍半萜11个(30.51%)、色酮4个(69.49%),其中含量最大的成分为5,8-二羟基-2-(2-苯乙基)色酮(40.09%),其次为6-甲氧基-2-(2-苯乙基)色酮(12.40%);S6:倍半萜6个(21.55%)、色酮4个(39.78%),其中含量最大的成分为5,8-二羟基- 2-(2-苯乙基)色酮(29.70%),其次为6,7-二甲氧基-2-(2-苯乙基)色酮(8.43%);S7:倍半萜10个(34.39%)、色酮7个(60.12%),其中含量最大的成分为6,7-二甲氧基-2-(2-苯乙基)色酮(39.10%),其次为瓦伦-1(10),8-二烯-11-醇(9.67%);S8:倍半萜11个(31.57%)、色酮6个(65.38%),其中含量最大的成分为6-甲氧基- 2-(2-苯乙基)色酮(22.96%),其次为2-(2-苯乙基)色酮(21.40%);S9:倍半萜12个(53.87%)、色酮5个(38.22%),其中含量最大的成分为6-甲氧基-2-(2-苯乙基)色酮(16.21%),其次为(+)-9-羟基-芹子-4,11-二烯-14-醛(14.61%)。
3 讨论
倍半萜类成分和色酮类成分是沉香中2类特征性成分,也是沉香的主要成分[33-35]。本研究通过GC-MS分析发现,9份沉香样品中倍半萜类和色酮类成分的总相对百分含量为68.49%~ 100.00%。所有样品中只有2种成分为共有成分,即5,8-二羟基-2-(2-苯乙基)色酮和6-甲氧基-2-(2-苯乙基)色酮,其中前者在小果沉香中的相对百分含量均较高,超过10.00%,最高可达40.09%(S5),而在白木香、柯拉斯那沉香和近全缘沉香均较低,分别为8.40%,12.15%和3.42%。杨峻山等[36]报道了5,8-二羟基-2-(2-苯乙基)色酮在国产白木香所产沉香中首次分离得到。
杨锦玲等[37]曾报道越南产柯拉斯那沉香中的黄熟香和吊口香中也有5,8-二羟基-2-(2-苯乙基)色酮,且相对百分含量也较高。另外,邵杭等[38]在柳叶拟沉香中也分离得到该化合物,并发现其对乙酰胆碱酯酶具有一定的抑制活性,抑制率为38.0±1.0(50 μg/mL)。雷智东[39]报道该化合物对金黄色葡萄球菌有较强的抑制作用。赵桐[40]用茉莉酸甲酯(MeJA)气雾成功诱导白木香产生2种色酮,其中包括6-甲氧基-2-(2-苯乙基)色酮,表明该化合物可由人工诱导产生,但目前对其生物活性方面研究未见报道。
6份小果沉香结香样品中挥发性成分变化较大,但野生沉香与栽培沉香结香样品具有较大差别,其中野生樣品(S1、S5、S6)中的倍半萜和色酮的种类均较少,二者之和分别为14种、15种和10种,其中倍半萜的相对百分含量较低(<40%),而色酮的种类少,但相对百分含量较高(>30%)。而栽培样品(S2、S3、S4)中的倍半萜和色酮种类均较多,二者之和分别为23种、22种和23种,其中倍半萜的相对百分含量较高(>60%),而色酮相对百分含量较低(<40%)。所有小果沉香栽培结香样品中均有白木香醛(S2为2.69%、S3为13.28%、S4为1.33%)和瓦伦萨- 1(10),8-二烯-11-醇(S2为3.52%、S3为3.42%、S4为1.15%),它们在3种其他种类的沉香中也均含有,其含量分别为(S7为8.11%,9.67%;S8为4.10%,11.23%;S9为0.98%,2.91%),而在小果沉香野生结香样品中则未检测到。另外,11,13-二羟基-9(10)-烯-8α,12-环氧艾里莫芬烷(S2为1.23%、S3为1.23%、S4为0.79%)只在栽培小果沉香结香样品中检测到。野生的自然结香年限相对较长,色酮类化合物所占比例较大,而栽培沉香结香的年限较短,倍半萜类化合物所占比例较大。杨锦玲等[41]建立了白木香结香样品的指纹图谱,研究结果发现,倍半萜类化合物以白木香醛为主(相对百分含量为0.83%-27.20%),色酮类化合物以6,7-二甲氧基-2-(2-苯乙基)色酮为主(相对百分含量为1.40%-31.23%),5,8-二羟基-2-(2-苯乙基)色酮也有,但含量较低(2.00%- 6.57%)。而本次试验的白木香结香样品中的倍半萜类化合物以瓦伦-1(10),8-二烯-11-醇(9.67%)为主,其次为白木香醛(8.11%),色酮类化合物以6,7-二甲氧基- 2-(2-苯乙基)色酮为主(39.10%),其次为5,8-二羟基-2-(2-苯乙基)色酮(8.40%),与杨锦玲等[41]的研究结果基本一致。
楊锦玲等[37]曾报道越南柯拉斯那沉香之红土沉香、黄熟香和吊口香的乙醚提取物GC-MS分析,结果表明,红土沉香和黄熟香均以色酮类成分为主,种类也较多,相对百分含量分别为71.27%(11种)和68.10%(14种),前者又以2-[2-(4-甲氧基)苯乙基]色酮(28.94%)、2-(2-苯乙基)色酮(22.63%)、2-[2-(3-羟基-甲氧基)苯乙基]色酮(14.27%)为主要成分,后者以6,7-二甲氧基-2-(2-苯乙基)色酮(39.11%)和5,8-二羟基-2-(2-苯乙基)色酮(5.57%)为主。越南吊口沉香以倍半萜类化合物较多,总相对百分含量为21.31%,其中又以白木香醛(16.00%)为主。而本次研究的柯拉斯那沉香的倍半萜类成分以瓦伦-1(10),8-二烯-11-醇(11.23%)为主,色酮类成分以6-甲氧基-2-(2-苯乙基)色酮(22.96%)、2-(2-苯乙基)色酮(21.40%)、5,8-二羟基-2-(2-苯乙基)色酮(12.15%)、6,7-二甲氧基-2-(2-苯乙基)色酮(5.41%)为主,与越南柯拉斯那沉香之黄熟香相近。
Pripdeevech等[42]采用固相微萃取的方法,研究了近全缘沉香的挥发性成分,结果表明,其相对百分含量最大的成分为十二酸异戊酯(isoamyl dodecanoate)(38.00%),其次为枯树醇(kusunol)(6.40%)和沉香雅蓝醇(jinkoh-eremol)(5.60%)。Monggoot等[43]采用4种内生真菌诱导近全缘沉香产生沉香,挥发性成分研究结果表明,含量最高的成分为氧化沉香螺旋醇(oxo-agarospirol),其相对百分含量均超过50.00%。本次研究结果与此前的研究有较大差异,其中含量最大的成分为6-甲氧基-2-(2-苯乙基)色酮(16.21%),其次为(+)-9-羟基-芹子-4,11-二烯-14-醛(14.61%),这可能跟结香方法和提取方法等有关。
综上所述,小果沉香结香样品油脂的化学成分组成以5,8-二羟基-2-(2-苯乙基)色酮为主,野生结香样品与栽培结香样品区别较大,野生样品中的倍半萜和色酮的种类均较少,其中倍半萜的种类多于色酮类化合物,但相对百分含量较低,而色酮的种类少,但相对百分含量却较高。栽培结香样品中的倍半萜和色酮种类均较多,其中倍半萜的种类也多于色酮类化合物,其相对百分含量也较高,色酮的种类较少,其相对百分含量也较低。另外,有一种倍半萜类化学成分,即11,13-二羟基-9(10)-烯-8α,12-环氧艾里莫芬烷只在栽培小果沉香结香样品中检测到。另外,将小果沉香与白木香、柯拉斯那沉香、近全缘沉香结香样品对比分析发现,所有种类和样品中有2种共有成分,即5,8-二羟基-2-(2-苯乙基)色酮和6-甲氧基- 2-(2-苯乙基)色酮。小果沉香与白木香、柯拉斯那沉香、近全缘沉香结香样品的种类与相对百分含量具有较大差异。本研究可以为小果沉香的真伪鉴定及质量标准研究等方面提供重要参考。
参考文献
Whitmore T C. Tree flora of Malaya[M]. Malaysia: Longman, 1973, 2: 383-386.
Bosi A C. Young stem and petiole anatomy of Aquilaria beccariana Van teigh and Aquilaria microcarpa Baill. (Gaharu Engkaras) in Sarawak[D]. Malaysia: University Malaysia Sarawak, 2004: 1-29.
Hou D. Thymelaeaceae. Flora Malesiana[M]. Groningen, The Netherlands: Wolters-Noordhoff Publishing, 1960: 1-48.
Cockburn B A. Trees of Sabah, vol.1[M]// Sabah forest record No. 10. Malaysia: Borneo Literature Bureau, Forest Department Sabah, 1976: 253-354.
Fauzi M K B M. Growth performance of Aquilaria microcarpa Baill. (Gaharu) seedlings under different light intensity and fertilizer application[D]. Malaysia: University Malaysia Sarawak, 2006: 1-44.
Kenmotsu Y, Yamamura Y, Kurosaki F. Expression of specific calmodulin genes isolated from tissue cultured cells of Aquilaria microcarpa in response to methyl jasmonate and yeast extract[J]. In Vitro Cellular and Development Biology-Plant, 2012, 48: 627-631.
Rou C L H. The effect on Nigrogen on the growth of stock plant and subsequent rooting of cuttings of Aquilaria microcarpa Baill. [D]. Malaysia: University Malaysia Sarawak, 2012: 1-58.
Yung C Y. Vegetative propagation of Aquilaria microcarpa Baill. (Gaharu) by stem and branch cuttings[D]. Malaysia: University Malaysia Sarawak, 2013: 1-57.
Ramalingam L S. Establishment of callus and suspension culture of Aquilaria microcarpa Baill. using leaf explant[D]. Malaysia: University Malaysia Sarawak, 2015: 1-89.
Soehartono T, Newton A C. Reproductive ecology of Aquilaria spp. in Indonesia[J]. Forest Ecology and Management, 2001, 152: 59-71.
Ogita S, Lee J B, Kurosaki F, et al. The biosythetic activities of primary and secondary metabolites in suspension cultures of Aquilaria microcarpa[J]. Natural Product Communications, 2015, 10(5): 779-782.
Fumiya K, Taura F. Transcriptional activation of sesquiterpene biosynthetic enzymeδ-guaiene synthase gene in cell cultures of Aquilaria microcarpa overexpressing cam1 and rac2 encoding calmodulin and Rac GTPase[J]. Plant Gene, 2015, 2: 25-28.
Kurosaki F, Hirohashi S, Katoh T, et al. Cloning and characterization of δ-Guaiene synthase genes encoding a sesquiterpene cyclase from Aquilaria microcarpa cell cultures[J]. American Journal of Plant Sciences, 2015, 6: 2603-2611.
Kurosaki F, Taura F. Transciptional activation of sesquiterpene biosynthetic enzyme δ-guaiene synthase gene in cell cultures of Aquilaria microcarpa overexpressing cam1 and rac2 encoding calmodulin and Rac GTPase[J]. Plant Gene, 2015, 2: 25-28.
Siburian R H S, Siregar U, Siregar I, et al. The genotype of Aquilaria microcarpa interacting with Fusarium sp. based on microsatellite marker[J]. Asian Journal of Microbiology, Biotechnology and Enviromental Scieces, 2019, 21(2): 143- 148.
Karlinasari L, Indahsuary N, Kusumo H T, et al. Sonic and ultrasonic waves in Agarwood trees (Aquilaria microcarpa) inoculated with Fusarium solani[J]. 2015, 27(3): 351-356.
Siburian R H S, Siregar U J, Siregar I Z, et al. Identification of Anatomical characteristics of Aquilaria microcarpa in ITS interaction with Fusarium solani[J]. Biotropia, 2013, 20(2): 104-111.
Siburian R H S, Siregar U J, Siregar I Z, et al. Identification of Morphological Characters of Aquilaria microcarpa in the Interaction with Fusarium solani[J]. International Journal of Sciences: Basic and Applied Research, 2015, 20(1): 119-128.
Akhsan N, Mardji D, Sutisna M. Response of Aquilaria microcarpa to two species of Fusarium under two different cultivation systems[J]. Journal of Tropical Forest Science, 2015, 27(4): 447-455.
Wulandari E. Efektivitas Acremonium sp. dan Fusarium sp. sebagai penginduksi ganda terhadap pembentukan Gaharu pada pohon Aquilaria microcarpa[D]. Indonesia: Bogor Agricultural University, 2009: 1-13.
Rahayu G, Santoso E, Wulandari E. Efektivitas dan Interaksi antara Acremonium sp. dan Fusarium sp. Dalam pembentukan gubal Gaharu pada Aquilaria microcarpa Baill.[J]. Info Hutan, 2010, 7(2): 155-164.
Indahsuary N, Nandika D, Karlinasari L, et al. Reliability of sonic tomography to detect agarwood in Aquilaria microcarpa Baill.[J]. Journal of the Indian Academy Wood Science, 2014, 11(1): 65-71.
Mukti M J. Profil kimia fraksi aktif antioksidan dari ekstrak metanol daun pohon penghasil Gaharu Aquilaria microcarpa hasil inokulasi[D]. Indonesia: Bogor Agricultural University, 2016: 1-27.
Kristanti A N, Tanjung M, Rahayu O P, et al. Phenolic compounds from Aquilaria microcarpa stem bark[J]. Journal of Chemical Technology and Biotechnology, 2017, 52: 1111.
Kristanti A N, Tanjung M, Rahayu O P. Flavonoid from stem bark of Aquilaria microcarpa[J]. Egyptian Journal of Chemistry, 2018, 61(2): 313-316.
Sari R, Muhani M, Fajriaty I. Uji Aktivitas Antibakteri Ekstrak Etanol Daun Gaharu (Aquilaria microcarpa Baill.) Terhadap Bakteri Staphylococcus aureus dan Proteus mirabilis[J]. Pharmaceutical Sciences and Research, 2017, 4(3): 143-154.
Novriyanti E, Santosa E. The role of Phenolics in Agarwood formation of Aquilaria crassna Pierre ex Lecomte and Aquilaria microcarpa Baill. trees[J]. Journal of Forestry Research, 2011, 8(2): 101-113.
Ramadhan P M. Aktivitas antioksidan ekstrak kemedangan phohon penghasil Gaharu hasil inokulasi jenis Aquilaria microcarpa dan Gyrinops verstegii[D]. Indonesia: Bogor Agricultural University, 2009: 1-24.
Ishihara M, Tsuneya T, Uneyama K. Fragrant sesquiterpenes from agarwood[J]. Phytochemistry, 1993, 33(5): 1147-1155.
Mei W L, Yang D L, Wang H, et al. Characterization and determination of 2-(2-Phenylethyl) chromones in agarwood by GC-MS[J]. Molecules, 2013, 18: 12324-12345.
梅文莉, 楊德兰, 左文健, 等. 奇楠沉香中2-(2-苯乙基)色酮的GC-MS分析鉴定[J]. 热带作物学报, 2013, 34(9): 1819-1824.
杨德兰, 梅文莉, 杨锦玲, 等. GC-MS分析4种奇楠沉香中致香的倍半萜和2-(2-苯乙基)色酮类成分[J]. 热带作物学报, 2014, 35(6): 1235-1243.
郭晓玲, 田佳佳, 高晓霞, 等. 不同产区沉香药材挥发油成分GC-MS分析[J]. 中药材, 2009, 32 (9): 1354-1358.
Naef R. The volatile and semi-volatile constituents of agarwood, the infected heartwood of Aquilaria species: a review[J]. Flavour & Fragrance Journal, 2011, 26: 73-87.
陈晓颖, 高 英, 李卫民, 等. 不同结香方法与国产沉香挥发性化学成分的相关性研究[J]. 中国药房, 2012, 23 (11): 1017-1020.
杨峻山, 王玉兰, 苏亚伦. 国产沉香化学成分的研究——V. 三个2-(2-苯乙基)色酮衍生物的分离和鉴定 [J]. 药学学报, 1990, 25(3): 186-190.
杨锦玲, 梅文莉, 董文化, 等. 3种越南产沉香的GC-MS分析[J]. 热带作物学报, 2015, 36(8): 1498-1504.
邵 杭, 梅文莉, 李 薇, 等. 柳叶拟沉香所产沉香的化学成分研究[J]. 天然产物研究与开发, 2015, 27(12): 2046-2049, 2078.
雷智东. 沉香抗菌活性成分的研究[D]. 广州: 广东药学院,, 2015: 1-61.
赵 桐. MeJA诱导白木香气雾根产生2-(2-苯乙基)色酮的研究[D]. 广州: 广州中医药大学, 2017: 1-81.
杨锦玲, 梅文莉, 董文化, 等. 沉香GC-MS指纹图谱分析[J]. 中成药, 2016, 38(8): 1765-1770.
Pripdeevech P, Khummueng W, Park S K. Identification of Odor-active components of agarwood essetial oils from Thailand by solid phase microextraction-GC/MS and GC-O[J]. Journal of Essential Oil Research, 2011, 23: 46-53.
Monggoot S, Popluechai, Gentekaki E, et al. Fungal endophytes: an alternative source for production of volatile compounds from agarwood oil of Aquilaria subintegra[J]. Microbial Ecology, 2017: 1-8.
责任編辑:崔丽虹
