橡胶树NIPs通道蛋白的生物功能分析
2021-09-14史翔宇龙翔宇方永军阳江华肖小虎秦云霞
史翔宇 龙翔宇 方永军 阳江华 肖小虎 秦云霞


摘 要:根瘤素26-like内在蛋白(nodulin 26-like intrinsic proteins, NIPs)是水通道蛋白(aquaporin protein, AQP)中一个植物特有的亚类,主要定位在质膜或内质网膜上,负责转运不带电荷的类金属溶质如硼、甘油、尿素、硅、砷、H2O2、NH3等,在植物营养获取或胁迫应答过程中发挥着重要作用。本研究以拟南芥NIPs序列为参照,利用多种生物信息学软件,对橡胶树7个HbNIPs的基因结构、蛋白理化性质、聚类分析、组织表达及割胶处理的应答进行综合分析。根据分析结果可以初步推断:7个HbNIPs应是有功能的转运蛋白,它们不但具有AQP典型的跨膜结构域(4~6个),保守的NPA基序和关键的ar/R筛选氨基酸,而且从聚类的结果可以推断它们具有转运硼酸、尿素和乳酸的功能。另外,从其启动子调控元件、表达分析和翻译后修饰分析可知,它们的活性及表达具有受发育阶段、多种激素和磷酸化修饰的严谨调控。该初步结果有助于进一步研究橡胶树NIP家族基因的功能及其在橡胶树创新育种中的应用。
关键词:橡胶树;根瘤素26-like内在蛋白;水通道蛋白;类金属元素
Abstract: Nodulin 26-like intrinsic proteins (NIPs) are one subclass of plant specific aquaporin protein (AQP), mainly located at cytoplasm or endoplasmic reticulum, in charge of exchange metalloids such as boron, silicon, arsenic, selenium, glycerol, carbamide, H2O2, NH3 etc., which are indispensible for plant microelement nutrition and stress responses. In this study, seven NIPs homologues of Arabidopsis were screened out on the rubber tree whole genome level, then bioinformations of their gene structure, protein domains and motifs, promter cis-acting elements and expression characteristics were in-depth analyzed through on-line softwares and PRISM. Totally, the seven HbNIPs were putative functional NIPs, because they owned all or partial typical characteristics of AQPs and clustered together with the homologues, such as typical domains for transmembrane, conservative NPA motifs and key ar/R amino acid for substrate determination. From the phylogenetic analysis results, they were predicated to be possibly involved in metalloids assimilation such as boron or glycerol, or lactate. In addition, from the analyses of cis-acting elements in the promoters, expression profiles and post-translational modifications, it is obvious that the activities would be critically regulated by development stages or hormones or phosphorylation. The primary results would benefit for further study on the function and utilization in rubber trees innovative breeding.
Keywords: Hevea brasiliensis; nodulin 26-like intrinsic proteins; aquaporin protein, AQP; metalloid
水通道蛋白(aquaporin protein, AQP)的重要性已經为人们所熟知,它们通过调节水分的吸收和转运,能够快速调节细胞体积、渗透压等,维系着细胞的生命和整个植物的水分平衡。它们如此重要而不断进化为成员众多,功能多样的主要内在蛋白MIP(major intrinsic protein)大家族。依据其亚细胞定位及氨基酸序列的同源性分为4大亚类:质膜内在蛋白(plasma membrane intrinsic proteins, PIPs),液泡膜内在蛋白(tonoplast intrinsic proteins, TIPs),根瘤素26-like内在蛋白(NOD26-like Intrinsic Proteins, NIPs)以及小分子碱性内在蛋白(small basic intrinsic proteins, SIPs)[1]。
根瘤素26-like内在蛋白(NOD26-like Intrinsic Proteins, NIPs)作为水通道蛋白AQP家族的一个大亚类,编码一类镶嵌式膜蛋白,形成让特异底物双向通过的选择性运输通道,主要转运一些不带电荷的小分子。与其他AQP蛋白亚类相同的是,NIPs同样以多基因家族的形式广泛存在于植物细胞中,家族成员较多;与其他AQP蛋白亚类不同的是,NIPs对水的透过率低或不透过水,而是转运一些其他非金属物质如硼酸、硅酸、甘油、硒和砷等,还有其他物质包括甲酰胺、尿素、甘油以及气体如氨气、过氧化氢H2O2等[2-9]。结构上,NIPs通过通道孔径及4个朝向膜内部的氨基酸组成的芳香族氨基酸/精氨酸(aromaticar ginine, ar/R)选择性过滤结构,严谨地选择通过底物的特异性[10-11]。目前已报道的NIPs拟南芥中有9个[8]、水稻10个[12]、玉米5个[13]、小麦4个[14]、大豆14个[15],其中拟南芥AtNIP5;1参与硼的高效吸收与转运,AtNIP6;l是负责将硼转运到生长中心后再分配[16-17];AtNIP1;1、AtNIP1;2、AtNIP5;1、AtNIP6;1、AtNIP7;1和OsNIP1;1都能转运砷[8-9,18-22];AtNIP1;2转运铝[23];OsNIP2;1转运硅[24]等。应用方面,过表达小麦TaNIP可增强植株耐盐性[25],而敲除水稻OsNIP3;1则使水稻因缺硼而生长发育严重受损[26]。因此科学家计划培育优质品种能够多吸收有益元素硒、硼、硅,不吸收或少吸收有毒砷或重金属镉等水稻品种,挖掘NIPs功能对于优质品种的分子改良具有重要意义[27]。
天然橡胶主要来源于巴西橡胶树,是一种重要的战略物资和工业原料。橡胶树在生长发育过程中的营养供给及割胶后胁迫清除的效率关系着其健康与丰产性。硼是橡胶树不可或缺的微量元素,缺硼时,叶片缩小变形;尤其是橡胶树开割后,随着胶乳的排出,整个排胶面内细胞代谢都被激活,水分、甘油、氮素、氨基酸等多种物质在乳管细胞间的转运,pH的制衡,H2O2等活性氧的产生与消除效率等都会影响胶乳再生效率[28-32],水通道蛋白家族的功能挖掘逐渐成为研究热点。目前已报道的7个橡胶树AQP基因[28-32],4个基因属于PIP家族,3个属于TIP家族,它们在受到乙烯利处理后,不同基因在韧皮部或乳管中转录水平有比较大的变化[29],推测乙烯是通过影响这些基因的表达而调控着木质部和韧皮部的水分循环,增加了排胶总量[33],而NIP家族基因的功能尚未见报道。
本研究以拟南芥NIPs序列为参照,通过橡胶树全基因组检索,筛选到7个可能的NIPs,对橡胶树NIPs的基因结构、蛋白理化性质和功能域等进行对比、聚类进化分析、以及基因组织表达及割胶处理的应答等方面进行系统分析,为发掘橡胶树NIP蛋白的功能提供参考。
1 材料与方法
1.1 橡胶树NIP基因的筛选与分析
以拟南芥、水稻NIP家族基因序列信息为参考,在橡胶树全基因组数据库中检索,去除冗余序列后,最终获得7个可能的NIP基因,它们的ID分别为HbNIP7;1(scaffold0091_20327)、HbNIP4;1(scaffold0103_1585880)、HbNIP1;2(scaffold0050_1992929)、HbNIP1;1(scaffold0123_ 1472792)、HbNIP3;1(scaffold0513_732267)、HbNIP5;1(scaffold0655_509650)和HbNIP6;1(scaffold0946_68795)。比对NIPs的全长DNA序列和CDS序列,利用GSDS2.0软件查询7个HbNIP基因的内含子和外显子构成,并进行基因结构解析;利用在线软件ProtParam tool、ProtComp 9.0(亚细胞定位)、CDD数据库、MOTIF、TMHMM Serverv.2.0和SOPMA等软件分析了HbNIPs的理化特性、亚细胞定位、保守结构域、跨膜结构域及二级结构特征。采用在线软件Netphos 3.1 Server(http://www.cbs.dtu.dk/ services/NetPhos/)预测HbNIPs可能的磷酸化位点。
1.2 橡胶树、拟南芥和水稻NIP家族成员进化树的构建
根据7个橡胶树NIP家族基因的氨基酸序列和从GenBank数据中下载获得的拟南芥和水稻NIP家族成员的氨基酸序列,利用DNAMAN进行氨基酸多序列比对,使用MEGA-X软件和邻接法(neighbor-joining,NJ)统计1000重复时,最近似的NIPs家族进化树。
1.3 HbNIPs基因启动子顺式元件分析
下载HbNIPs各基因编码区上游约1.5 kb的启动子序列,利用在线软件(PlantCARE)統计分析各基因启动子区顺式作用元件的数量和种类[34]。
1.4 橡胶树7个NIPs基因的组织及表达分析
本课题组已建立的转录组数据库是以橡胶树高产品种‘热研7-33-97品种为材料,构建了不同组织(胶乳、叶片、根、树皮、雌雄花、种子、胚芽)、叶片的不同发育时期(古铜期、变色期、淡绿期、成熟期)、1.5%乙烯利处理不同时间(0、3、12、24 h)以及橡胶幼苗高低温胁迫处理不同时间(4 ℃/45 ℃,0、6、12 h)的转录组数据库。各个基因的表达以(Reads Per Kilobase per Million mapped reads, RPKM)均一化处理。利用此数据库信息和PRISM数据分析软件,获得橡胶树各HbNIPs基因的表达模式。
2 结果与分析
2.1 HbNIPs的鉴定及其结构特征
为全面了解HbNIPs的生物学特征,以拟南芥NIPs序列为参照,利用多种生物信息学软件(软件信息见1.1-1.3)对其进行全面分析。从其基因结构可知(图1):不同HbNIPs基因间的外显子长度相似(除了HbNIP5;1的第一个外显子和HbNIP1;2的一个8氨基酸的小外显子外),内含子长度差异明显,比如HbNIP6;1基因全长达到3371 bp而HbNIP3;1只有1249 bp。除了HbNIP1;2多添加了一个8氨基酸的小外显子及HbNIP5;1被选择性剪接为3个外显子和2个内含子外,其他5个HbNIPs都含有5个外显子和4个内含子。
亚细胞定位预测是:除了HbNIP7;1特异地定位于质膜上外,其他6个HbNIPs既可以定位于质膜上,也可以定位在内质网上(表1)。HbNIP7;1基因结构和亚细胞定位的差异暗示着选择性剪接在HbNIPs基因家族进化中起着重要作用,有可能进化出新的功能。7个HbNIPs的基本生化特征是氨基酸长度为233~305 aa,相对分子量大小为24~32 ku,理论等电点pI 5.71~9.34,平均亲水系数范围是0.346~0.713;脂溶指数分析表明HbNIPs变动范围为95.22~113.02(表2)。
结构特征(CDD在线软件)和二级结构(SOMPA软件)分析结果发现HbNIPs二级结构均存在α螺旋,延伸带,β转角和随机扭曲,分布情况也相对一致,以α螺旋和随机扭曲为主,占比超过74%(表1)。7个HbNIPs结构域保守,其中有4个含有6个跨膜结构域(TM1-TM6),HbNIP6;1没有跨膜结构域TM3,HbNIP3;1没有TM4,因而这2个蛋白只有5个跨膜结构域,HbNIP1;2只有4个跨膜结构域(不含有包括TM1和TM2)(图2)。它们都含有2个典型的保守结构域NPA(Asn-Pro-Ala)motif,其中HbNIP5;1和HbNIP6;1中的NPA motif突变成NPS-NPV。(图2)由于缬氨酸V和丙氨酸A同为不带电荷的非极性氨基酸,所以NPV不会改变蛋白质的空间结构,而且其芳香族氨基酸/精氨酸所形成的选择过滤结构(ar/R selectivity filter)具有植物NIPs保守的FA-AR氨基酸组成,所以底物的特异性也应该不会改变(图2)。
总之,7个HbNIPs应是有功能的转运蛋白,它们不但具有AQP典型的跨膜结构域(4~6个),保守的NPA基序和关键的ar/R筛选氨基酸,而且其蛋白的理化性质等多个参数与已知拟南芥、水稻的同源NIPs相近,因此推测它们的功能很可能会相似(拟南芥、水稻的同源NIPs的参数略),能够分别特异地转运不同的底物。
2.2 橡胶树HbNIPs成员的生物学进化
为探寻HbNIPs的进化,与拟南芥AtNIPs和水稻OsNIPs一起构建了系统进化树(图3)。结果显示HbNIPs与拟南芥AtNIPs的进化关系更为接近,初步表明其进化的保守性,如HbNIP1;1-2与AtNIP1;1-2、HbNIP4;1和AtNIP4;1-2、HbNIP5;1与AtNIP5;1、HbNIP6;1与AtNIP6;1、HbNIP7;1与AtNIP7;1等分别聚类在相近的进化分支上。然而,也有单子叶植物与双子叶的拟南芥和高大乔木橡胶树的成员聚在一起,例如水稻的OsNIP3;1与AtNIP5;1、HbNIP5;1、AtNIP6;1和HbNIP6;1聚在一起,而OsNIP2;1和OsNIP2;2、OsNIP4;1则单独聚类在不同分支上,这表明部分NIPs功能的保守性和相似性,部分NIPs的功能分化晚于物种间的分化,聚类结果对于鉴定同源基因的功能具有重要的指导意义。
2.3 HbNIPs的调控特征
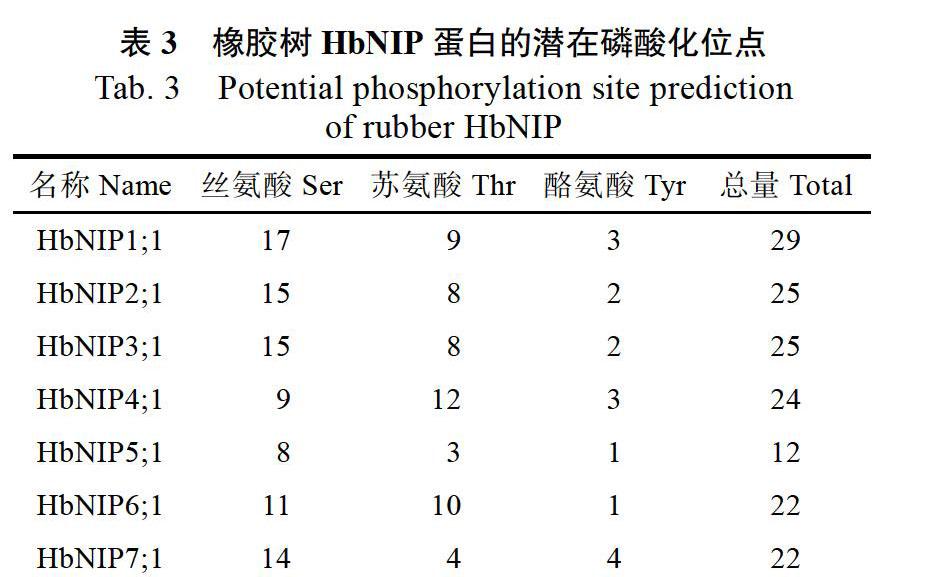
已有文献表明水稻中的NIPs活性受磷酸化修饰调控。利用软件Netphos 3.1 Server分析结果如下,HbNIPs氨基酸序列中存在很多个可能的磷酸化位点,预测分值大于0.5的丝氨酸、苏氨酸和酪氨酸的数量(表3)。众多磷酸化位点的存在预示着磷酸化调控很可能是调控HbNIPs活性的重要方式。
2.4 HbNIPs启动子元件分析
HbNIPs基因启动子分析统计结果表明:各个基因启动子中具有应答多种逆境和激素的顺式调控元件,数量差异很大而且各个基因的具有偏好性(表4):比如与光感知应答有关的LR(light responsive)元件53个;HbNIP4;1有与无氧胁迫相关的ARE(anaerobic induction)元件4个;HbNIP7;1中有4个CGTCA(甲基茉莉酸应答元件)等、與干旱有关的MBS元件与防御胁迫(defense and stress responsiveness)有关的TC-rich repeat元件;还有其他激素应答元件:TGA(生长素)、ERE(乙烯利)、P-box或者TATC-box(赤霉素)、ABRE(脱落酸)和TCA(水杨酸)。这些信息暗示HbNIPs的功能参与橡胶树逆境胁迫应答,其表达受到多种激素协同调控。
2.5 HbNIPs基因的组织表达及随叶片发育的表达特征
HbNIPs在胶乳、树叶、根、树皮、雌花、雄花和种子等7个组织中的表达分析结果(图4A)表明:它们组织表达模式各不相同。HbNIP3;1、HbNIP4;1和HbNIP7;1在7种组织中表达量都很低几乎检测不到,而HbNIP1;1、HbNIP1;2、HbNIP5;1和HbNIP6;1四个基因的表达水平较高些而在各个组织中各有偏重,其中HbNIP5;1在叶、根、雄花、雌花4个组织中都是优势表达的基因;HbNIP1;2在树皮中表达最高;HbNIP1;1在种子中表达最高;在胶乳中只有HbNIP1;1、HbNIP1;2、HbNIP3;1和HbNIP6;1有表达,相比起来,HbNIP1;2是表达最高的,其他3个基因表达量很低。利用乙烯利增产实验进一步分析这4个基因的表达特征(图4C),结果表明,这4个基因受诱导后转录水平变动幅度不大,但是HbNIP1;1在乙烯利处理后的12 h内,胶乳表达呈上升趋势,而HbNIP6;1呈下降趋势,而在处理12 h后,二者的表达渐近恢复。
另外,对4个在叶片中表达量高的基因成员HbNIP1;1、HbNIP1;2、HbNIP5;1和HbNIP6;1进一步分析了它们随叶片发育(4个时期—古铜期、变色期、淡绿期和成熟期)的表达情况,同时也分析了它们是否受高低温处理诱导表达。结果表明:3个基因呈现出快速递增的表达,HbNIP1;2和HbNIP6;1在淡绿期最高,HbNIP1;1在变色期和淡绿期较高,HbNIP5;1在成熟期表达最高。总之,各个成员的差异表达表明其功能的时空差异性和功能特异性(图4B)。另外,这4个基因总体上是受低温的诱导影响小于高温处理,在低温处理12 h后,它们的表达都比处理前略微下降;而HbNIP5;1和HbNIP6;1随着高温处理,表达量迅速下调2倍,HbNIP1;2则有增加趋势(图4D)。
3 讨论
3.1 HbNIPs具有植物NIPs典型的组成特征,推断是橡胶树中有功能的NIPs蛋白
HbNIPs具有植物NIPs典型的组成特征,而且聚类在一起,推断其在橡胶树中发挥着相似的功能。本研究在橡胶树全基因组水平上检索出7个NIPs,通过对比分析发现其基因结构、理化性质和聚类都与其同源基因相似,比如橡胶树的HbNIP5;1和HbNIP6;1中的2个NPA motif进化为NPS-NPV,与拟南芥AtNIP5;1和AtNIP6;1一致,因此推测二者很可能会参与硼酸的吸收和转运。在橡胶树中各个组织中表达分析表明:7个HbNIPs的组织表达量都比较低,其中HbNIP1;1、HbNIP1;2、HbNIP5;1与HbNIP6;1四个基因的表达水平较高些,它们在各个组织中各有偏重而且随着叶片发育而改变(图4B),这与其他AQP的NIPs亚家族成员的基因表达水平相对低,而且一些NIPs常常在一些特化的细胞或器官中表达是一致的。乳管中的表达情况:橡胶树NIPs在胶乳中表达水平低(图4A、C),且它们受乙烯利处理后受诱导变化小,因此推测橡胶树NIPs的主要功能很可能不是负责木质部和韧皮部的水分运输而是主要转运特殊的溶质比如硼、乳酸等。例如在树皮、雄花和雌花部位表达量较高的HbNIP1;2,是AtNIP2;1的同源蛋白,很可能其功能是选择性转运乳酸,有利于更好地适应低氧环境[35]。由于橡胶树乳管中和茎干内无氧代谢活跃[36],因此与AtNIP2;1聚在一组的HbNIP1;2很可能也参与乳酸的代谢和利用,这个与这个基因的启动子含有ARE无氧应答元件是一致的(表4)。另外,从进化分析推断(图3),如橡胶树HbNIP1;1、HbNIP1;2与拟南芥AtNIP1;2在同一进化分支上,推测其可能参与铝元素的胁迫过程[23];橡胶树HbNIP7;1和拟南芥AtNIP7;1在同一进化分支上,推测其可能提高砷元素胁迫的耐受性[37-38];橡胶树HbNIP5;1、HbNIP6;1与拟南芥AtNIP5;1和AtNIP6;1及水稻OsNIP3;1在同一个进化分支上,推测其可能参与硼酸的转运过程[39]。硼是花粉管生长、受精和信号传递等过程中必不可少的微量元素[40-41],推测这2个基因可能在橡胶树花器官内硼酸转运中发挥作用。
3.2 HbNIPs可能的調控方式与利用
已有的文献表明:AQP的功能受多种调控方式的影响,包括糖基化修饰、磷酸化修饰等,比如质膜上的OsNIP1;1[42]、大豆的GmNOD26[43]等受多种蛋白激酶CDPKs调控。吴伟等[15]启动子元件分析表明多数NIPs含有响应多种胁迫和激素应答元件,推断它们的功能会受多种调控而参与植物胁迫应答。我们对橡胶树HbNIPs启动子元件分析中发现,它们除了包括多种激素应答元件外,还具有甲基茉莉酸、无氧,光应答元件等。总之,根据综合分析,HbNIPs的活性及表达具有受发育阶段、激素及翻译后修饰等严谨控制,推测其主要功能不是或不仅是转运水,更重要的是转运尿素、甘油、硼等物质,通过调控参与营养物质吸收、转运和利用或胁迫防御,其分子机理还需要进一步去实验证实。该研究结果为进一步鉴定橡胶树NIP家族功能的挖掘和利用奠定基础。
参考文献
Maurel C, Boursiac Y, Luu D, et al. Aquaporins in plants[J]. Physiological Reviews, 2015, 95(4): 1321-1358.
Calamita G. The Escherichia coli aquaporin-Z water channel[J]. Molecular microbiology, 2000, 37(2): 254-262.
Kjellbom P, Larsson C, Johansson I, et al. Aquaporins and water homeostasis in plants[J]. Trends in Plant Science, 1999, 4(8): 308-314.
Johansson I, Karlsson M, Johanson U, et al. The role of aquaporins in cellular and whole plant water balance[J]. Biochimica et Biophysica Acta (BBA) - Biomembranes, 2000, 1465(1-2): 324-342.
Santoni V, Gerbeau P, Javot H, et al. The high diversity of aquaporins reveals novel facets of plant membrane functions[J]. Current Opinion in Plant Biology, 2000, 3(6): 476-481.
Johanson U, Karlsson M, Johansson I, et al. The complete set of genes encoding major intrinsic proteins in Arabidopsis provides a framework for a new nomenclature for major intrinsic proteins in plants[Z]. 2001, 126(4): 1358-1369.
Maurel C, Chrispeels M J. Aquaporins. A molecular entry into plant water relations[J]. Plant Physiology, 2001, 125(1): 135-138.
Wallace I, Choi W, Roberts D. The structure, function and regulation of the nodulin 26-like intrinsic protein family of plant aquaglyceroporins[J]. Biochimica et Biophysica Acta. Biomembranes, 2006, 1758(8): 1165-1175.
Tanaka M, Wallace I S, Takano J, et al. NIP6;1 is a boric acid channel for preferential transport of boron to growing shoot tissues in Arabidopsis[J]. The Plant cell, 2008, 20(10): 2860-2875.
Benga G. The first discovered water channel protein, later called aquaporin 1: molecular characteristics, functions and medical implications[J]. Molecular Aspects of Medicine, 2012, 33(5-6): 518-534.
Eriksson U K, Fischer G, Friemann R, et al. Subangstrom resolution X-ray structure details aquaporin-water interactions[J]. Ence, 2013, 340(6138): 1346-1349.
Chen Y, Sun S, Tang Z, et al. The Nodulin 26-like intrinsic membrane protein OsNIP3;2 is involved in arsenite uptake by lateral roots in rice[J]. Journal of Experimental Botany, 2017, 68(11): 3007-3016.
Gu R, Chen X, Zhou Y, et al. Isolation and characterization of three maize aquaporin genes, ZmNIP2;1, ZmNIP2;4 and ZmTIP4;4 involved in urea transport[J]. BMB Reports, 2012, 45(2): 96-101.
孫 慧, 张征宇, 王 旭, 等. 小麦NIP蛋白的生物信息学分析[J]. 分子植物育种, 2018, 16(18): 5869-5875.
吴 伟, 冯志娟, 徐盛春, 等. 大豆NIP类水孔蛋白基因的鉴定及表达特性分析[J]. 浙江农业学报, 2018, 30(7): 1101-1109.
Masataka U, Wang S, Takehiro K, et al. Identification and characterization of an Arabidopsis mutant with altered localization of NIP5;1, a plasma membrane boric acid channel, reveals the requirement for d-galactose in endomembrane organization[J]. Plant & Cell Physiology, 2014, 55(4): 704-714.
Miwa K, Tanaka M, Kamiya T, et al. Molecular mechanisms of boron transport in plants: Involvement of Arabidopsis NIP5;1 and NIP6;1[J]. Advances in Experimental Medicine & Biology, 2010, 679: 83-96.
Bienert G P, Thorsen M, Schüssler M D, et al. A subgroup of plant aquaporins facilitate the bi-directional diffusion of As(OH)3 and Sb(OH)3 across membranes[J]. Bmc Biology, 2008, 6(1): 26.
Ma J F, Yamaji N. Silicon uptake and accumulation in higher plants[J]. Trends in Plant Ence, 2006, 11(8): 392-397.
Takano J, Wada M, Ludewig U, et al. The Arabidopsis major intrinsic protein NIP5;1 is essential for efficient boron uptake and plant development under boron limitation[J]. The Plant Cell, 2006, 18(6): 1498-1509.
Isayenkov S V, Maathuis F J M. The Arabidopsis thaliana aquaglyceroporin AtNIP7;1 is a pathway for arsenite uptake[J]. Febs Letters, 2008, 582(11): 1625-1628.
纪瑞杰. CDPK31通过与NIP1;1互作调控拟南芥砷吸收的分子机理的研究[D]. 南京: 南京农业大学, 2016.
Mitani N, Yamaji N, Ma J F. Identification of maize silicon influx transporters[J]. Plant and Cell Physiology, 2009, 50(1): 5-12.
Mitani N, Yamaji N, Jian F M. Characterization of substrate specificity of a rice silicon transporter, Lsi1[J]. Pflügers Archiv European Journal of Physiology, 2008, 456(4): 679-686.
Huang Z. Overexpressing a putative aquaporin gene from wheat, TaNIP, enhances salt tolerance in transgenic Arabidopsis [J]. Plant & Cell Physiology, 2010, 51(5): 767-775.
Hideki H, Shimpei U, Junpei T, et al. OsNIP3;1, a rice boric acid channel, regulates boron distribution and is essential for growth under boron-deficient conditions[J]. The Plant Journal: For Cell and Molecular Biology, 2014, 78(5): 890-902.
张标金, 陈庆隆, 戴廷灿, 等. 水稻亚硒酸盐转运子OsNIP2;1及其家族成员的蛋白结构分析[J]. 江西农业大学学报, 2018, 40(5): 914-919.
邹 智, 莫业勇, 王丹华, 等. 橡胶死皮相关水通道蛋白编码基因的克隆与序列分析[J]. 安徽农业科学, 2013, 41(34): 13100-13102, 13114.
Kessarin T, Unchera V, Panida K, et al. Hormonal treatment of the bark of rubber trees (Hevea brasiliensis) increases latex yield through latex dilution in relation with the differential expression of two aquaporin genes[J]. Journal of Plant Physiology, 2011, 168(3): 253-262.
庄海燕, 安 锋, 何 哲, 等. 巴西橡胶树水通道蛋白基因cDNA的克隆及序列分析[J]. 西北植物学报, 2010, 30(5): 861-868.
邹 智, 王丹华, 莫业勇, 等. 橡胶死皮相关液泡型水通道蛋白基因TIP1的克隆与序列分析[J]. 安徽农业科学, 2013, 41(36): 13851-13854.
黄 娟, 安 锋, 庄海燕, 等. 橡胶树水通道蛋白基因HbPIP1;2和HbPIP2;2的克隆及序列分析[J]. 西北林学院学报, 2011, 26(6): 56-61, 113.
王 进, 安 锋, 蔡秀清, 等. 橡胶树水通道蛋白基因HbPIP1和HbPIP2的功能鉴定及其表达分析[J]. 林业科学, 2014, 50(1): 69-75.
Lescot M, Déhais P, Thijs G, et al. PlantCARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research, 2002, 30(1): 325-327.
Choi W G, Roberts D M. Arabidopsis NIP2;1, a major intrinsic protein transporter of lactic acid induced by anoxic stress *[J]. Journal of Biological Chemistry, 2007, 282(33): 24209-24218.
Tup? J, Resing W L. Anaerobic respiration in latex of Hevea brasiliensis substrate and limiting factors[J]. Biologia Plantarum, 1968, 10(1): 72-80.
Xu W, Dai W, Yan H, et al. Arabidopsis NIP3;1 Plays an important role in arsenic uptake and root-to-shoot translocation under arsenite stress conditions[J]. Molecular Plant, 2015, 8(5): 722-733.
Lindsay E R, Maathuis F J M. Arabidopsis thaliana NIP7;1 is involved in tissue arsenic distribution and tolerance in response to arsenate[J]. FEBS Letters, 2016, 590(6): 779-786.
Thorsten S, Julie H, Maria H, et al. Boron toxicity tolerance in barley through reduced expression of the multifunctional aquaporin HvNIP2;1[J]. Plant Physiology, 2010, 153(4): 1706-1715.
岳 川, 曹红利, 王 赞, 等. 茶树水通道蛋白基因的克隆与表达分析[J]. 西北植物学报, 2018, 38(8): 1419-1427.
常新菊. 甘蓝型油菜不同硼效率品种BnNIP6;1s基因的克隆及其表达研究[D]. 武汉: 华中农业大学, 2014.
Takehiro K, Mayuki T, Namiki M, et al. NIP1;1, an aquaporin homolog, determines the arsenite sensitivity of Arabidopsis thaliana[J]. The Journal of Biological Chemistry, 2009, 284(4): 2114-2120.
Guenther J F, Chanmanivone N, Galetovic M P, et al. Phosphorylation of soybean nodulin 26 on serine 262 enhances water permeability and is regulated developmentally and by osmotic signals[J]. Plant Cell, 2003, 15(4): 981-991.
責任编辑:白 净
