多花指甲兰花粉活力及柱头可授性研究
2021-09-14王清芸侯天泽徐诗涛余文刚邢孔惠王健
王清芸 侯天泽 徐诗涛 余文刚 邢孔惠 王健


摘 要:花粉和柱头特性的研究是兰花杂交育种的重要基础。本研究以多花指甲兰(Aerides rosea)为实验材料,利用扫描电子显微镜观察多花指甲不同开花时期的花粉微观形态用TTC(氯化三苯基四氮唑)、I2-KI和醋酸洋红染液并结合花粉离体培养检测不同开花时期的花粉活力,利用联苯胺-过氧化氢法测定柱头的可授性。结果表明, 多花指甲兰花粉随着开花时间的延长,花粉表面颜色变深,质地更硬,花粉粒结合更加紧密,花粉团体积变小,表面变得更加平滑致密。 多花指甲兰花蕾期花粉染色为粉红色,盛花期的花粉染色最明显,染色率最高,而衰败期的花粉几乎无法被染色,在整个开花过程中,花粉活力呈先上升后下降的趋势。柱头可授性的结果显示,盛花期柱头气泡最多最迅速,可授性最强。该研究结果为多花指甲兰的引种栽培、迁地保护提供理论基础,在花卉资源利用和产业发展上具有重要指导意义。
关键词:多花指甲兰(Aerides rosea );花粉形态;花粉活力;柱头可授性
Abstract: The study on the characteri stics of pollen and stigma is an important basis for orchid cross breeding. In this study, Aerides rosea was used as the experimental materi al to observe the micro-morphol ogy of pollen at different flowering stages by scanning electron microscope. The pollen viabil ity at different flowering stages was detected by TTC (triphenyltetrazolium chloride), I2-KI and magenta acetate staining solution combined with pollen culture in vitro, and benzidine-hydrogen peroxide method was used to determine the receptivity of stigma. The resul ts showed that with the extension of flowering time, the surface col or of A. rosea pollen became darker, the texture became harder, the pollen grains combined more closely, the pollen mass became smaller, and the surface became smoother and denser. A.s rosea pollen staining was pink in the bud stage, the pollen staining in the full flowering stage was the most obvious, and the staining rate was the highest, while the pollen in the decline stage could hardly be stained. In the whole flowering process, the pollen viabili ty increased at first and then decreased. The resul ts of stigma receptivity showed that the stigma bubbles were the most rapid and the receptivity was the strongest at flowering stage. The results of this study would provide a theoretical basis for the introduction, cultivation and ex-situ protecti on of A. rosea, and have important guiding signi ficance in the util ization of flower resources and industrial development.
Keywords: Aerides rosea; pollen morphology; pollen vitality; stigma receptivity
多花指甲兰(Aerides rosea)为兰科(Orchidaceae)指甲兰属附生草本植物,花型奇特,状似“狐尾”,花序密集,花大部白色,稍有紫色点缀其间,观赏价值高[1]。更重要的是,多花指甲兰极具芳香,独特的芳香性状也是多花指甲蘭的重要价值之一。其含有醛类、芳香族类、酯类、酮类以及萜类化合物等多种挥发性物质,可广泛应用于化妆品、美容等行业[2],近年,一家日本公司公布了其香水专利,构成其产品成分的一种主要香味物质便来自于此[3]。同时,多花指甲兰也是重要的药用兰花,在印度东北部当地部落居民有使用指甲兰属植物治疗常见疾病的习俗,孟加拉国和泰国也有相关报道[4],国内研究人员也发现指甲兰属植物有作为抗癌药物潜能[5]。多花指甲兰不仅拥有花型、花色和香味等众多优良性状,是不可多得的优秀亲本资源[6],而且在医药业、化工业也广泛运用,具有重大开发潜能。多花指甲兰常附生于乔木上,由于过度的资源开采、旅游开发等生态破坏行为,以及对其附生树种的乱砍滥伐、野生植物非法贸易,导致多花指甲兰野生种群的生存面临极大威胁。CITES(《濒危野生动植物种国际贸易公约》)将指甲兰属的所有种列入其附录Ⅱ的保护对象。我国也将其列入国家重点野生植物保护名录(第二批次)。我们应积极对其采取相关保护措施[6]。但由于种质资源匮乏等原因,国内目前较少见到多花指甲兰的相关报道,花粉形态观察和花粉活力测定以及柱头可授性更是鲜有报道,还有极大的挖掘空间。
花粉和柱头具有较高的活性是杂交育种成功的关键,目前,国内外主要使用花粉染色法和花粉离体培养测定花粉活力。常见染色方法有醋酸洋红染色法、I2-IK染色法和TTC染色法。据文献报道,最符合真实值的方法为TTC染色法[7-9];而花粉离体培养是最能反映真实值的方法[10]。柱头可授性均利用联苯胺-过氧化氢法测定[11]。当前,仅有少数研究人员以市场上常见的几种兰花为材料进行了花粉形态、花粉活性以及柱头可授性的研究。褚怡等[11]研究了大花蕙兰和几种国兰的花粉活力和柱头可授性,喻兰等[12]对蝴蝶兰的花粉活力和柱头可授性进行了测定。罗远华等[13]以20个文心兰种质为材料,对花粉活力进行测定。这些研究明确了各材料最佳的授粉时机,为兰花的杂交育种、引种栽培提供了理论指导。本文在前人的基础上对多花指甲兰的花粉形态、花粉活力以及柱头可授性开展研究,以期为多花指甲兰的杂交引入、迁地保护以及后续的应用开发提供理论指导。
1 材料与方法
1.1 材料
材料来源于云南省澜沧县(99°29′ E~ 100°35′ E、22°01′ N~23°16′ N之间),为野生种,目前种植于海南大学育苗基地(20°03′ N,110°19′ E)。使用试剂为氯化三苯基四氮唑(TTC)、I2-KI以及醋酸洋红染液。试验器材为镊子、解剖针、解剖刀、盖玻片、载玻片、10 mL离心管、恒温培养箱、光学显微镜(BA210-T)等。
1.2 方法
1.2.1 多花指甲兰花粉电镜扫描 采集花蕾期、盛花期、衰败期的多花指甲兰花粉(图1),经离子溅射仪喷金后,置于场发射扫描电子显微镜下观察(S-4800)。选取各时期花粉在30×、100×、500×的视野下观察并对各开花时期花粉块的形态结构进行拍照记录。
1.2.2 花粉活力染色测定 结合胡适宜[14]与罗远华等[13]的方法,并在此基础上进行优化,具体为用pH为7.2~7.4的10 × 0. 01 mol/L磷酸缓冲液配成0.5%的TTC溶液、I2-KI以及醋酸洋红染液取不同开花时期新鲜花粉团,将花粉捣碎于载玻片上,用镊子与解剖针使之充分分散,然后滴加适量新鲜配制的TTC染色液、I2-KI以及醋酸洋红染液,盖上盖玻片,用锡箔纸包裹黑暗处理置于35 ℃恒温箱中。24 h后在光学显微镜下观察统计花粉活力,每张片子随机计数5个视野的染色率,染成红色的为活力强的花粉,淡红色为活力弱的花粉,无活力或不育的花粉无法被染色。
1.2.3 花粉离体萌发 以钱鑫等[15]、郭丽霞等[16]的研究为基础对培养基进行优化,预实验结果表明,最适培养基为:20%蔗糖+20 mg/L硼酸+ 10 mg/L CaCl2,在25 ℃恒温中暗培养48 h之后于光学显微镜下观察花粉萌发情况,以花粉管长度超过花粉粒直径的2倍为萌发标准,并选择3个视 野进行计数。
1.2.4 柱头可授性检测 用联苯胺-过氧化氢法测定多花指甲兰柱头活性。联苯胺-过氧化氢反应液用1%联苯胺∶3%过氧化氢∶水=4∶11∶22配制,现配现用。取不同开花时期的新鲜雌蕊柱头,放入培养皿中,加入检测液使之没过柱头,反应10 min。在体视显微镜下观察气泡产生情况以及柱头变色情况。
1.3 数据处理
数据采用Microsoft office 2010及GraphPad Prism 8分析软件进行分析作图。
2 结果与分析
2.1 多花指甲兰花粉电镜扫描结果
与其他形态和生理特征相比,花粉形态保持相对稳定,因此花粉形态可以作为更好的分类和系统发育标记[14-15]。多花指甲兰花粉团附着于有柄的粘盘上,花粉呈黄色,蜡质,2个。在扫描电镜下可以清晰的观察到每个具半裂的裂隙,表面稍有凹陷,无纹饰,近球形(图2A),粘盘柄狭长,粘盘较宽(图3A)。每个花粉团均由大量形状不规则花粉粒通过类脂质粘合而成。由图2~图4和表1可知,随着开花时间延长,花粉粒皱缩,体积变小,整个花粉团体积也相应变小,花粉团表面变得更加紧密平滑。尤其是开花10 d后时,即衰败期,花粉粒表面致密平滑。
2.2 不同开花时期花粉的活力测定
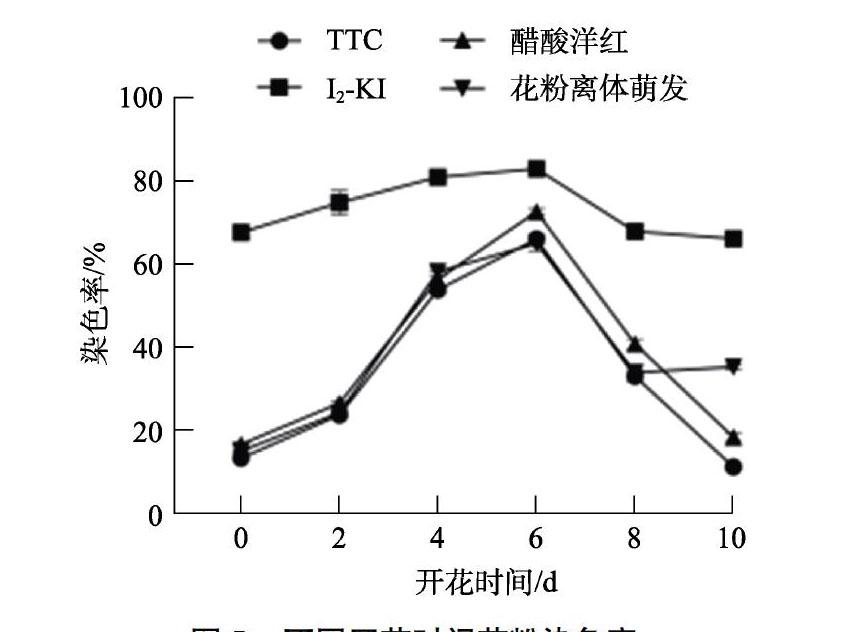
研究发现,多花指甲兰最佳染色时长为12 h。实验结果表明,TTC染色液和醋酸洋红染色效果最接近离体萌发结果,而I2-KI染液会使整个视野变红,不利于观测;开花4~6 d的花粉染色效果最好,颜色最深,染色率最高(图5),花蕾期染色较浅,呈粉红色,且染色数目较少,开花10 d的花粉几乎无法染色,染色极浅。整个花期花粉活力先上升到达最高值,之后下降,呈先升后降趋势。
2.3 不同开花时期柱头可授性研究结果
利用联苯胺-过氧化氢法测定多花指甲兰柱头可授性(表2),结果显示3个时期的柱头在检测液中均冒出气泡,其中盛花期过氧化氢酶含量最高,气泡量最大,冒出最迅速,可授性最强。花蕾期次之;衰败期最少最缓慢,可授性最弱;但3个时期的柱头均未变色。
3 讨论
花粉为植物的生殖细胞,它能反映物种演化的一般规律,花粉的性状相对稳定,其微观态结构具有种间特异性,是植物分类的重要依据之一[17-20]。
蘭科植物花粉不同于其他植物,兰科植物花粉由成千上万的花粉粒通过类脂质集合而成。花粉粒由四分体组成的,四分体是构成花粉的基本单位。不同种属兰花花粉形态、表面纹饰不一。如蝴蝶兰花粉块为梨形,中间有大缝隙,花粉块可分为两半[12];杓兰属花粉表面都有圆形凹陷,外壁结构呈光滑或褶皱状[21]。多花指甲兰花粉近球形,表面具裂隙,无纹饰,类似蜂巢,未见萌发孔。由于花粉粒结合紧密,相互挤压,花粉粒呈不规则状。随着开花时间的延长,花粉粒粘合得更加紧密,花粉团体积也相应变小。花粉活性与柱头可授性是影响杂交结实率的关键因素,本研究发现,花粉染色在开花4~6 d效果最好,花蕾期次之,衰败期几乎无法染色。花粉活性与自身遗传特性有关,罗远华等[13]研究发现不同的文心兰种质花粉活力不同。同时还与环境温度、花期长短等多种因素有关,且兰花花粉团是由花粉粒依靠类脂质聚合而成的,分离困难,一定程度上增加了实验难度。结果表明,最接近真实值的花粉染色方法为TTC染色法和醋酸洋红染色法,I2-KI的测量值远大于其他3种方法。这是由于I2-KI是根据花粉粒积累淀粉的量来判断花粉活力,而三核期退化的花粉已有淀粉积累,遇碘呈蓝色反应另外,含有淀粉而被杀死的花粉粒遇I2-KI也呈蓝色,因此,此法不能准确表示花粉的活力。
开花10 d以后TTC染液和醋酸洋红染液几乎无法将花粉染色,而花粉萌发率依然较高,这很可能是因为开花后期花粉粒结合过于紧密,类脂质阻碍了染色液的进入,导致染色困难。兰花花粉属于二核型花粉,有厚实的外壁,寿命很长,易于保存[17],不会轻易失活。兜兰、蝴蝶兰等花粉活力均表现为先上升后下降的趋势[4,12],这与我们的研究结果一致。柱头可授性的结果显示多花指甲兰开花5 d可授性最好,但3个时期的柱头在检测液中均未变色,该现象在其他植物中也有出现,如苏芸芸[22]用同种方法研究了藿香的柱头可授性,亦只见气泡,未见柱头变色。多花指甲兰花粉活力最高时期与柱头可授性时期一致,可选择开花4~6 d时对多花指甲兰进行人工授粉。
洋兰的野生种大都艳而无香,因而培育有香味的洋兰品种是今后洋兰育种的主要目标之一[23-24]。黄金小神童是花香引入的典范,为大花蕙兰与四季兰素心的杂交种[25],气味幽香。多花指甲兰花香清幽、花型美丽,后期可大力开展该种与其近缘种属之间的杂交育种研究。
参考文献
中國科学院《中国植物志》编委会. 中国植物志: 第19卷[M]. 北京: 科学出版社, 1999.
Kaiser R. On the scent of orchids: Acs symposium series(Vol 203)[M]. Amsterdam: Elservier, 1993: 240-268 .
Matsuda H, Hakama T A T, Ujihara H, et al. Fragrance composition: US, 20150275131[P]. 2015-10-08 .
Pal R, Meena N K, Dayamma M, et al. Ethnobotany and Recent Advances in Indian Medicinal Orchids[M]. Cham: Springer, 2019.
济南星懿医药技术有限公司. 一种防治结肠癌的药物组合物及其制备方法: 20161502021A[P], 2016-6-30.
王 玉, 温福岳, 陈利君, 等. 指甲兰属种质资源概况及其研究进展[J]. 广西植物, 2018, 38(7): 960-968.
宋一岚, 张英杰, 孙纪霞, 等. 兜兰花粉活力及柱头可授性研究[J]. 安徽农业科学, 2019, 47(13): 53 -55.
Douglas A C, Freyre R. Floral development, stigma receptivity and pollen viability in eight Nolana (Solanaceae)species[J]. Euphytica, 2010, 174(1): 105-117 .
杨 芩, 万兴权, 李东平, 等. 温度对“杰兔”兔眼蓝莓花粉活力及柱头可授性的影响[J]. 北方园艺, 2017(14): 39-43.
罗卿清, 郑 钢, 顾翠花, 等. 黄薇花粉活力及柱头可授性[J]. 浙江农林大学学报, 2020, 37(1): 182-187.
褚 怡, 范义荣, 张韶伊, 等. 大花蕙兰与国兰花粉活力及
柱头可授性分析[J]. 浙江农林大学学报, 2013, 30(6): 950-954.
喻 兰, 李 杰. 蝴蝶兰花粉活力及柱头可授性研究[J]. 中国农学通报, 2017, 33(11): 54-58.
罗远华, 黄敏玲, 林 兵, 等. 文心兰花粉活力与杂交结荚性研究[J]. 福建农业学报, 2015(3): 258-263.
胡适宜. 植物胚胎学实验方法(一)花粉生活力的测定[J]. 植物学通报, 1993, 10(2): 60-62 .
钱 鑫, 刘 芬, 牛晓玲, 等. 无距虾脊兰花粉离体萌发及储藏条件的研究[J]. 西北植物学报, 2014, 34(2): 341-348.
郭丽霞, 莫 饶. 海南原生墨兰花粉萌发试验初报[J]. 中国农学通报, 2007, 23(6): 594-597.
Healey P L, Michaud J D, Arditti J. Morphometry of orchid seeds. III. native claifornia and related species of Goodyera, Piperia, Platanthera and Spiranthes[J]. American Journal of Botany, 1980, 67(4): 508-518 .
王伏雄. 中国植物花粉形态[M]. 北京: 科学出版社, 1997.
Dressler R L. Cambridge[M]. Mass: Harvard University Press, 1981.
Ackerman J D, Williams N H. Pollen morphology of the Chloraeinae (Orchidaceae: Diurideae) and related subtribes[J]. Amer J Bot, 1981(68): 1392-1402 .
陈丽飞, 赵和祥, 顾德峰, 等. 5种杓兰属植物花粉的微形态扫描电镜观察[J]. 江苏农业科学, 2013, 41(9): 161-163 .
苏芸芸. 不同产地藿香花粉活力与柱头可授性研究[J]. 草业学报, 2016, 25(9): 189-196 .
王爱芝, 王清君, 李长海, 等. 花楸的传粉生物学研究[J]. 北方园艺, 2020(2): 73-79 .
程金水. 园林植物遗传育种学[M]. 北京: 中国林业出版社, 2000 .
姚 婧, 覃宝祥, 刘 帆, 等. 冬凤兰与“黄金小神童”大花蕙兰杂交后代的观赏性评价[J]. 热带作物学报, 2015, 036(7): 1201-1206 .
责任编辑:白 净
